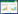文章信息
- 孔祥吉, 韦笑, 王娜, 卜元卿, 单正军
- KONG Xiang-ji, WEI Xiao, WANG Na, BU Yuan-qing, SHAN Zheng-jun
- 聚氧乙烯型非离子表面活性剂类农药助剂的环境行为特性综述
- A Review on the Environmental Behavior of the Polyoxyethylene Type Nonionic Surfactants Adjuvants in Pesticides
- 农业资源与环境学报, 2017, 34(3): 197-206
- Journal of Agricultural Resources and Environment, 2017, 34(3): 197-206
- http://dx.doi.org/10.13254/j.jare.2017.0013
-
文章历史
- 收稿日期: 2017-01-10
2. 国家环境保护农药环境评价与污染控制重点实验室, 江苏 南京 210042;
3. 南京信息工程大学, 江苏 南京 210044
2. Laboratory of Pesticides Environmental Assessment and Control, Nanjing 210042, China;
3. Nanjing University of Information Science & Technology, Nanjing 210044, China
助剂是指农药制剂中除了活性成分外的其他组分。其定义是“可促进或改进农药配方中活性成分作用效果的辅助成分”[1]。一般来说,添加助剂的主要目的是增大活性成分的溶解度、或增加成分间的相容性,进而提高农药制剂的作用效果(或生物利用率)。助剂的其他作用还包括增强活性成分对靶标的吸附、渗透、移位能力,增加耐雨蚀性,以及改变活性成分对不同植物的选择性作用[2]。除溶剂外,数量最大的助剂类型是表面活性剂,尤以非离子表面活性剂居多。
典型的聚氧乙烯型非离子表面活性剂主要分为烷基酚聚氧乙烯醚(APEOs)、醇基聚氧乙烯醚(AEOs)、以及烷基胺聚氧乙烯醚(ANEOs)[3]三大类。其中,AEO类的结构式为:
CH3(CH2)m-1O(CH2CH2O)nH(CmEOn)
APEO的结构式:
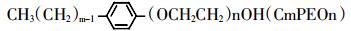
|
ANEO的结构式为:
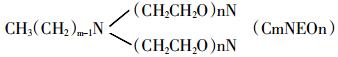
|
代表化合物有:蓖麻油聚氧乙烯醚,壬基酚及辛基酚聚氧乙烯醚,脱水山梨醇聚氧乙烯醚,牛脂胺聚氧乙烯醚,烷基酚聚氧乙烯醚,脂肪酸聚氧乙烯醚,聚氧乙烯/聚丙乙烯嵌断共聚物。
当前,关注助剂的环境归趋及生态风险的报道不多。本文以典型的聚氧乙烯型非离子表面活性剂——AEOs、ANEOs和APEOs为重点,对其在环境中的暴露、环境行为、归趋的相关研究进展作以综述。
1 表面活性剂类助剂的来源与暴露水平表面活性剂作为助剂,已广泛应用于工业、农业和日常生活中。2005年,全球表面活性剂消耗量1 250万t[4],而到2014年,已达到2 060万t[5]。非离子表面活性剂占总消耗量的37%~40%。这些表面活性剂混杂在未经处理的污水、污水厂排水及污泥进入环境中[6]。以壬基酚聚氧乙烯醚(NPEOs)为例,其是一种去污力和脱脂力优异的非离子表面活性剂,全球每年的需求量超过70万t。在其广泛应用的同时,也带来了环境安全隐患:其在水体环境中很容易分解为壬基酚(NP)——具有持久性并且会干扰内分泌系统的化学物质,能够通过食物链不断蓄积,具有较大的环境危害风险。因此,目前在欧洲,NPEOs已被限制使用。
农药助剂种类数量巨大,使用量惊人,世界农药工业协会统计显示,每年全球通过使用农药投入到环境中的有机助剂超过100万t;其中非离子表面活性剂助剂的使用量不容忽视,US EPA调查显示农药助剂在制剂中的含量1%~99%不等,平均含量约为70%。农药助剂的表面活性剂使用负荷大小取决于作物类型、喷药次数、以及所用配方[7-8]。如在丹麦农业区,用作助剂的表面活性剂的使用负荷在0.3~0.4 kg·hm-2·a-1 [9]。与家庭及工业暴露源不同,随农药喷洒在土壤中的表面活性剂在其中发生降解,其吸附性和毒性不容乐观。径流、淋溶、吸附和生物降解是助剂主要的扩散途径和环境行为。助剂随雨水输移的途径包括垂直和水平方向,最终扩散到地表水,或垂直渗入地下水。助剂的另一种归趋是吸附到土壤或生物质中,例如植物根部、植物碎屑或土壤微生物。
在地表水(河流、湖泊、沿海)中检测到NPEOs及其降解产物的质量浓度分布情况为:NPEO1 < NPEO3 < NPEO2[10-14],韩国工业区附近河水中NP、NPEO/NPEO2的总含量0.32~875 μg·L-1 [15]。大部分AEOs及NPEOs在地表水中的浓度要明显高于地下水,在土壤间隙水中的浓度水平随着深度的增加而降低[16-18]:C12EO3-9聚氧乙烯醚同族体在浅层地下水(地表水位2~3 m)中总浓度为710 ng·L-1。而深层间隙水中的总浓度为194 ng·L-1 [19]。瑞士Glatt河两岸垂直深度在2.5~14 m范围内的地下水中NPEO1的平均浓度从7.5 μg·L-1减至0.1 μg·L-1,NPEO2从82 μg·L-1减至0.1 μg·L-1 [20]。近年Carmen等[21]、Castillo等[22]的研究也得到了类似的结论。
污水厂的排放的污水和污泥是环境中表面活性类助剂的主要来源。有研究表明,污水厂排放水中AEOs浓度为6.5 μg·L-1 [23],污水污泥中浓度为10~190 mg·kg-1 [24]。污水处理工艺中,厌氧/好氧活性污泥法(A/O法)对3种污染物(AEO1、AEO2和AEO3)的去除率明显高于生物滤池法(BAF),活性污泥中3种污染物的总浓度最大为2.7 mg·kg-1 [25]。希腊的两个大型污水处理厂的各级污水处理工艺对NP、NPEO1和NPEO2的去除率达到70%以上[26]。土耳其城市污水处理厂污水污泥中NPEOs及其代谢物(NP+NPEO1+NPEO2)的总浓度在5.5~19.5 μg·kg-1 [27]。该含量仍在该国法定限值内。天津海河污水处理厂NPs类物质在进水中的总浓度47.2 μg·kg-1,出水中NP的平均浓度在2.92 μg·kg-1 [28],纳污的地表水中NPEO2的浓度为最高,平均浓度达1.38 μg·kg-1。沉积物中NPs类物质总含量在4.1~9.9 mg·kg-1。季节变化对污水及污泥中APEOs(或AEOs)类物质的分布和去除影响也较大:一般冬季NPEOs的浓度较高,进水中浓度NPEO1 < NPEO2。污水工艺对3类物质的去除效率变化趋势为:NP,冬季>夏季>秋季>春季;NPEO1,春季>夏季>秋季>冬季;NPEO2,夏季>秋季>冬季>春季[29-32]。
典型农药助剂在地表水及污水中的分布状况见表 1。
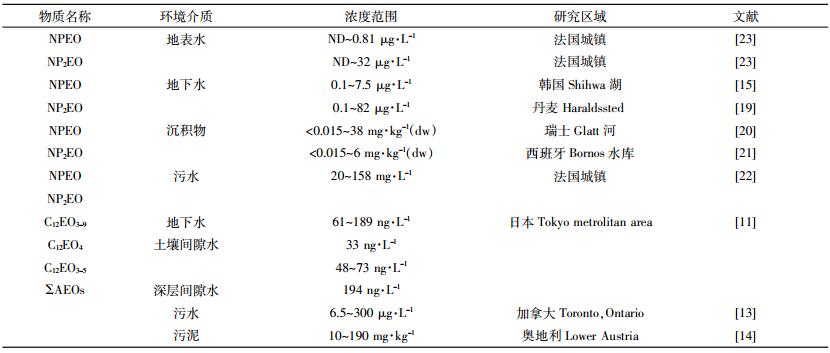
|
总体上,非离子表面活性剂的分布水平由于区域和存在介质的不同而有较大差异:工业区附近的水体中的浓度较高;污泥中的相对浓度要远高于污水。因此,污泥在资源化利用的同时,要充分考虑其中有潜在危害的非离子表面活性剂的含量。
2 聚氧乙烯型非离子表面活性剂类助剂的结构与其环境特性的关系典型的聚氧乙烯型非离子表面活性剂在水/辛醇(土壤/沉积物/植物)中的临界浓度(CMC值)、分配系数(KOW(辛醇/水)和KSW(土壤或沉积物/水))在很大程度上决定其在环境中的归属[33]。通常,AEOs和APEOs两类化合物的烷基链越长、醚键越短,CMC值越小。醚键越长、烷基链越短,化合物的KOW值越小,水溶性越大,对应KSW越小。APEOs的溶解度主要取决于亲水的EO基团的数量。通常认为EO数少于5的APEOs是不溶于水的,即亲脂性的;EO数多于5的APEOs是亲水的。同时,憎水基团的性质也对整个分子溶解性有重要影响。20.5 ℃时,辛基酚聚氧乙烯醚OPEO1-4在水中的溶解度为8~24.5 mg·L-1,壬基酚聚氧乙烯醚NPEO1-4为3.02~9.48 mg·L-1。OPEO1-4的溶解度明显高于NPEO1-4,说明R的长度对APEOs溶解度有一定的影响。
图 1阐释了AEOs和ANEOs各种可能的结合形式[34]。这些表面活性剂分子中的亲水基团和疏水基团与土壤中的成分有不同的结合形式,例如和土壤中的各种成分以氢键(H binding)或疏水键(hydrophobic)结合。对于AEOs而言,疏水的烷基链可通过疏水键吸附到有机物上(图 1A),而亲水的乙氧基链中含有结合氧,可通过氢键结合到土壤中极性更强的粘土矿物质上。ANEOs和土壤中的成分结合的形式与AEOs的情况是相似的(图 1B)。由于ANEOs由两条乙氧基链构成,因此,和AEOs相比,ANEOs和土壤中的粘土矿物或者其他极性成分的结合力会更强。此外,对于ANEOs而言,亲水基团和疏水基团通过一个氮原子连接,AEOs则是通过氧原子连接。在分子的pKa值和土壤环境pH值适宜情况下,ANEOs中的氮原子可能会发生质子化。质子化的ANEOs可能形成离子键,同时也可以去质子化与土壤中的矿物质络合(图 1B)。
AEOs可吸附于粘土,尤可吸附于吸水膨胀类粘土矿物及其他含氧矿物表面,如在蛭石和蒙脱石及沉积层[35-36]中AEOs吸附性较强。正如图 1中所示,吸附的可能原因是化合物的乙氧基链和硅酸盐矿物间形成了氢键。和砂质土相比,粘土类土壤更容易吸附这类物质。按Valoras等[37]的解释,其原因是粘土比砂土的表面积更大。此外,若砂土中硅酸盐矿物的含量较低,则与AEOs的结合力也会降低。
具有较长乙氧基链的AEOs同系物与土壤组分间的亲和力也更高。乙氧基官能团和极性土壤取代基间的极性结合力(如氢键)可能是这类化合物土壤吸附的主要机制[38]。AEOs分子中的乙氧基和聚乙二醇(PEG)中的完全相同,因此这两种物质的理化特性相近。和AEOs一样,乙氧基链越长的PEG对沉积物的吸附能力也更强[39]。乙氧基链越短的AEOs的沉积物吸附性和吸附等温线的线性关系会降低[40]。如图 1中的键合原理所示,乙氧基链增长会增加氢键形成的概率。Cano等[35]研究发现了与之相反的结论:和EO链较长的AEOs相比,EO链较短的AEOs在单位质量沉积物上的吸附性更强,但吸附总量差别不大。
除乙氧基链长度外,分子中烷基链的数量也是影响AEOs吸附性的重要因素[41]。即随着具有疏水性的烷基链长度的增加,疏水键的结合力增加,同时削弱化学物质分子中亲水部分产生的斥力(图 1)。Urano等[42]研究发现,AEOs的吸附性和沉积物中有机碳的含量成正比,但也有研究表明,沉积物或土壤中有机质含量与AEOs的吸附量并无相关性。造成该截然相反的结论原因可能是:所用沉积物中有机碳含量存在差异。
除少数几种土壤外,低pH值会增加AEOs在土壤中的吸附性,这对于具有较长乙氧基链的AEOs分子最为明显[43]。pH值可能是影响ANEOs吸附性的关键因素,是这些化合物在氮原子处发生质子化(图 1B)。ANEOs的典型pKa值在5~7之间,因此在常规pH值条件下,氮会部分质子化[44]。
此外,表面活性剂浓度与其CMC比值也会影响其吸附性。在比值>1的情况下,表面活性剂会聚合形成胶束,与底质(如土壤颗粒)键合。
对AEOs的吸附动力学研究表明,该类化合物的吸附和解吸过程迅速且可逆。Cano等[45]发现,在24 h之后,吸附和解吸就基本达到了平衡。
刘光明等[46-47]采用天然蒙脱土对APEOn物质NPEO9,NPEO10进行吸附,表明APEOn在蒙脱土上有较高的吸附量,吸附等温线为S型,符合兰格缪尔吸附模型,且吸附量大小为NPEO9>NPEO10,温度对吸附影响较大,升温有利于吸附的进行。pH值对吸附的影响较小,动力学拟合结果表明,APEO在蒙脱土上的吸附符合假二级反应动力学。NPEO1和NPEO2的吸附主要在浅层土壤0~10 cm;而壬基酚的扩散范围更大,在0~20 cm;在黑土、潮土和红土中,助剂扩散以0~5 cm为主体,其吸附常数k值小于100,移动性较差[48]。
总体上,决定非离子表面活性剂APEOs和AEOs在固体基质中的吸附性主要取决于3个方面:(1)自身结构特性,包括疏水性的化学键长度,以及浓度;(2)介质的特性,包括比表面积、有机质含量、矿物盐含量等;(3)环境特性,如温度、pH值等,客观研究其在某一介质中的吸附性,必须综合考虑以上几点。
2.2 聚氧乙烯型非离子表面活性剂对农药类化合物环境归趋的影响聚氧乙烯型非离子表面活性剂吸附到土壤后,会对土壤的理化特性及生物学特性产生影响。影响土壤中农药或其他污染物迁移性的关键因素是其自身的疏水性,及表面活性剂的浓度。当土壤中非离子表面活性剂浓度在CMC浓度附近时,农药二嗪磷、阿特拉津、以及乙酰甲胺磷的迁移性降低[49-50]。但在表面活性剂浓度较高(5~50 g·kg-1)的情况下,农药的移动性增强。此外,渗透水中高浓度的表面活性剂浓度(50 g·L-1)也会增强农药的移动性[51]。向土壤中添加非离子表面活性剂会降低农药的移动性,这些农药先被表面活性剂吸附,后吸附到土壤中。相反,由于胶束的吸附作用,淋溶水中添加表面活性剂可能会增强农药的移动性。
除移动性外,农药的降解性也会受到表面活性剂的影响。非离子表面活性剂(鼠李糖脂和聚乙二醇辛基苯基醚Triton X-100)存在的情况下,农药阿特拉津和蝇毒磷的降解速度变慢,同时降解率下降[52]。
尽管目前对于非离子表面活性剂改变其他化学物质环境归趋的影响研究不多,但这一特性可用于污染土壤的修复,在控制其有效浓度范围情况下,可降低污染物在土壤中的吸附性,促进污染土壤自身功能的恢复。
3 聚氧乙烯型非离子表面活性剂类助剂的生物降解特性聚氧乙烯型非离子表面活性剂在土壤中的降解是一个非常复杂的过程,会受到其自身性质以及土壤性质的影响,降解可分为化学降解和生物降解。在化学降解过程中,最常见的是光解作用,另外水解、热解、化学氧化、化学络合等也会有一定的作用。本文重点关注生物降解特性。
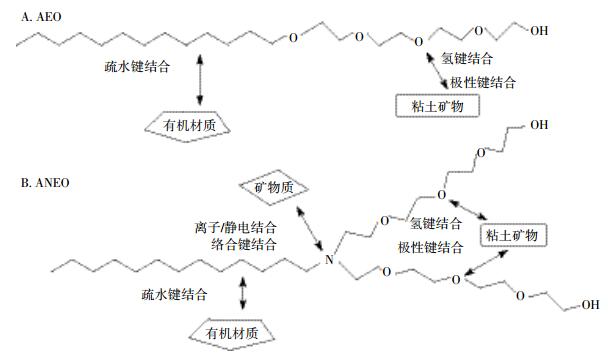
3.1 生物降解机制化学物质的生物降解途径取决于氧化还原电势。已有研究提出了AEOs的多种好氧生物降解途径[5, 53-55](图 2)。AEOs生物降解试验表明,疏水的烷基链将最先被降解,而聚氧乙烯部分的降解速度较慢。降解开始后,烷基链末端的甲基官能团最先氧化(ω-氧化)成酸,后C2官能团发生β-氧化(图 2中的途径A),链进一步缩短。
图 2中途径A始于烷基链的ω/β氧化,后发生双键非氧化断裂;途径B先是中心裂解为烷基链和聚乙烯醚键,后分别降解;途径C始于乙氧基链断裂。
Patterson等[56]通过降解机制研究发现:AEOs首先裂解为疏水和亲水两部分,之后疏水基团迅速氧化(图 2中的B途径)。Steber等[57]以14C示踪研究十八烷酰聚氧乙烯醚的降解机制,发现烷基链末端甲基官能团的断裂和分子的水解断裂反应同时发生,并且烷基链的降解速度比乙氧基链的降解速度快得多。
对于支链AEOs而言,水解会受到邻近醚键的影响,进而导致烷基链的裂解和氧化速度变慢。Di Corcia等[58]的研究结果确认了醚键的空间位阻效应导致支链AEOs的裂解速率变缓的结论。同时还发现生物降解是从分子的亲水端开始的。聚氧乙烯醚最常见的一种降解方式是C2-乙氧基键的非氧化裂解(形成CmEOn-1),另一种方式是末端醇基团氧化形成CmEOnC(乙氧基的羧酸化)。在乙氧基链缩短的同时,烷基链也会缩短。疏水链的降解主要通过β以及ω/β-氧化进行,在两端形成羧酸化的中间产物(即,CCm-3EOn-2或CCm-3EOnC)。
采用14C示踪的AEOs降解试验表明,直链AEOs的两种生物降解方式会同时发生。降解过程包括表面活性剂分子内部的断裂以及烷基链的氧化(ω/β-氧化,图 2中的途径A和途径B)。每个降解阶段伴随不同的反应机制,这表明AEOs的完全降解需不同菌群的共同作用。
AEOs的厌氧生物降解从乙氧基链的自由端开始,逐渐释放C2官能团,直到疏水基团形成为止(图 2途径C)。在厌氧条件下,观察到乙氧基链在解聚过程中发生中央裂解反应,这种反应的具体过程和好氧条件下基本相同。值得注意的是,厌氧时不会发生烷基链末端的ω-氧化。
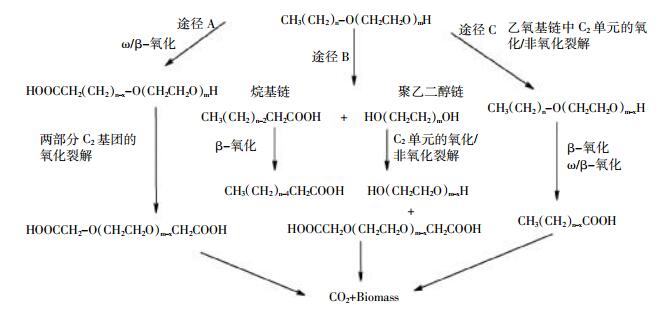
ANEOs的生物降解可以用“两步”法概括(图 3)。第一阶段是快速的中央裂解,第二阶段是中间体的降解[59],中间体醛类和胺类的降解分别需要不同的功能菌群。第二阶段降解速度相对较慢,在这个阶段内乙氧基仲胺中间体和醛类中间体同时降解,ω/β-氧化不会对生物降解的速率产生影响[60]。
国外多名研究者对聚氧乙烯醚类表面活性剂类助剂(AEOs和APEOs)的生物降解数据进行了总结[61-67]。通常,这两类表面活性剂的降解速率取决于多种因素,其中关键因素包括:微生物的测试条件、微生物的耐药性、测试物引入接种体以及测试装置的方法、接种物的来源及数量、微生物群落的种类、培养基浓度等。生物降解过程分析主要考虑降解程度、反应终点等因素。降解过程分为初级降解和完全降解(矿化)。在初级生物降解中,受试物的理化特性会发生变化。因此,这类试验主要检测母体分子是否消失,及其主要特性(例如,发泡性以及表面张力)是否发生变化(消失)。
污水系统中APEOs的降解历程:微生物代谢常常是先攻击烷氧基链,而非苯环或者疏水链。随着聚氧乙烯链的变短,形成的产物脂溶性增加而更具有耐生物降解性。整个过程如图 4所示。母体APEOs转换成难降解的具有雌激素活性的短链APEOs,NPEnC和AP代谢物,通过次级排放,进入水生环境。烷基酚趋于分离进入河流的沉积层,在河床发现其浓度大大高于水体中的浓度。端羟基的羧基化产生烷基苯氧基羧酸是APEOs生物转化过程中的重要步骤。Ahel等[67]发现在以APEOs为唯一碳源的微生物振荡培养中,经过23 d达90%的APEOs转化成APEnC,而这些短链的羧酸盐具有更高的水溶性,进入饮水中的可能性增大。
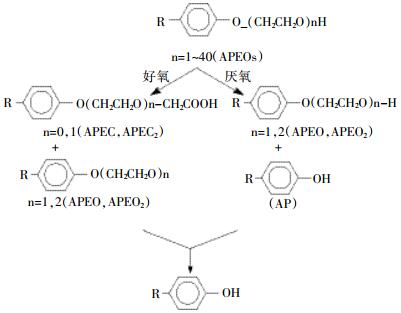
|
| 图 4 APEOs的好氧和厌氧生物降解过程 Figure 4 The aerobic and anerobic biodegradation process of APEOs |
因此,同其他具有环境激素效应的污染物类似,对于APEOs类表面活性剂,其代谢物毒性要远高于母体的情况下,仅关注于其初级降解速率对于充分评价其环境降解性的是远远不够的。
3.2 污水污泥、土壤以及沉积物中的生物降解摇瓶法对直链AEOs(C12EOn)的好氧降解试验表明,在其接近CMC值浓度下的生物降解速率和浓度之间具有显著的相关性。在C10EO8的浓度增加到高于临界胶束浓度之后,观察到降解速度有所降低[68]。与单体表面活性剂分子相比,胶束态的表面活性剂的生物降解率相对更低。这主要是由于胶束结构会妨碍表面活性剂分子和微生物的接触,或使微生物失去活性(因为表面活性剂可以破坏微生物的细胞膜)。
Kravetz等[65]研究测试的1种AEO在11种性质不同土壤中的生物降解性,发现该AEO能够迅速矿化。测试土壤包括砂质土、壤砂土、壤土以及淤泥等多种类型。气候对降解速率的影响实验表明,如果土壤在降解试验之前进行润湿和干燥的循环处理,则其生物降解速度会大大增加[65]。Knaebel等[69]研究了土壤深度对AEOs矿化的影响程度表明,在表土层(地表2.5 m以内)中,AEOs会迅速降解,而深层土壤中,其降解速度大幅度降低。
吸附对生物降解性的影响研究表明,非离子表面活性剂降解率最高的土壤就是吸附性最低的土壤[65]。表面活性剂也可能吸附在微生物上。在以73%、23%以及15%的比例将乙氧基链长度为5、10以及17的十八烷醇的AEO混合10 min后,观察到AEOs首先吸附到了微生物表面,才进一步发生生物降解。水中灭菌后的活性污泥和阴离子表面活性剂都不会抑制C12EO10和十八烷醇AEOs的生物降解速率[66-67]。事实表明,阴离子表面活性剂还会加大AEOs的生物降解率。
改变土壤-水混合物中的土壤成分,会发现不同的土壤成分会影响降解速率和最终的降解率[68]。在加入矿物质(蒙脱石、高岭土、伊利石以及砂子)的情况下,AEOs的初始矿化速度为k1=0.33±0.5 d-1,而在加入腐植质和腐植酸的情况下k1分别为0.15、0.09 d-1,都比无矿物质添加系统的降解速率(k1=0.68 d-1)低[68]。AEOs结合到蒙脱石和腐植酸的过程比结合到高岭土、伊利石砂土以及腐植酸的过程更具不可逆性,同时,吸附到蒙脱石和腐植酸的AEOs的矿化度也较低。
有研究指出[69],当初始NPEO、NPEO2和NP的浓度为30.3、17.5 mg·kg-1和19.3 mg·kg-1的污水污泥施用到土壤中后,受到土壤中微生物的降解作用影响,63 d后土壤中的污染物浓度分别降到0.57、0.66 mg·kg-1和0.27 mg·kg-1。
综上,非表面活性剂在土壤中的降解性除与土壤中微生物浓度、其他化学物质的浓度以及土壤类型均有较大关系,在此条件下,研究微污染土壤中的生物降解性更具有实际意义。
3.3 水中的生物降解在土壤/地下水系统中加入土著微生物后,当体系中加入氮和磷之后,AEOs生物降解速度得到的显著改善[70]。江口水体中AEOs降解研究表明,C16EO3(采用碳-14示踪烷基链)的平均半衰期为2.3 d[71],其降解速度基本和浓度无关。而C12EO9(采用碳-14示踪乙氧基链)的降解机理相对更为复杂:在0.42 μg·L-1浓度下,其最终生物降解半衰期为5.8 d,在3.9 μg·L-1浓度下,在使用酶活化时,其平均半衰期相对更长。
佟玉洁等[72]采用BOD快速测定法研究了在天然河水中NPEO的生物降解速率,发现在初始浓度为100 mg·L-1时,其生物降解速率为0.010 3 h-1,降解半衰期t1/2为67 h。
不同种类的非离子表面活性剂(APEOs,AEOs和ANEOs)水中降解速率和其初始浓度的关系还有待于进一步试验研究总结。
4 结论与展望AEOs、APEOs和ANEOs三类化合物结构形式相似,同时又具有各自独特的理化特性,在实际应用中都是以混合态形式使用的,因此进行各自的环境评估难度较大。
pH值对ANEOs化合物(pKa6~7)环境归趋影响明显:较低的pH值条件下(pH2~4),ANEOs分子中的N会发生质子化;较高pH值条件下(pH10~12)这类物质是中性的。与其相反,AEOs不存在pH值依赖性。
常温下ANEOs在土壤中的最终降解半衰期约为20~40 d,在污泥和污水中的降解期相对更长。AEOs在土壤中的降解速率很大程度上取决于土壤的类型及深度,其降解半衰期约为30~40 d。同样,ANEOs的降解性也在很大程度上取决于土壤性质。AEOs、APEOs和ANEOs的初级降解速率较快,但深度降解速率较低,并且中间体毒性往往超过母体。这些物质的移动性较差,其通过土柱淋溶到地下水的可能性较低。
这几类典型非离子表面活性剂的吸附性与其降解性关系密切,因此其在土壤中的浓度应与其环境归趋结合起来考虑。随着典型聚氧乙烯型非离子表面活性剂助剂的农药制剂用量逐渐增加,在土壤和沉积物的吸附性(解吸性)的影响参数(如温度、湿度和微生物量)上需要进行更多的研究,同时,还应进一步研究其在水体表层、水中悬浮颗粒物、水体沉积物及生物体内的吸附解吸、富集、释放、降解等行为,明确这几类化合物在水生生态系统中的迁移、转化;以及扩展研究与其他化学污染物共存时,浓度对彼此在环境基质中的吸附性、降解性的影响,以对这一类污染物进行有效防治;此外还要进一步开展污泥资源化利用中这一类物质的环境风险评价,以降低污泥资源化利用的生态健康风险。
| [1] | Foy C L. Adjuvants:Terminology, classification, and mode of action[M]//Chow P N P, Grant C A, Hinshalwood A M, et al. Adjuvants and agrochemicals, CRC Press, 1987:1-15. |
| [2] | Foy C L. Progress and development in adjuvants use since 1989 in the USA[J]. Pestic Sci, 1993, 38: 65–76. DOI:10.1002/ps.v38:2/3 |
| [3] | Foy C L. Adjuvants-current technology and trends[M]//Foy C L, Pritchard D W, et al. Pesticide formulation and adjuvant technology, Boca Raton, FL, CRC Press, 1996:323-352. |
| [4] | Ji Shixiang. Enhance the ability of independent innovation to take sure detergent industry develop placidly and quickly[C]//2006 The 9th international conference on surfactant & detergent proceedings, Shanghai:Cassdi & Ridci, 2006:1-5. |
| [5] | 智研咨询集团. 2016-2022年中国表面活性剂行业市场供需预测及投资战略研究报告[R]. 2015. Zhiyan Consulting Group. China surfactant market forecast and investment strategy report in 2016-2022 years[R]. 2015. (in Chinese) |
| [6] | 马兴杰, 邵兵, 胡建英, 等. 壬基酚聚氧乙烯醚在污水处理过程中的迁移转化行为[J]. 环境科学, 2002, 23(5): 80–83. MA Xing-jie, SHAO Bing, HU Jian-ying, et al. The transformation of nonylphenol ethoxylates in sewage treatment[J]. Enviromental Science, 2002, 23(5): 80–83. (in Chinese) |
| [7] | Hewin International. Surfactants and other additives in agricultural formulations[M]. USA: Wiley, 1999: 100. |
| [8] | Lokke H. Detergenter er ogs a tilsatningsstoffer til pesticider[J]. DJF Rapport, 2000, 23: 79–85. |
| [9] | Madsen T, Boyd H B, Nyl_en D, et al. Environmental and health assessment of substances in household detergents and cosmetic detergent products[M]. Copenhagen: Miljostyrelsen, 2001: 1-240. |
| [10] | Petrovic M, Femandez-Alba A R, Borrull F, et al. Occurrence and distribution of nonionic surfactants, their degradation products, and linear alkylbenzene sulfonates in coastal waters and sediments in Spain[J]. Environ Toxicol Chem, 2002, 21(1): 37–46. DOI:10.1002/etc.v21:1 |
| [11] | Isobe T, Nishiyama H, Nakashima A, et al. Distribution and behaviour of nonylphenol, octylphenol, and nonylphenol monoethoxylate in Tokyo metropolitan area:Their association with aquatic particles and sedimentary distributions[J]. Environ Sci Technol, 2001, 35: 1041–1049. DOI:10.1021/es001250i |
| [12] | Kuch H M, Ballschmitter K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range[J]. Environ Sci Technol, 2001, 35: 3201–3206. DOI:10.1021/es010034m |
| [13] | Lee H B, Peart T E, Gris G, et al. Endocrine-disrupting chemicals in industrial wastewater samples in Toronto, Ontario[J]. Water Qual Res J Can, 2002, 37(2): 459–472. |
| [14] | Fuerhacker M, Scharf S, Pichler W, et al. Sources and behaviour of bismuth active substances (BiAS) in a municipal sewage treatment plant[J]. Sci Total Environ, 2001, 277(1-3): 95–100. DOI:10.1016/S0048-9697(00)00866-4 |
| [15] | Minkyu C, Edward T F, Hyo B M, et al. Contamination of nonylphenolic compounds in creek water, wastewater treatment plant effluents, and sediments from Lake Shihwa and Vicinity, Korea:Comparison with fecal pollution[J]. Chemosphere, 2011, 85: 1406–1413. DOI:10.1016/j.chemosphere.2011.08.016 |
| [16] | Guo F, Liu Q, Qu G, et al. Simultaneous determination of five estrogens and four androgens in water samples by online solid-phase extraction coupled with high-performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2013, 1281: 9–18. DOI:10.1016/j.chroma.2013.01.044 |
| [17] | Jakimska A, Huerta B, Bargan'ska, et al. Development of a liquid chromatography-tandem mass spectrometry procedure for determination of endocrine disrupting compounds in fish from Mediterranean rivers[J]. J Chromatogr A, 2013, 1306: 44–58. DOI:10.1016/j.chroma.2013.07.050 |
| [18] | Berlioz-Barbier A, Vauchez A, Wiest L, et al. Multi-residue analyisis of emerging pollutants in sediment using QuEChERS based extraction followed by LC-MS/MS analysis[J]. Anal Bioanal Chem, 2014, 406: 1259–1266. DOI:10.1007/s00216-013-7450-8 |
| [19] | Krogh K A, Vejrup K V, Mogensen B B, et al. Liquid chromatographymass spectrometry method to determine alcohol ethoxylates and alkylamine ethoxylates in soil interstitial water, groundwater and surface water[J]. J Chromatogr A, 2002, 957: 45–57. DOI:10.1016/S0021-9673(02)00077-8 |
| [20] | Msrcmini A, Stelluto S, Psvoni B. Determination of linear alkylben-zenesulphonates and alkylphenol polythoxylates in commercial products and marine water by reversed and normal-phase HPLC[J]. Int J Environ Anal Chem, 1989, 35(1): 207–218. |
| [21] | Carmen C F, Pablo A, Lucila C, et al. Vertical distribution profiles and diagenetic fate of synthetic surfactants in marine and freshwater sediment[J]. Science of Total Environment, 2013, 461-462: 568–575. DOI:10.1016/j.scitotenv.2013.04.100 |
| [22] | Castillo M, Martnez E, Ginebreda A, et al. Determination of non-ionic surfactants and polar degradation products in influent and effluent water samples and sludges of sewage treatment plants by generic solidphase extraction protocol[J]. Analyst, 2000: 1733–1739. |
| [23] | Matthijs E, Holt M S, Kiewiet A, et al. Environmental monitoring for linear alkylbenzene sulphonate, alcohol ethoxylate, alcohol ethoxy sulfate, alcohol sulfate, and soap[J]. Environ Toxicol Chem, 1999, 18: 2634–2644. DOI:10.1002/etc.v18:11 |
| [24] | Petrovic M, Barcel_o D. Determination of anionic and nonionic surfactants, their degradation products and endocrine-disruption compounds in sewage sludge by liquid Chromato-graphy/mass spectrometry[J]. Anal Chem, 2000, 72: 4560–4567. DOI:10.1021/ac000306o |
| [25] | Gao D W, Li Z, Guan J X, et al. Removal of surfactants nonylpehnol ethoxylates from municipal sewage-comparison of an A/O process and biological aerated filters[J]. Chemosphere, 2014, 97: 130–134. DOI:10.1016/j.chemosphere.2013.10.083 |
| [26] | Samaras V G, Stasinakis A S, Mamais D. Fate of selected pharmaceuticals and synthetic endocrine disrupting compounds during wastewater treatment and sludge anaerobic digestion[J]. Journal of Hazardous Materials, 2013, 244-245: 259–267. DOI:10.1016/j.jhazmat.2012.11.039 |
| [27] | Seçil O, Murdoch F K, Sanin F D S. Investigation of nonylphenol and nonylphenol ethoxylates in sewage sludge samples from a metropolitan wastewater treatment plant in Turkey[J]. Talanta, 2015, 131: 650–655. DOI:10.1016/j.talanta.2014.08.014 |
| [28] | Yu Y, Zhai H Y, Hou S G, et al. Nonylphenol ethoxylates and their metabolites in sewage treatment plants and rivers of Tianjin, China[J]. Chemosphere, 2009, 77: 1–7. DOI:10.1016/j.chemosphere.2009.06.036 |
| [29] | Dolores C, Julia M, Juan L, et al. Occurrence of surfactants in wastewater:Hourly and seasonal variations in urban and industrial wastewaters from Seville (Southern Spain)[J]. Science of the Total Environment, 2014, 468. |
| [30] | Arditsoglou A, Voutsa D. Occurrence and partitioning of endorcrinedisrupting compounds in the marine environment of Thermaikos Gulf, Northern Aegean Sea, Greece[J]. Marine Pollution Bulletin, 2012, 64: 2443–2452. DOI:10.1016/j.marpolbul.2012.07.048 |
| [31] | Sanderson H, Compernolle R, Scott D D. Occurrence and risk screen of alcohol ethoxylate surfactants in three U. S. river sediments associated with wastewater treatment plants[J]. Science of the Total Environment, 2013, 463-464: 600–610. DOI:10.1016/j.scitotenv.2013.05.047 |
| [32] | Gao D W, Li Z, Guan J X, et al. Seasonal variations in the concentration and removal of nonylphenol ethoxylates from the wastewater of sewage treatment plant[J]. Journal of Environmentl Sciences, 2016: 1–7. |
| [33] | Muller M T, Zehnder A J B, Escher B I. Liposome-water and octanolwater partitioning of alcohol ethoxylates[J]. Environ Toxicol Chem, 1999, 18: 2191–2198. |
| [34] | Albright Wilson. Safety data sheet, Empilan KTA 7. 5[C/OL]. 1996. |
| [35] | Cano M L, Dorn P B. Sorption of two model alcohol ethoxylate surfactants to sediments[J]. Chemosphere, 1996, 33(6): 981–994. DOI:10.1016/0045-6535(96)00240-8 |
| [36] | Brownawell B J, Chen H, Zhang W, et al. Sorption of nonionic surfactants on sediment materials[J]. Environ Sci Technol, 1997, 31: 1735–1741. DOI:10.1021/es960692k |
| [37] | Valoras N, Letey J, Osborn J. Adsorption on nonionic surfactants by soil materials[J]. Soil Sci Soc Am Proc, 1969, 33: 345–348. DOI:10.2136/sssaj1969.03615995003300030007x |
| [38] | Yuan C, Jafvert C T. Sorption of linear alcohol ethoxylate surfactant homologs to soils[J]. J Contam Hydrol, 1997, 28: 311–325. DOI:10.1016/S0169-7722(97)00020-X |
| [39] | Podoll R T, Irwin K C, Brendlinger S. Sorption of water-soluble oligomers on sediments[J]. Environ Sci Technol, 1987, 21: 562–568. DOI:10.1021/es00160a006 |
| [40] | Brownawell B J, Chen H, Zhang W, et al. Sorption of nonionic surfactants on sediment materials[J]. Environ Sci Technol, 1997, 31: 1735–1741. DOI:10.1021/es960692k |
| [41] | Kiewiet A T, de Beer K G M, Parsons J R, et al. Sorption of linear alcohol ethoxylates on suspended sediments[J]. Chemosphere, 1996, 32: 675–680. DOI:10.1016/0045-6535(95)00346-0 |
| [42] | Urano K, Saito M, Murata C. Adsorption of surfactants on sediments[J]. Chemosphere, 1984, 13: 293–300. DOI:10.1016/0045-6535(84)90136-X |
| [43] | Kibbey T C, Hayes K F. A multicomponent analysis of the sorption of polydisperse ethoxylated nonionic surfactants to aquifer materials, equilibrium sorption behaviour[J]. Environ Sci Technol, 1997, 31: 1171–1177. DOI:10.1021/es960681r |
| [44] | Petersen L. Grundtrak af jordbundslaren[M]. Jordbrugsforlaget, Frederiksberg: Denmark The Royal Veterinary and Agricultural University, 1994. |
| [45] | Cano M L, Dorn P B. Sorption of an alcohol ethoxylate surfactant to natural sediments[J]. Environ Toxicol Chem, 1996a, 15: 684–690. DOI:10.1002/etc.v15:5 |
| [46] | 刘光明, 尹大强. 粘土矿物对烷基酚聚氧乙烯醚的吸附行为[J]. 生态环境, 2008, 17(2): 593–597. LIU Guang-ming, YIN Da-qiang. Adsorption of alkylphenol ethoxylates onto clay mineral[J]. Ecology and Environment, 2008, 17(2): 593–597. (in Chinese) |
| [47] | LIU Guang-ming, ZHENG Shou-rong, YIN Da-qiang, et al. Adsorption of aqueous alkylphenol ethoxylate surfactants by mesoporous carbon CMK-3[J]. Journal of Colloid and Interface Science, 2006, 302(1): 47–53. DOI:10.1016/j.jcis.2006.06.006 |
| [48] | 王艳平. 高风险农药助剂在土壤中的残留特征及环境行为初探[D]. 北京: 中国农业科学院硕士学位论文, 2011: 44-47. WANG Yan-ping. Exploratory studies on the residue and environmental behavior of high-risk pesticide adjuvants in soils[D]. Beijing:Chinese Academy of Agricultural Sciences Dissertation, 2011, 44-47(in Chinese). |
| [49] | Sanchez-Camazano M, Arienzo M, Sanchez-Martin M J, et al. Effect of different surfactants on the mobility of selected non-ionic pesticides in soil[J]. Chemosphere, 1995, 31: 3793–3801. DOI:10.1016/0045-6535(95)00253-5 |
| [50] | Iglesias-Jimenez E, Sanchez-Martin M J, Sanchez-Camazano M. Pesticide adsorption in a soil-water system in the presence of surfactants[J]. Chemosphere, 1996, 32: 1771–1782. DOI:10.1016/0045-6535(96)00094-X |
| [51] | Sanchez-Camazano M, Arienzo M, Sanchez-Martin M J, et al. Effect of different surfactants on the mobility of selected non-ionic pesticides in soil[J]. Chemosphere, 1995, 31: 3793–3801. DOI:10.1016/0045-6535(95)00253-5 |
| [52] | Mata-Sandoval J C, Karns J, Torrents A. Influence of rhamnolipids and Triton X-100 on the biodegradation of three pesticides in aqueous phase and soil slurries[J]. J Agric Food Chem, 2001, 49: 3296–3303. DOI:10.1021/jf001432w |
| [53] | Steber J, Wierich P. Metabolites and biodegradation pathways of fatty alcohol ethoxylates in microbial biocenoses of sewage treatment plants[J]. Appl Environ Microbiol, 1985, 49: 530–537. |
| [54] | Steber J, Wierich P. The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants[J]. Water Res, 1987, 21: 661–667. DOI:10.1016/0043-1354(87)90076-5 |
| [55] | Swisher R D. Metabolic pathways and ultimate biodegradation[M]//Swisher R D, et al. Surfactant Biodegradation, New York:Mackel Dekker, 1987. |
| [56] | Patterson S J, Scott C C, Tucker K B E. Nonionic detergent degradation. Ⅲ:Initial mechanism of the degradation[J]. J Am Oil Chem Soc, 1970, 47: 37–41. DOI:10.1007/BF02541454 |
| [57] | Steber J, Wierich P. The environmental fate of detergent range fatty alcohol ethoxylates:Biodegradation studies with a 14C-labelled model surfactant[J]. Tenside Deterg, 1983, 20: 183–187. |
| [58] | Di Corcia A, Crescenzi C, Marcomini A, et al. Liquid chromatography electrospray mass spectrometry as a valuable tool for characterizing biodegradation intermediates of branched alcohol ethoxylate surfactants[J]. Environ Sci Technol, 1998, 32: 711–718. DOI:10.1021/es970616x |
| [59] | Van Ginkel C G, Kroon A G M. Metabolic pathway for the biodegradation of octadecyl bis (2-hydroxyethyl) amine[J]. Biodegradation, 1993(3): 435–443. |
| [60] | Hoey M D, Gadberry J F. Polyoxyethylene alkylamines[M]//Van Os N M, et al. Nonionic surfactants:Organic chemistry, New York:US, Marcel Dekker, 1998:163-175. |
| [61] | Adams C D, Spitzer S, Cowan R M. Biodegradation of nonionic surfactants and effects of oxidative pretreatment[J]. J Environ Eng, 1996, 122: 477–483. DOI:10.1061/(ASCE)0733-9372(1996)122:6(477) |
| [62] | Madsen T, Rasmussen H, Nilsson L. Anaerobic biodegradation potentials in digested sludge, a freshwater swamp and a marine sediment[J]. Chemosphere, 1995, 31: 4243–4258. DOI:10.1016/0045-6535(95)00300-W |
| [63] | Salanitro J P, Diaz L A. Anaerobic biodegradability testing of surfactants[J]. Chemosphere, 1995, 30: 813–830. DOI:10.1016/0045-6535(94)00443-X |
| [64] | Ang C C, Abdul A S. A laboratory study of the biodegradation of an alcohol ethoxylate surfactant by native soil microbes[J]. J Hydrol (Amst), 1992, 138: 191–209. DOI:10.1016/0022-1694(92)90164-Q |
| [65] | Kravetz L, Salanitro J P, Dorn P B, et al. Influence of hydrophobe type and extent of branching on environmental response factors of nonionic surfactants[J]. J Am Oil Chem Soc, 1991, 68: 610–618. DOI:10.1007/BF02660164 |
| [66] | Zhang C L, Valsaraj K T, Constant W D, et al. Surfactant screening for soil washing:Comparison of foamability and biodegradability of a plant-based surfactant with commercial surfactants[J]. J Environ Sci Health, Pt. A:Toxic/Hazard Subst Environ Eng A, 1998, 33: 1249–1273. DOI:10.1080/10934529809376787 |
| [67] | Ahel M, Hrsak D, Giger W. Aerobic transformation of shortchain alkylphenol polyethoxylates by mixed bacterial cultures[J]. Arch Environ Contam Toxicd, 1994, 26(4): 540–548. DOI:10.1007/BF00214159 |
| [68] | Kiewiet A T, Weiland A R, Parsons J R. Sorption and biodegradation of nonionic surfactants by activated sludge[J]. Sci Total Environ Suppl, 1993(1): 417–422. |
| [69] | Knaebel D B, Federle T W, McAvoy D C, et al. Microbial mineralization of organic compounds in an acidic agricultural soil, effects of preadsorption to various soil constituents[J]. Environ Toxicol Chem, 1996, 15: 1865–1875. DOI:10.1002/etc.v15:11 |
| [70] | González M M, Martín J, Camacho-Muñoz D. Degradation and environmental risk of surfactants after the application of compost sludge to the soil[J]. Waste Management, 2012, 32: 1324–1331. DOI:10.1016/j.wasman.2012.02.023 |
| [71] | Larson R J, Games L M. Biodegradation of linear alcohol ethoxylates in natural waters[J]. Environ Sci Technol, 1981, 15: 1488–1493. DOI:10.1021/es00094a011 |
| [72] | 佟玉洁, 聂云. 壬基酚聚氧乙烯醚 (NPEO) 在河水的生物降解测定[J]. 科技传播, 2011(6): 124–125. TONG Yu-jie, NIE Yun. Biodegradation rate determinating of nonylphenol polyethoxylates (NPEO) in river water[J]. Public Communication of Science & Technology, 2011(6): 124–125. (in Chinese) |
 2017, Vol. 34
2017, Vol. 34