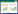文章信息
- 张志旭, 吴根义, 许振成
- ZHANG Zhi-xu, WU Gen-yi, XU Zhen-cheng
- 粘土矿吸附过程中四环素基团变化研究
- Functional Groups' Variation of Tetracycline in the Process of Adsorption in Clay Minerals
- 农业资源与环境学报, 2017, 34(2): 115-120
- Journal of Agricultural Resources and Environment, 2017, 34(2): 115-120
- http://dx.doi.org/10.13254/j.jare.2016.0263
-
文章历史
- 收稿日期: 2016-09-06
2. 湖南植物功能成分利用协同创新中心, 湖南 长沙, 410128;
3. 国家中医药管理局亚健康干预技术实验室, 湖南 长沙, 410128;
4. 环保部华南环境科学研究所, 广东 广州, 510655
2. Hunan Co-Innovation Center for Utilization of Botanical Functional Ingredients, Changsha 410128, China;
3. State Key Laboratory of Sub-health Intervention Technology, Changsha 410128, China;
4. South China Institute of Environmental Sciences, MEP, Guangzhou 510655, China
红壤是湖南省分布最广的土壤类型,为57.58万hm2,占湖南省土壤总面积的51%。红壤的最基本成分就是富含硅铝的粘土矿,高岭土和蒙脱石是2种典型的硅铝粘土矿,高岭土的主要成分是高岭石(Al2O3·2SiO2·2H2O),晶体类型1:1(Si:Al),为紧密的多层结构,呈电中性;蒙脱石理论化学通式Al2O3·4SiO2·nH2O(n通常大于2),晶体类型2:1(Si:Al),通常为较为疏松的多层结构,呈电负性[1-2]。研究这2种粘土矿吸附抗生素的变化与规律对湖南土壤的抗生素污染治理具有指导意义。
在畜禽饲料中使用的抗生素进入畜禽体内后,一般不发生吸收或降解,而以原形或代谢物的形式随粪、尿等排泄物排除,残留于环境中,并通过食物链对生态环境产生毒害作用。四环素是畜牧业广泛使用的抗生素之一,约30%~90%的四环素通过畜禽粪便的使用直接进入土壤环境[3]。四环素进入土壤通常会保留很长时间,Flemming等[4]使用简易摇瓶装置测得土霉素的半衰期为42~46 d。目前的研究表明,四环素在土壤中的吸附主要取决于抗生素和土壤的特性,但由于土壤和有机质组成的复杂性,大部分研究集中于四环素吸附量在不同土壤中的变化数据。Tolls[5]的研究认为,土壤中的矿物和有机质组分是抗生素的主要吸附位点,疏水分配、阳离子交换、阳离子键桥、表面配位螯合以及氢键等作用都可能在吸附过程中起到重要的作用;Stephen等[6]对不同土壤中四环素类抗生素的吸附研究发现,四环素类抗生素都能被土壤强烈吸附,酸性粘土中四环素类抗生素的吸附作用更强;有些研究认为在吸附过程中存在离子桥等作用,因而去质子化基团会促进吸附,但是这些推断没有足够的数据支持,没有揭示四环素在粘土矿中的吸附机理[7]。
本研究通过红外光谱仪跟踪四环素在不同吸附阶段的基团变化,发现-OH和C=O是影响吸附的主要基团,研究以高岭土和蒙脱石为吸附介质,结论有助于进一步研究湖南红壤吸附规律。
1 材料与方法 1.1 粘土矿样品的准备高岭土(邢台市中纬矿物材料有限公司)、蒙脱石(浙江安吉县荣建矿产精制厂)磨碎至200目,其电镜结构图见图 1和图 2,两种粘土矿物理结构相似,均为层柱状,在四环素吸附过程中有利于进行比较。

|
| 图 1 高岭土电镜图 Figure 1 SEM of Kaolin |

|
| 图 2 蒙脱石电镜图 Figure 2 SEM of Montmorillonite |
四环素标准品购自中国药品生物制品检定所,草酸、三氯乙酸、甲醇、乙腈、氯化钙、溴化钾为分析纯,购自国药集团。
1.3 主要仪器和设备岛津IRAFFINITY-1红外光谱仪,安捷伦1260型高效液相色谱仪,日本JEOL JSM-1230LV型扫描电镜。
1.4 试验设计和方法 1.4.1 吸附平衡时间的测定和吸附等温模型研究称取供试土样2 g,分别置于盛有35 mL 100.0 mg·L-1的四环素水溶液的离心管中,再向每支离心管中加入5.0 mL 0.05 mol·L-1 CaCl2溶液,盖好瓶塞,摇匀后置于25±1 ℃恒温振荡(高速震荡,250 r·min-1),分别于0 min,30 min,1、3、6、12、24、30 h时取下离心管,在高速离心机中4 000 r·min-1离心15 min,准确移取10 mL上清液,采用HPLC进行定量分析[8-9]。
1.4.2 四环素主要官能团变化研究取不同吸附时间离心后的土样少许,0 ℃以下预冻24 h,然后放入冷冻干燥机中冻干。取冻干后的土样1~2 mg加入溴化钾(KBr)200 mg。使用研钵研细(200目以下),置于压片模具中压片,保持样片厚度不超过0.5 mm,样片置于红外光谱分析仪下进行分析,比较主要官能团变化。
1.4.3 HPLC检测色谱柱采用岛津C18柱(150×4.6 mm,5 μm),紫外检测器波长360 nm,柱温40 ℃,采用0.01 mol·L-1草酸+0.01 mol·L-1三氯乙酸+甲醇+乙腈体系,流速0.8 mL·min-1。
1.4.4 分析方法所有实验数据重复测定3次,结果采用3次的平均数。
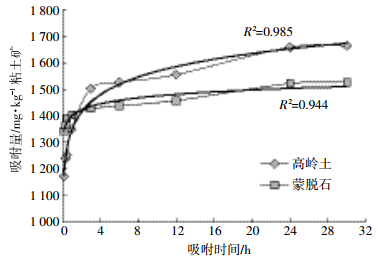
2 结果与讨论 2.1 吸附平衡时间由图 3可以看出,四环素在吸附前4 h内吸附量增加很快,在24 h左右增加放缓,达到平衡时间,因此四环素在高岭土和蒙脱石的吸附平衡时间均为24 h。
|
| 图 3 四环素在高岭土和蒙脱石中的吸附平衡曲线 Figure 3 Adsorption equilibrium curve of TC in Kaolin and Montmorillonite |
通常条件下,污染物在土壤中的吸附模型可以通过不同的吸附等温线方程进行描述,不同的等温吸附模型定量描述为:
Freundlich模型:
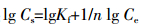
|
(1) |
Langmuir模型:
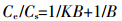
|
(2) |
线性模型:
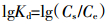
|
(3) |
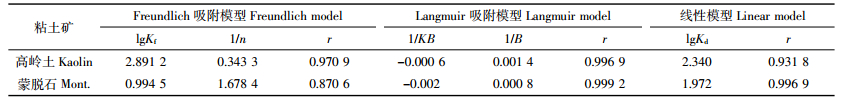
方程(1)中,Cs为单位质量土壤吸持的抗生素量(mg·kg-1),Ce为平衡溶液抗生素浓度(mg·kg-1),Kf和1/n是与温度有关的常数,其中Kf代表吸附容量,但不代表最大吸附量,其值越大,则土壤吸附容量越大;1/n反映吸附的非线性程度以及吸附机理的差异,其值越大,表示抗生素吸附强度越大,1/n也可表征吸附过程的亲和力,且1/n为Freundlich模型中的位能不均匀因子或非线性因子,该值越远离1,吸附的非线性越强。方程(2)中,B为最大吸附量,K为系数。方程(3)中,Kd为线性吸附模型的吸附参数(L·kg-1),计算四环素的吸附常数和相关参数见表 1。结果显示,Langmuir吸附等温式的相关系数最高,均在0.99以上,因此用Langmuir吸附等温模型描述四环素在粘土矿中的吸附行为最好[10-11]。本实验采用的两种粘土矿不含有机质等其他影响因素,是四环素分子与矿物层之间发生的吸附,Langmuir吸附等温模型是3类模型中最适于描述单分子层吸附的模型,因此相关系数最高。在土壤的吸附中多采用Freundlich模型来描述吸附行为,这是因为多种有机质的存在使吸附表面出现了分层,每层都存在能够吸附分子或原子的吸附位,多分子层的吸附适合用Freundlich模型来描述。
|
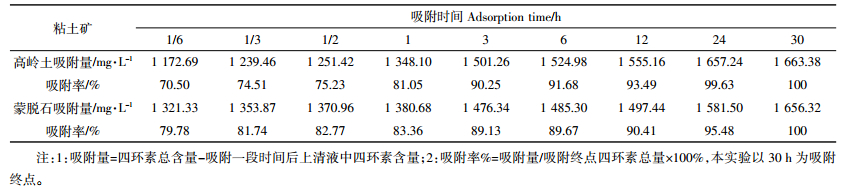
结合表 2和图 3可知四环素吸附量在1、12、24 h出现平台期,吸附1 h后80%以上的四环素被吸附,1~12 h发生10%左右吸附,24 h以后仍有5%左右的吸附发生[12-14]。表明四环素类抗生素吸附分为两个过程,即快速反应过程和慢速平衡过程。抗生素吸附的快速扩散过程可在1 h左右完成,之后溶液中抗生素的比例变化趋于平缓,在一定时间吸附达到饱和,这一过程称为慢速平衡过程。许多研究证实了这种双速率吸附过程,但对于吸附机理却有多种分析,主要包括:(1)吸附位点理论:李鑫等[15]以黑土、褐土为吸附介质研究了四环素类抗生素的吸附认为土壤的吸附位点是决定吸附的重要因素。抗生素分子首先附着在土壤细小颗粒表面,沿着扩散阻力最小的径向方向运动并与吸附位点结合形成吸附,之后受到狭窄孔径的巨大阻力,逐渐转变为慢速吸附。随着抗生素吸附时间的不断增加,土粒的全部吸附点位都被四环素类抗生素占据时,抗生素的吸附就达到了饱和,抗生素的总吸附量不再增加。由于黑土提供的吸附位点较多,因此黑土的最终平衡量大于褐土[8, 13];(2)阳离子交换理论:邹星等[9]在以蒙脱石为介质的吸附研究中认为四环素类抗生素在蒙脱石上的吸附明显受pH值的影响与其带有电荷或具电子耦合性的两性分子有关。四环素分子上的阳离子基团可以通过阳离子交换的方式和蒙脱石表面的负电荷结合而产生吸附作用。四环素和土霉素吸附量随pH值的升高而降低,表明其吸附机理以阳离子交换为主。在阳离子存在的情况下,价态越高影响越大,Ca2+对蒙脱石吸附四环素和土霉素的影响比Na+大[9, 15-16]。
|
四环素在土壤中的吸附是比较复杂的,但从趋势来看,在粘土矿和土壤中的吸附行为都呈现“快-慢”的两段吸附模式和“多-少”的吸附量变化,说明有机质和金属元素的存在虽然会在一定程度上影响和改变吸附行为,但这两大主要特征都会在吸附行为中体现出来[17]。这些吸附理论注重了吸附介质和吸附环境对吸附的影响,但没有揭示四环素分子在吸附中的变化,笔者通过傅里叶红外光谱分析仪对四环素分子的变化进行了检测和分析,发现可能是这些主要基团的变化主导了四环素在粘土矿中的吸附行为。
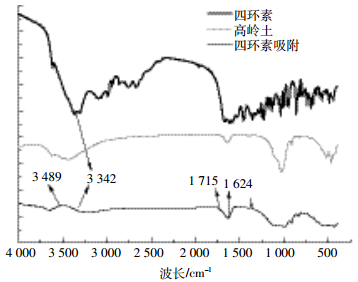
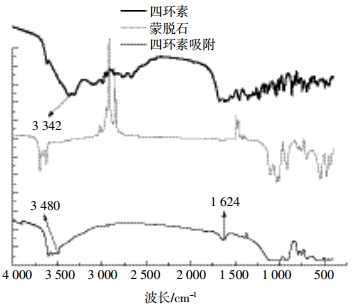
2.4 四环素主要官能团在吸附中的变化及分析如图 4所示,四环素吸附24 h后达到平衡,羟基和羰基发生较明显变化。波长范围在3 350±10 cm-1处是-OH的伸缩振动峰,在发生吸附前,四环素在3 342 cm-1处出现-OH的特征吸收峰,吸附后吸收峰向高频方向移动,吸收峰变得宽而钝,经标准图谱比对,这是由于氢键的影响而导致的,说明四环素在吸附过程中形成了氢键;羰基(C=O)伸缩振动峰一般出现在1 700±10 cm-1处,吸附24 h后,吸收峰向低频移动,说明羰基在吸附过程中发生了共轭效应,可能由于氢键的出现产生诱导效应,使电子云密度向氢键方向偏移,C=O的伸缩振动减弱[18-20]。如图 5所示,在蒙脱石吸附四环素的过程中也出现了类似的变化。快速吸附期的特点是四环素的羟基基团与水形成多个氢键,而且不易解析;慢速吸附期主要是由四环素的羰基发生改变引起的吸附,这种吸附在外界作用力减弱的情况下容易恢复,因而较易发生解析[21-22]。
|
| 图 4 高岭土吸咐四环素24 h后红外图谱 Figure 4 FTIR compare of TC after 24 h in Kaolin |
|
| 图 5 蒙脱石吸附四环素24 h后红外图谱 Figure 5 FTIR compare of TC after 24 h in Montorillonite |
吸附1 h后的红外图谱显示氢键的吸收峰形成后基本维持稳定,1 700 cm-1处的羰基(C=O)伸缩振动峰向低频处移动,但在3 h和12 h的吸收峰变化不大;吸附24 h后达到饱和,吸收峰和吸附量的变化不大,此时发生的吸附主要与其他特征官能团相关,而且吸附能力不强。24 h解析后,80%的四环素不发生解析,表明氢键的形成是稳定的,不加大能量输入破坏氢键,四环素很难从粘土矿中解析出来[23-25]。
这一发现表明四环素类抗生素的吸附特性与苯环上-OH和C=O相关。低pH值时,-OH容易形成氢键,吸附速度快而且吸附量大,高价态金属离子的出现与H+发生竞争,影响了氢键的形成,因此吸附量降低,这与前述研究[8-9, 13, 15-16]的吸附位点理论和阳离子交换理论的结果相吻合,且从分子变化清晰揭示了吸附过程中四环素主要官能团发生的变化。吸附行为中吸附剂与吸附介质的结构是影响吸附行为的关键因素,但对两者相互作用的分子水平研究不多,如果能在量子化学的基础上计算出氢键形成与破坏所需能量和电子云变化,则有利于建立精准的吸附模型,对解释四环素类抗生素中其他取代基团对氢键形成的影响方向和效率有较好预测作用[26-27]。
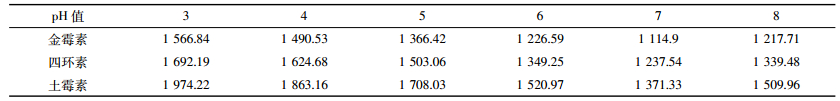
2.5 不同起始pH值下在蒙脱石中的四环素类抗生素吸附量变化随着pH值的升高,四环素类抗生素吸附量均呈现下降趋势(表 3),在pH值为7时呈现转折点,表明酸性条件有利于四环素类抗生素的吸附,结合-OH在吸附中的作用,我们可以进一步推测。四环素在等电点为3.3时表现出的离子形态有利于氢键的形成,因而吸附量最大,而在pH值为7时出现新的等电点(pH7.7),离子形态发生变化,吸附量略微增大但小于pH值为3~5,表明此时的离子形态也能形成氢键但数目不多[28-29]。在同一pH值下,土霉素的吸附量最大,金霉素的吸附量最小,表明四环素类抗生素的结构对吸附的影响大,土霉素的结构最有利于吸附进行,吸附能力:土霉素>四环素>金霉素。
|
从不同起始pH值时吸附量的变化特点,可以推测金霉素、土霉素与四环素在吸附过程中具有类似的吸附行为和基团变化,而且随羟基基团的增加,吸附增强加快。自然界存在的土壤含有多种有机质、阴阳离子等影响氢键形成的因素,可以进行进一步研究,逐步将结论应用于抗生素在土壤的吸附机理研究中[30-31]。
3 结论(1)四环素在两种粘土矿中的吸附可分为3个阶段,1~12 h为快速吸附期,发生80%左右的吸附;12~24 h为慢速吸附期,发生10%左右的吸附;24 h以后为饱和期,仍有5%左右的吸附发生。
(2)根据傅里叶红外光谱分析发现,快速吸附期时,四环素的羟基基团与水形成多个氢键,吸收峰向高频方向移动,吸收峰变得宽而钝,发生的吸附而且不易解析;慢速吸附期主要是四环素的羰基引起的吸附,此时吸收峰向低频移动,这种吸附在外界作用力减弱的情况下容易恢复,因而较易发生解析。
| [1] | 李兆君, 齐瑞环, 龙健, 等. 土壤粒度对土霉素在黑土和红壤上吸附的影响[J]. 农业环境科学学报, 2010, 29(12): 2357–2362. LI Zhao-jun, QI Rui-huan, LONG Jian, et al. Influence of particle size on the adsorption of oxytetracycline on black soil and red soil[J]. Journal of Agro-Environment Science, 2010, 29(12): 2357–2362. (in Chinese) |
| [2] | Soren Thiele-Bruhn. Pharmceutical antibiotic compounds in soils:A review[J]. Journal of Plant Nutrition Soil Science, 2003, 166: 145–167. DOI:10.1002/jpln.200390023 |
| [3] | 刘雨霞, 鲍艳宇. 土壤中四环素类抗生素污染研究进展[J]. 环境污染与防治, 2011, 33(8): 81–91. LIU Yu-xia, BAO Yan-yu. A review on pollution situation of tetracycline antibiotics in soil environment[J]. Environmental Pollution & Control, 2011, 33(8): 81–91. (in Chinese) |
| [4] | Flemming Ingerslev, Lars Toräng, Marie-Louise Loke, et al. Primary biodegradation of veterinary antibiotics in aerobic and anaerobic surface water simulation systems[J]. Chemosphere, 2001, 44(4): 865–872. DOI:10.1016/S0045-6535(00)00479-3 |
| [5] | Tolls J. Sorption of veterinary pharmaceuticals in soils:A review[J]. Environmental Science Technology, 2001, 35(17): 3397–3406. DOI:10.1021/es0003021 |
| [6] | Stephen A S, Linda S L. Sorption of three tetracyclines by several soils:Assessing the role of pH and cation exchange[J]. Environmental Science & Technology, 2005, 39: 7452–7459. |
| [7] | Elena Martinez-Carballo, Carmen Gonzalez-Barreiro, Sigrid Scharf. Environmental monitoring study of selected veterinary antibiotics in animal manure and soils in Austria[J]. Environmental Pollution, 2007, 148: 570–579. DOI:10.1016/j.envpol.2006.11.035 |
| [8] | Gerlinde D R, Robn J. Availability and leaching of polycyclic aromatic hydrocarbons controlling processes and comparison of testing methods[J]. Waste Management Research, 2009, 29(1): 136–142. DOI:10.1016/j.wasman.2008.03.013 |
| [9] | 邹星, 昊小莲, 莫测辉, 等. 蒙脱石对四环素类抗生素的吸附平衡及动力学[J]. 高校化学工程学报, 2011, 25(3): 524–528. ZOU Xing, WU Xiao-lian, MO Ce-hui, et al. Adsorption equilibrium and kinetics of adsorbing tetracycline antibiotics on Montmorillonite[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(3): 524–528. (in Chinese) |
| [10] | 武庭瑄, 周敏, 万建新, 等. 膨润土和高岭土对四环素吸附的影响[J]. 农业环境科学学报, 2009, 28(5): 914–918. WU Ting-xuan, ZHOU Min, WAN Jian-xin, et al. Influence of Montmorillonite and Kaolin on tetracycline adsorption[J]. Journal of Agro-Environment Science, 2009, 28(5): 914–918. (in Chinese) |
| [11] | Gong Wenwen, Liu Xinhui, He Hui, et al. Quantitatively modeling soil-water distribution coefficients of three antibiotics using soil physicochemical properties[J]. Chemosphere, 2012, 102: 1–7. |
| [12] | Shao Lina, Ren Zongming, Zhang Gaosheng, et al. Facile synthesis, characterization of a MnFe2O4/activated carbon magnetic composite and its effectiveness in tetracycline removal[J]. Materials Chemistry and Physics, 2012, 135: 16–24. DOI:10.1016/j.matchemphys.2012.03.035 |
| [13] | Kang Hyun-Joong, Lim Mi-Young, Kwon Jung-Hwan. Effects of adsorption onto silica sand particles on the hydrolysis of tetracycline antibiotics[J]. Journal of Environmental Monitoring, 2012, 14: 1853–1859. DOI:10.1039/c2em10961a |
| [14] | 齐会勉, 吕亮, 乔显亮.抗生素在土壤中的吸附行为研究进展[J].土壤, 2009, 41(5):703-708. http://www.cnki.com.cn/Article/CJFDTOTAL-TURA200905004.htm |
| [15] | 李鑫, 王东升, 张婷. 土霉素和金霉素在土壤中的吸附-解吸行为[J]. 地球环境学报, 2015, 6(5): 317–322. LI Xin, WANG Dong-sheng, ZHANG Ting. Adsorption-desorption behavior of oxytetracycline (OTC) and chlortetracycline (CTC)[J]. Journal of Earth Environment, 2015, 6(5): 317–322. (in Chinese) |
| [16] | Chang Po-Hsiang, Li Zhao-hui, Jiang Wei-the, et al. Adsorption and intercalation of tetracycline by swelling clay minerals[J]. Applied Clay Science, 2009, 46(1): 27–36. DOI:10.1016/j.clay.2009.07.002 |
| [17] | ZHANG Chen, JIA Le, WANG Sheng-hui, et al. Biodegredation of beta-cypermethrin by two Serratia spp. with different cell surface hydrophobicity[J]. Bioresource Technology, 2010, 101(10): 3423–3429. DOI:10.1016/j.biortech.2009.12.083 |
| [18] | Sun Huiyu, Shi Xin, Mao Jing-dong, et al. Tetracycline sorption to coal and soil humic acids:An examination of humic structural heterogeneity[J]. Environmental Toxicology and Chemistry, 2010, 29(9): 1934–1942. |
| [19] | Zhang Lun-liang, Zhu Dong-qiang, Wang He, et al. Humic acid-mediated transport of tetracycline and pyrene in saturated porous media[J]. Environmental Toxicology and Chemistry, 2012, 31(3): 534–541. DOI:10.1002/etc.v31.3 |
| [20] | Zhao Yanping, Gu Xueyuan, Gao Shixiang. Adsorption of tetracycline (TC) onto montmorillonite:Cations and humic acid effects[J]. Geoderma, 2012, 183-184: 12–18. DOI:10.1016/j.geoderma.2012.03.004 |
| [21] | Gerlinde D R, Robn J. Availability and leaching of polycyclic aromatic hydrocarbons controlling processes and comparison of testing methods[J]. Waste Management Research, 2009, 29(1): 136–142. DOI:10.1016/j.wasman.2008.03.013 |
| [22] | Avisar Dror, Primor Orna, Gozlan Igal, et al. Sorption of sulfonamides and tetracyclines to Montmorillonite clay[J]. Water, Air & Soil Pollution, 2010, 29(1-4): 439–450. |
| [23] | Fang Jong-Yi, Hsu Yu-rong. Molecular identification and antibiotic control of endophytic bacterial contaminants from micro propagated Aglaonema cultures[J]. Plant Cell Tiss Organ Cult, 2012, 110: 53–62. DOI:10.1007/s11240-012-0129-6 |
| [24] | Zhao Yan-ping, Geng Jin-ju, Gao Shi-xiang, et al. Adsorption of tetracycline onto goethite in the presence of metal cations and humic substances[J]. Journal of Colloid and Interface Science, 2011, 361: 247–251. DOI:10.1016/j.jcis.2011.05.051 |
| [25] | Chen Wan-Ru, Huang Ching-Hua. Adsorption and transformation of tetracycline antibiotics with aluminum oxide[J]. Chemosphere, 2010, 79: 779–785. DOI:10.1016/j.chemosphere.2010.03.020 |
| [26] | Zhang Zhe-yun, Sun Ke, Gao Bo, et al. Adsorption of tetracycline on soil and sediment:Effects of pH and the presence of Cu (Ⅱ)[J]. Journal of Hazardous Materials, 2011, 190: 856–862. DOI:10.1016/j.jhazmat.2011.04.017 |
| [27] | Wan Ying, Bao Yan-yu, Zhou Qi-xing. Simultaneous adsorption and desorption of cadmium and tetracycline on cinnamon soil[J]. Chemosphere, 2010, 80: 807–812. DOI:10.1016/j.chemosphere.2010.04.066 |
| [28] | Wang Yu-jun, Jia De-an, Sun Rui-juan, et al. Adsorption and cosorption of tetracycline and Copper (Ⅱ) on Montmorillonite as affected by solution pH[J]. Environmental Science & Technology, 2008, 42(9): 3254–3259. |
| [29] | Wang Yu-jun, Sun Rui-juan, Xiao An-yun. Phosphate affects the adsorption of tetracycline on two soils with different characteristics[J]. Geoderma, 2010, 156: 237–242. DOI:10.1016/j.geoderma.2010.02.022 |
| [30] | Kong Wei-dong, Li Chun-ge, Jenna M Dolhi, et al. Characteristics of oxytetracycline sorption and potential bioavailability in soils with various physical chemical properties[J]. Chemosphere, 2012, 87: 542–548. DOI:10.1016/j.chemosphere.2011.12.062 |
| [31] | 彭凤姣, 应光国, 周丽君, 等. 氧四环素在典型土壤中的吸附/解吸行为及其吸附态生物有效性研究[J]. 地球化学, 2015, 44(1): 71–78. PENG Feng-jiao, YING Guang-guo, ZHOU Li-jun, et al. Adsorption and desorption of oxytetracycline on typical soils and soil-adsorbed oxytetracycline's bioavailability[J]. Geochemical, 2015, 44(1): 71–78. (in Chinese) |
 2017, Vol. 34
2017, Vol. 34