文章信息
- 王定美, 王伟, 李勤奋, 李玮, 程汉亭, 李光义, 麦力文
- WANG Ding-mei, WANG Wei, LI Qin-fen, LI Wei, CHENG Han-ting, LI Guang-yi, MAI Li-wen
- 干燥温度对2个品种木薯嫩茎叶黄酮提取率的影响
- Effects of Drying Temperature on Flavonoids Extraction Rate from Young Stems and Leaves of Two Cassava Varieties
- 农业资源与环境学报, 2017, 34(1): 86-94
- Journal of Agricultural Resources and Environment, 2017, 34(1): 86-94
- http://dx.doi.org/10.13254/j.jare.2016.0207
-
文章历史
- 收稿日期: 2016-09-05
木薯茎叶是木薯种植、加工过程中产生的主要副产物之一,其鲜产量和块根产量相当[1]。由于种植木薯主要为获得高淀粉含量的块根,而鲜木薯茎叶则被看成是农业废弃物,除了少部分作低附加值饲料外,没有得到足够重视,其资源化开发利用滞后,大部分被丢弃浪费掉,污染环境。充分利用这些木薯茎叶,对于解决环境污染问题、提升木薯种植效益、促进产业发展均具有重要意义。
黄酮泛指两个苯环通过3 个碳原子相互连结而成的系列化合物的总称,为一种存在于植物体内的生物活性成分,其结构解析、功能特性及产品开发,是近现代研究的热点和前沿[2]。研究表明,木薯茎叶中含丰富的黄酮,干燥叶片总黄酮含量可达2.8%[3],与银杏叶片黄酮含量相当[4]。木薯叶总黄酮粗提物在饲料[5]、抗菌[6]、保肝[7]等方面已取得积极应用效果。Kubo 等[8]发现,巴西木薯叶片含槲皮素840 mg·kg-1、山奈酚840 mg·kg-1、芦丁4 620 mg·kg-1,并且这3 种化合物的抗氧化性效果显著。Tanaka 等[9]发现木薯在采收之后会产生具有抗炎与抗氧化作用的儿茶素等次生代谢产物。李珊珊等[10]从海南产木薯茎乙醇提取物中分离得到具有多种生物功能的穗花杉双黄酮。何翠薇等[11]研究发现木薯叶与茎杆皮乙醇提取液中含有二氢黄酮甙。开发利用木薯茎叶黄酮方兴未艾。
木薯茎叶收储方法直接影响后续黄酮提取利用的效果。干燥贮存是常用的植物叶片采后预处理方法,已有研究表明,各类植物黄酮提取率对干燥温度的响应规律是不一致的。如银杏叶在90 ℃、黄蜀葵花在60~80 ℃烘干后,总黄酮提取率最高[12-13];连钱草总黄酮提取率随干燥温度降低而显著升高[14];橘子皮总黄酮在50~60 ℃与干燥温度成反比,在70~100 ℃与干燥温度成正比[15]。据报道:常温下储藏的大豆种子异黄酮含量有偏高的趋势[16];贮藏时间对陈皮中类黄酮成分影响不大[17],这也说明不同类别的植物黄酮随贮存时间的变化是有差异的。本文选择食用甜木薯品种SC09 和高产、高淀粉含量木薯品种SC205 的嫩茎叶作为实验材料,对其进行干燥处理,研究不同干燥温度(40~120 ℃)对黄酮提取率及其干燥后稳定性的影响,探讨嫩茎叶采后干燥收贮方法,为一步研究开发利用木薯茎叶黄酮资源提供依据。
1 材料与方法 1.1 试验材料供试试验材料为木薯品种华南9 号(SC09)和华南205 号(SC205)植龄为90 d的嫩茎叶(指茎无连续粉灰色处10 cm 以上的绿色嫩茎叶),均采自中国热带农业科学院环境与植物保护研究所儋州观测站试验地。该试验地为平整台地,土层深厚,排水条件良好。
1.2 试验方法试验地深耕30 cm 后施肥均地,施肥量为每公顷15-15-15 复合肥量450 kg,按种植密度80 cm×100cm,每个品种种植面积10 m×15 m,采用斜插式种植。植后第90 d,在种植区域内,每个品种任选长势基本一致的10株进行采样。
将采集后的木薯茎叶用饲料粉碎机切至长度小于5 cm,分别置于不同的恒温(40、50、60、70、80、90、100、110、120 ℃)干燥箱中,烘干至恒重后粉碎至粒径小于60目。依据干燥温度对总黄酮提取率的影响结果,分别取各品种中总黄酮提取率较高(前3)的干燥样品进行贮存试验,开展干燥后木薯茎叶黄酮提取率的稳定性研究。考察周期为120 d,贮存条件为自封袋密闭常温保存,每30 d 监测总黄酮与6 种类黄酮成分(儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮)提取率。
总黄酮提取率的测定方法参考文献[3]:超声波辅助乙醇法制备木薯茎叶黄酮提取液,超声波提取条件:提取剂为浓度50%的乙醇水溶液,液料比40颐1,功率80 W、提取0.5 h、2次提取,NaNO2-Al(NO3)3 -NaOH法测定提取液中总黄酮含量,折算样品中总黄酮提取率。HPLC 法测定木薯茎叶黄酮成分提取率。所用固定相为CNW Athena C18-WP 液相色谱柱(4.6 mm×250 mm,5 μm),柱温为25 ℃,流速为1.0 mL·min-1;流动相A 为乙腈,流动相B 为水-乙酸(40颐1)。采用梯度洗脱: 0 min,15%流动相A、85%流动相B;30 min,70%流动相A、30%流动相B。外标法定量。检测波长:儿茶素与二氢黄酮甙281 nm、芦丁与山奈酚360 nm、槲皮素367 nm、穗花杉双黄酮338 nm;进样量5 μL。根据标准曲线的回归方程计算出样品提取液中儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮6 种黄酮成分含量,折算木薯茎叶黄酮成分提取率。
经方法学验证,本文所述HPLC 法中,儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮的进样含量分别为1.5~194.6 mg·L-1(R2=0.999 9)、7.8~992.6 mg·L-1(R2=1.000 0)、0.7~84 mg·L-1(R2=0.999 9)、0.7~93.8 mg·L-1(R2=0.999 9)、0.8~108 mg·L-1(R2=0.995 8)、0.5~67.2 mg·L-1(R2=0.999 5)时与各自峰面积线性关系良好,回收率95%~101%,相对标准偏差(RSD)小于3%,可用于以上6 种木薯茎叶黄酮成分含量的精确定量。
2 结果与分析 2.1 木薯嫩茎叶总黄酮提取率根据图 1 可看出,两个木薯品种SC09 与SC205嫩茎叶样品,随干燥温度(60~120 ℃)增大,总黄酮提取率先上升后下降再上升,并且60~90 ℃间变化趋势与许成帅等[19] 对木薯品种南植199 的研究结果一致。其中,SC205 总黄酮提取率最大的前3 个干燥温度依次是60 ℃>70 ℃>120 ℃,提取率值依次为1.89%、1.76%、1.53%;SC09 则为120 ℃(1.65%)>60 ℃(1.41%)>110 ℃(1.40%),说明为获得较高的总黄酮提取率,应依据木薯品种选择合适的干燥温度。在干燥温度40~80 ℃下的木薯茎叶总黄酮提取率,SC205 显著大于SC09,说明在此干燥温度下,总黄酮提取效果SC205 好于SC09;90~120 ℃下两者总黄酮提取率差别不大,说明在此干燥温度下,SC205 与SC09 总黄酮提取效果相差不大。综合总黄酮提取率随温度的变化规律,40~80 ℃干燥,木薯品种和干燥温度均对提取率产生明显影响,均为主要影响因素,90~120 ℃干燥,品种影响程度减弱,温度是主要影响因素。
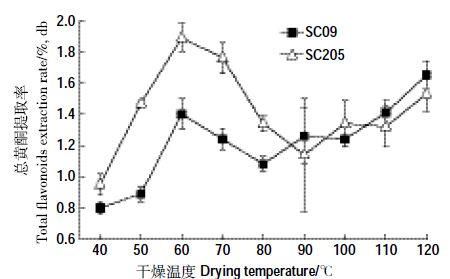
|
| 图 1 干燥温度对木薯嫩茎叶总黄酮提取率的影响 Figure 1 Effects of drying temperature on total flavonoids extraction rate from young cassava stems and leaves |
由图 2可以看出,不同木薯品种嫩茎叶中6 种黄酮成分提取率随干燥温度升高呈现不同规律。SC09中儿茶素以90 ℃,芦丁、槲皮素、山奈酚及穗花杉双黄酮以80 ℃,二氢黄酮甙以70 ℃为界点,SC205 中这6 种成分则以90 ℃为界点,提取率分别出现两个峰值。界点温度以下提取率随温度升高呈现出完整峰型变化,界点温度以上峰型情况依品种及成分种类差别较大。儿茶素与芦丁以SC09 中60 ℃、二氢黄酮甙以SC09 中50 ℃、槲皮素以SC205 中110 ℃、山奈酚以SC09 中70 ℃、穗花杉双黄酮以SC205 中70 ℃提取,分别达到最大提取率281.41、1 656.66、34.94、2.95、19.66、296.77 mg·kg-1。说明木薯品种不同,茎叶中黄酮成分提取率最大的干燥温度亦不同。

|
| 图 2 干燥温度对木薯嫩茎叶类黄酮成分提取率的影响 Figure 2 Effects of drying temperature on flavonoids extraction rate from young cassava stems and leaves |
在本实验的干燥温度(40~120 ℃)下,木薯嫩茎叶中各类黄酮成分的提取程度差异显著。对于SC09,儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮在40~120 ℃的平均提取率依次为:126.65、717.74、16.57、0.61、17.77、114.63 mg·kg-1,成分提取程度为:芦丁>儿茶素>穗花杉双黄酮>山奈酚>二氢黄酮甙>槲皮素。对于SC205,各成分平均提取率依次为:41.70、527.34、7.51、1.43、19.98、157.93 mg·kg-1,提取程度为:芦丁>穗花杉双黄酮>儿茶素>山奈酚>二氢黄酮甙>槲皮素,说明儿茶素和穗花杉双黄酮提取程度还跟木薯品种有关。综上,木薯茎叶中以上6 种成分的提取程度为:芦丁>(穗花杉双黄酮或儿茶素)>山奈酚>二氢黄酮甙>槲皮素。在陶海腾[20]研究中,60℃干燥的木薯SC05 叶片中,芦丁>烟花甙>杨梅素-3-O-芸香糖苷>金丝桃苷>水仙甙>clovin 的提取率依次减小,Kubo 等[8]发现,巴西木薯叶片中类黄酮成分含量:芦丁(4 620 mg·kg-1)为槲皮素/山奈酚(840 mg·kg-1)的5.5 倍,芦丁含量高,由此可推测,芦丁应为木薯茎叶黄酮的首要共同成分,其他成分与品种有关。
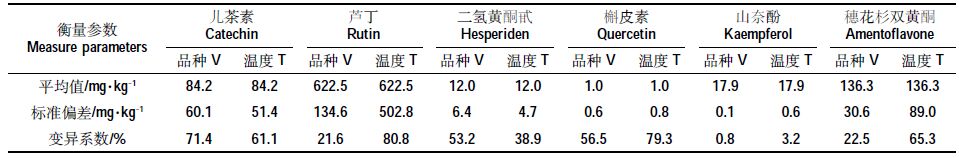
表 1 为类黄酮成分提取率在不同干燥温度和木薯品种间的变异程度分析结果。变异程度分析发现,儿茶素与二氢黄酮甙的品种间的变异系数大于温度间的,芦丁、槲皮素、山奈酚、穗花杉双黄酮则温度间的变异系数大于品种间的,说明儿茶素与二氢黄酮甙提取率受品种的影响程度要大于温度,其他4 种成分则反之。提取率的品种间与温度间变异系数分别以儿茶素的71.4%、芦丁的80.8%为最大,说明儿茶素提取率受品种、芦丁提取率受温度的影响程度最大。但无论是干燥温度间还是木薯品种间的变异系数,均以山奈酚的最小,说明其提取率在这6 种黄酮中受干燥温度和木薯品种的影响均最小。
|
前文表明,SC09 和SC205 木薯茎叶分别在干燥温度60、70、120 ℃和60、110、120 ℃下(依次记为SC09-60、SC09-70、SC09-120、SC205-60、SC205-110、SC205-120),总黄酮提取率高,将此选为稳定性试验研究的考察处理。表 2 为不同干燥温度处理后的木薯茎叶总黄酮提取率在贮存期(30~120 d)内的变化。由表 2可知,无论是SC09 还是SC205,不同温度干燥后的木薯茎叶总黄酮提取率随贮存期延长呈先下降后上升的变化趋势,但不同品种和干燥温度下谷值出现的早晚和幅度不同。110 ℃干燥后的SC205 木薯茎叶总黄酮提取率随贮存期的变化程度未达到显著性水平,其他品种和温度下的变化程度均达到显著水平。60 ℃下干燥的木薯茎叶均在30 d贮存期出现谷值,SC09 与SC205 相对初始值降低率分别为40.89%、20.15%。70 ℃干燥后的SC09木薯茎叶在60d 出现谷值,降低率35.85%。SC09 木薯茎叶120 ℃干燥,总黄酮提取率在30 d 出现谷值后(降低率7.57%),随贮存期延长有所上升并大于初始值,但未达到显著水平;SC205 在60 d时总黄酮提取率显著低于初始值,在90 d 出现谷值,降低率为20.05%。SC09 木薯茎叶120 ℃下干燥相比60、70 ℃,总黄酮提取率随时间变化幅度最小,降低率最大为7.57%;SC205 木薯茎叶110 ℃下干燥相比60、120 ℃,总黄酮提取率随时间变化幅度最小,降低率最大为18.28%,并与初始值相比不显著。由此,本实验条件下,SC09 茎叶在120 ℃、SC205 茎叶在110 ℃下干燥存贮,总黄酮提取率的稳定性最好。
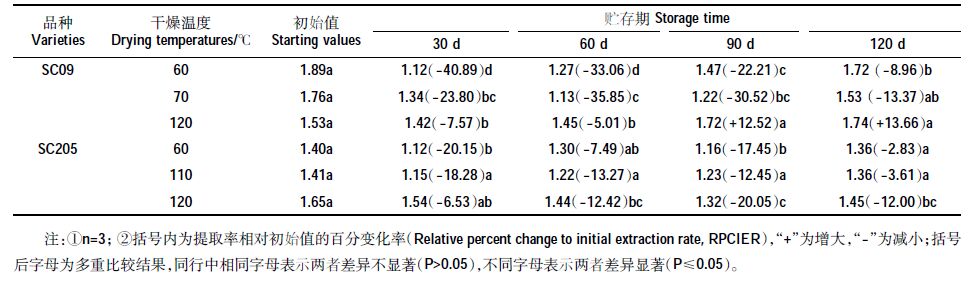
|
为进一步了解类黄酮成分提取率在120 d贮存期内的稳定程度,以每30 d的以上6种类黄酮成分提取率为基础计算变异系数,结果见表 3。由表 3 可以看出,木薯叶中类黄酮成分提取率随贮存期延长的变异系数为1.03%~65.41%、相对初始提取率的平均变化率为-39.0%~+538.1%,因干燥温度、木薯品种、类黄酮成分种类,差别较大。在120 d贮存期内,同一处理下山奈酚变异系数最小,随贮存过程其提取率的变异程度最小,稳定性最好。贮存后,二氢黄酮甙提取率相对初始值均增大,推测原因:二氢黄酮甙是一种黄酮类苷,由芸香糖基与橙皮苷元组成,贮存后,木薯叶片内芸香糖基与橙皮苷元结合形成二氢黄酮甙增多,故提取率越高[21];儿茶素、芦丁、二氢黄酮甙、槲皮素、山奈酚、穗花杉双黄酮提取率相对初始值增加最大的处理分别为SC09-60、SC205-110、SC09-120、SC205-60、SC205-110、SC09-120,相对初始值平均增大211.60%、44.89%、538.08%、186.39%、7.27%、17.60%,提取率随贮存期变异系数为38.89%、6.94%、39.58%、50.06%、4.59%、18.47%,其中芦丁、山奈酚变异系数均小于10%,变异程度小,儿茶素、二氢黄酮甙、槲皮素、穗花杉双黄酮变异系数均大于18%,并大于本实验6个处理中对应成分的平均变异系数值,变异程度大,说明120 d贮存过程中,芦丁在SC205-110、山奈酚在SC205-110 茎叶中提取率相对初始值显著稳定增大。儿茶素在SC09-60、二氢黄酮甙在SC09-120、槲皮素在SC205-60、穗花杉双黄酮在SC09-120 茎叶贮存过程中提取率相对初始值虽显著增大,但不稳定。SC205在110 ℃干燥后贮存芦丁、山奈酚提取效果稳定提高,为利用木薯茎叶中芦丁、山奈酚的优选预处理方法条件。
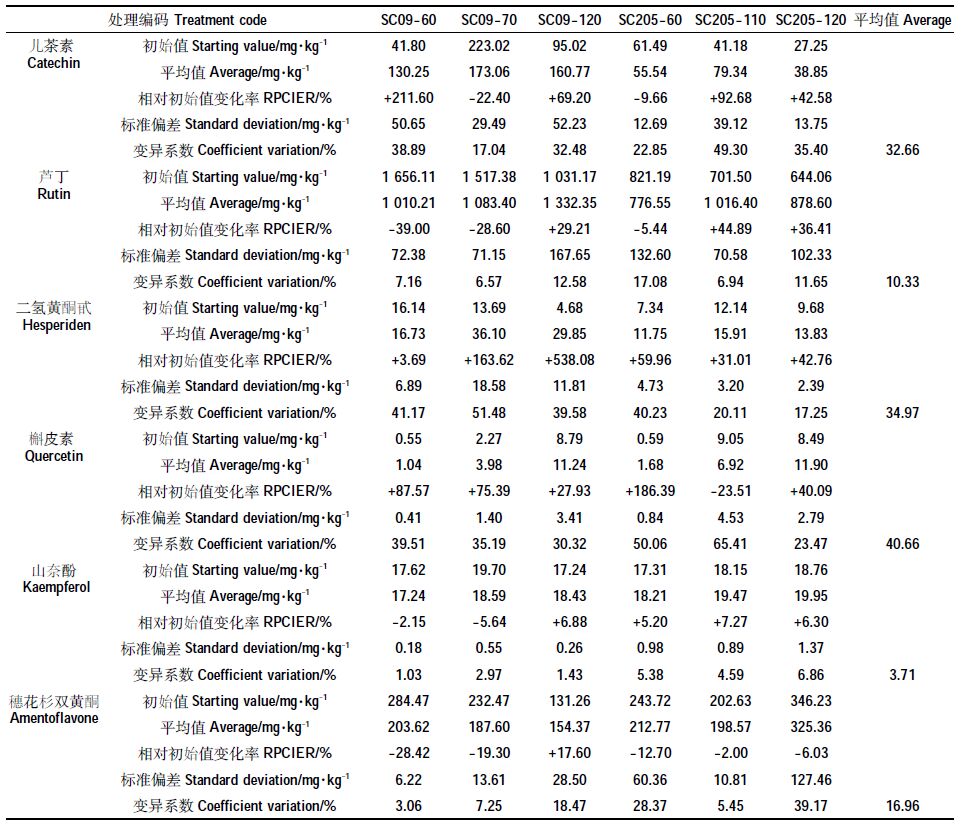
|
120d贮存过程中,儿茶素、芦丁、槲皮素、山奈酚、穗花杉双黄酮提取率相对初始值平均减小程度最大的处理分别为SC09-70、SC09-60、SC205-110、SC09-70、SC09-60,相对初始值下降22.40%、39.00%、23.51%、5.64%、28.42%,,提取率在贮存期内变异系数为17.04%、7.16%、65.4%、2.97%、3.06%,除儿茶素、槲皮素外其他3 种成分提取率变异系数均小于10%,变异程度小,槲皮素变异系数为各处理中最大值,说明山奈酚在SC09-70、芦丁、穗花杉双黄酮在SC09-60 处理茎叶中提取率显著稳定下降,儿茶素在SC09-70、槲皮素在SC205-110 处理茎叶中提取率虽显著下降,但不稳定。即SC09 木薯叶在60 ℃干燥后贮存芦丁、穗花杉双黄酮提取效果及在70 ℃干燥后贮存山奈酚提取效果均会稳定下降,利用木薯茎叶中芦丁、穗花杉双黄酮、山奈酚的应优先舍去这些相应的预处理方法。各处理中,SC205-110 中穗花杉双黄酮提取率相对初始平均下降2%,基本不变,下降水平仅次于其提取率相对初始值增加最大的处理SC09-120,并且其变异系数小,为5.45%,变异程度小;SC205-120 中二氢黄酮甙、槲皮素提取率变异系数最小,为17.25%、23.47%,对应相对初始值平均提升42.76%、40.09%。即SC09 茎叶在110 ℃下干燥贮存可保证穗花杉双黄酮、SC205 茎叶在120 ℃下干燥贮存可保证二氢黄酮甙、槲皮素在120 d贮存期内成分提取率不显著下降,可作为利用该3 种成分相应的预处理方法。
3 讨论木薯叶黄酮成分丰富,研究手段的局限性与复杂性限制了新种类的发现。目前从不同种植地、不同品种木薯叶片中已鉴定的木薯叶黄酮成分有12种[8 -10,20 -22](槲皮素、山奈酚、芦丁、clovin、杨梅素-3-O-芸香糖苷、金丝桃苷、刺槐甙、烟花甙、水仙甙、二氢黄酮甙、穗花杉双黄酮、儿茶素)。在研究过程中,笔者发现,同一品种的某一干燥温度下6 种类黄酮成分提取率测定值之和均小于相应的总黄酮提取率测定值,原因分析如下:(1)总黄酮及黄酮成分提取率采用的测定方法不一样;(2)未知黄酮成分待分析测定。总黄酮提取液经NaNO2-Al(NO3) 3- NaOH显色法后,用分光光度法测定总黄酮含量,操作简便,不需预先知道提取物中黄酮成分,对设备要求低[23]。由于木薯茎叶总黄酮提取物中含有大量的绿原酸、花青素及其他酚类成分[18],对分光光度法的显色测定产生一定干扰,所以试验结果偏高。高效液相色谱(HPLC)干扰少,误差小,结果较准确,但该法对样品纯度的要求很高,前处理较复杂,需预先知道提取物中黄酮成分,并需要合适的标准品,制约了该方法对未知成分的定量[24]。在本文研究过程中,我们发现在液相条件下还存在除6种成分峰之外的吸收峰,该成分还有待于用质谱、核磁共振等方法进一步分析与鉴定。
木薯茎叶总黄酮及成分提取率因品种及干燥温度差别很大。笔者认为,其原因为:(1)不同木薯品种茎叶,黄酮成分本身存在差异。黄酮作为一种植物体代谢产物,受生理生化活动影响大。本实验中选择的木薯SC09,为食用甜木薯品种,而木薯SC205 为产淀粉品种,其特征是块茎产量与淀粉含量高,不同品种对环境的响应差别大,进而影响代谢产物黄酮成分的产生和积累。研究表明,同一植物不同品种的黄酮含量差别大。(2)叶片干燥温度改变物料的物理化学属性。干燥过程中,水分子热运动对植物细胞发生冲击,引起造成物料物理化学的变化[25],如细胞壁碎粒化程度、黄酮与细胞的结合力,某些成分由于受热降解也发生转化[26-27],进而影响溶剂渗透与黄酮溶解程度、黄酮分子内扩散阻力;另外,由于物料性质的改变,颗粒吸收能量的难易程度也随之变化。干燥温度不同,水分子产生的作用力亦不同,黄酮成分提取传质进程不一,最终表现为外在提取率的变化。结合图 1,笔者推测,40~60 ℃,水分子热运动作用力下,水分逐步脱出、细胞壁脆度增加、挥发性成分散失、黄酮分子与细胞结合力减小,故提取率与温度成正比;60~90 ℃,水分子热运动更加剧烈,热不稳定性黄酮分子发生氧化降解,提取率快速下降,品种间的成分差异性逐渐减小;90 ℃后,降解后的黄酮分子在热力下转化为其他稳定黄酮分子,温度越高,转化积累程度越大,故提取率与温度成正比。如图 2,对于不同的黄酮成分,随温度增大,也出现了双峰式的变化规律,只是在不同成分下峰点温度不同,这也印证了以上推测的合理性。
干燥植物样品在常温贮存过程中,黄酮成分变化受温度、湿度等因素的影响程度因样品性质差别很大。对于干燥木薯茎叶,是否会因吸湿作用,发生降解转化,如何转化还需进一步研究。本文研究条件下,从总黄酮提取率,处理SC09-120 与SC205-110 为相应木薯品种中各处理较高,并且在120 d贮存期内稳定性最好,SC09 茎叶经120 ℃干燥、SC205 茎叶经110℃干燥,总黄酮提取效果最好,可为利用木薯茎叶总黄酮采后干燥收储处理条件。从黄酮成分提取率,SC205-110 中芦丁与山奈酚,经贮存后成分提取效果最好,可为利用木薯茎叶中芦丁与山奈酚采后干燥收贮处理条件;SC205-120 中槲皮素与二氢黄酮甙在120 d贮存期内提取率稳定性最好,并且其相对初始提取率分别增加40.09%与42.76%,同理SC205-110中穗花杉双黄酮提取率在120 d贮存期内相对初始提取率基本不变,变异系数为5.45%,变异程度小,可作为利用木薯茎叶槲皮素与二氢黄酮甙、穗花杉双黄酮的采后干燥收储处理条件。综上,在利用木薯叶黄酮时,需依据利用的目标成分,选择合适的木薯品种及采后干燥温度,才能保证贮存过程中该成分提取效果较优。
4 结论随干燥温度增大,木薯嫩茎叶总黄酮提取率呈先升后降再升变化。40~80 ℃下,品种和温度均对提取率产生明显影响,90~120 ℃下,温度对提取率产生明显影响。120 ℃与110 ℃分别干燥后的SC09、SC205茎叶,总黄酮达较高提取峰值1.41%与1.53%,120 d贮存期内稳定性最好。
在不同干燥温度(40~120 ℃)下,木薯嫩茎叶黄酮成分的提取程度为:芦丁>(穗花杉双黄酮或儿茶素)>山奈酚>二氢黄酮甙>槲皮素。木薯品种对儿茶素与二氢黄酮甙提取率影响程度大于干燥温度,其他4 种成分则反之。品种和温度分别对儿茶素与芦丁的提取率影响最大,对山奈酚提取率影响均最小。
干燥嫩茎叶贮存后,二氢黄酮甙提取程度增大,其他5 种成分随品种、温度增减不一;山奈酚提取率变异系数(CV)最小,其值为1.03%~6.86%,稳定性最好;110 ℃干燥后SC205 嫩茎叶中芦丁和山奈酚的提取程度增加最大,增加率分别为44.89 %和7.27%,变异程度小(CV 为4.59%、6.94%),提取率稳定性好;儿茶素、穗花杉双黄酮、槲皮素、二氢黄酮甙提取率的最大提升率分别为211.60%、17.60%、186.39%、538.08%,但贮存期内变异程度大(CV=18.47%~50.03%),不稳定。
综上,选择合适的木薯品种及干燥温度,是保证采后干燥收贮叶片中目标黄酮成分提取效果最优的必要条件。
| [1] | 李开绵, 林雄, 黄洁, 等. 木薯饲用型品种的筛选[J]. 热带作物学报 , 1999, 20 (4) : 62–70. LI Kai-mian, LIN Xiong, HUANG Jie, et al. Selection of feed cassava varieties(Manihot esculanta Crantz)[J]. Chinese Journal of Tropical Crops , 1999, 20 (4) : 62–70. (in Chinese) |
| [2] | 唐浩强. 黄酮类化合物研究[M]. 北京: 科学出版社 ,2008 . TANG Hao-qiang. Flavonoids study[M]. Beijing: Science Press , 2008 . (in Chinese) |
| [3] | 陶海腾, 陈晓明, 吕飞杰, 等. 木薯叶黄酮类化合物提取研究[J]. 食品研究与开发 , 2009, 30 (12) : 12–15. TAO Hai-teng, CHEN Xiao-ming, LV Fei-jie, et al. Study on the extraction of flavonoids from cassava leaves[J]. Food Research and Development , 2009, 30 (12) : 12–15. (in Chinese) |
| [4] | 杨柳, 欧阳绍湘, 张仕斌, 等. 银杏叶黄酮含量变化规律及其干燥方式的研究[J]. 林产化学与工业 , 1999, 19 (2) : 31–34. YANG Liu, OUYANG Shao-xiang, ZHANG Shi-bin, et al. Studies on variation of flavone contents of ginkgo leaves and their drying method[J]. Chemistry and Industty of Forest Products , 1999, 19 (2) : 31–34. (in Chinese) |
| [5] | 郝倩, 曾会明, 张振文, 等. 木薯叶提取液制备及其对甲鱼生长的影响[J]. 热带作物学报 , 2013, 34 (8) : 1598–1602. HAO Qian, ZENG Hui-ming, ZHANG Zhen-wen, et al. Liquid extracting from cassava leaves and its effects on growth of soft-shell turtles[J]. Chinese Journal of Tropical Crops , 2013, 34 (8) : 1598–1602. (in Chinese) |
| [6] | 李兵, 何翠薇, 陈青青, 等. 广西木薯叶总黄酮提取工艺及抗菌性研究[J]. 湖北农业科学 , 2014, 53 (23) : 5816–5819. LI Bing, HE Cui -wei, CHEN Qing-qing, et al. Extracting of total flavonoids from Guangxi cassava leaves and its antimicrobial properties[J]. Hubei Agricultural Sciences , 2014, 53 (23) : 5816–5819. (in Chinese) |
| [7] | Tao Hai-teng, Qiu Bin, Du Fang-ling, et al. The protective effects of cassava(Manihot esculenta Crantz)leaf flavonoid extracts on liver damage of carbon tetrachloride injured mice[J]. African Journal of Traditional, Complementary&Alternative Medi , 2015, 12 (1) : 52. |
| [8] | Kubo I, Masuoka N, Nihei K-I, et al. Manicoba, a quercetin-rich Amazonian dish[J]. Journal of Food Composition and Analysis , 2006, 19 (6-7) : 579–588. DOI:10.1016/j.jfca.2006.02.007 |
| [9] | Tanaka Y, Data E S, Hirose S, et al. Bioehemical changes in secondary metabolites in wbunded and deteriorated cassava roots[J]. Agricultural and Biological Chemistry , 1983, 47 (4) : 693–700. |
| [10] | 李姗姗, 戴好富, 赵友兴, 等. 海南产木薯茎化学成分研究[J]. 热带亚热带植物学报 , 2012, 20 (2) : 197–200. LI Shan-shan, DAI Hao-fu, ZHAO You-xing, et al. Chemical constituents from the stems of cassava(Manihot esculenta Crantz)in Hainan[J]. Journal of Tropical and Subtropical Botany , 2012, 20 (2) : 197–200. (in Chinese) |
| [11] | 何翠薇, 陈玉萍, 覃洁萍, 等. 木薯茎杆及叶化学成分初步研究[J]. 时珍国医国药 , 2011, 22 (4) : 908–909. HE Cui-wei, CHEN Yu-ping, QIN Jie-ping, et al. Preliminary tests for chemical components of cassava,s stems, peels and leaves[J]. Lishizhen Medicine and Materia Medica Research , 2011, 22 (4) : 908–909. (in Chinese) |
| [12] | 程华平, 俞飞飞, 鲁中原. 烘干温度对银杏黄酮含量的影响[J]. 安徽农学通报 , 1998, 4 (4) : 36–37. CHENG Hua-ping, YU Fei-fei, LU Zhong-yuan. Effect of drying temperature on the content of flavonoids in ginkgo biloba[J]. Anhui Agric Sci Bull , 1998, 4 (4) : 36–37. (in Chinese) |
| [13] | 刘志辉, 冯淑琴, 李国荣. 不同采收时间及干燥方法对黄蜀葵花总黄酮含量的影响[J]. 南京中医药大学学报 , 1999, 15 (3) : 157–158. LIU Zhi-hui, FENG Shu-qin, LI Guo-rong. Changes of total flavone in Abelmoschus Manihot Medic affected by time difference in collection and different drying method[J]. Journal of Nanjing University of TCM , 1999, 15 (3) : 157–158. (in Chinese) |
| [14] | 辛敏甲, 黎莉, 周文, 等. 干燥温度和采收时间对湖北产连钱草总黄酮含量的影响[J]. 亚太传统医药 , 2009, 5 (12) : 11–12. XIN Min-jia, LI li, ZHOU Wen, et al. Study on the influence of the contents of total flavones from Herba Glechomæ growing in Hubei Province by drying temperature and harvest time[J]. AsiaPacific Traditional Medicine , 2009, 5 (12) : 11–12. (in Chinese) |
| [15] | Chen Mei-ling, Yang Deng-jye, Liu Shih-chuan. Effects of drying temperature on the flavonoid, phenolic acid and antioxidative capacities of the methanol extract of citrus fruit(Citrus sinensis(L.)Osbeck) peels[J]. International Journal of Food Science & Technology , 2011, 46 (6) : 1179–1185. |
| [16] | 孙君明, 韩粉霞, 丁安林, 等. 储藏温度与时间对大豆子粒中异黄酮含量的影响[J]. 大豆科学 , 2004, 23 (2) : 243–248. SUN Jun-ming, HAN Fen-xia, DING An-lin, et al. Effect of storage temperature and time on the isoflavone content in soybean seeds[J]. Soybean Science , 2004, 23 (2) : 243–248. (in Chinese) |
| [17] | 乐巍, 王洋, 吴德康.不同采收期及贮藏时间广陈皮中黄酮类成分比较[C]. 全国第8届天然药物资源学术研讨会论文集: 539-542. LE Wei, WANG Yang, WU De-kang. Comparison of flavonoids in pericarpium citri reticulatæ at different harvest and storage time[C]. The 8th National Symposium on Natural Medicinal Material Resources Proceedings and Abstracts: 539-542.(in Chinese) |
| [18] | Régnier C, Bocage B, Archimède H, et al. Digestive utilization of tropical foliages of cassava, sweet potatoes, wild cocoyam and erythrina in Creole growing pigs[J]. Animal Feed Science and Technology , 2013, 180 (1-4) : 44–54. DOI:10.1016/j.anifeedsci.2012.12.007 |
| [19] | 许成帅, 李伯松, 李克烈, 等. 烘干脱毒对木薯叶中氰化物和总黄酮含量的影响[J]. 中国农学通报 , 2016, 32 (5) : 33–36. XU Cheng-shuai, LI Bo-song, LI Ke-lie, et al. Effect of drying detoxification on cyanide and total flavonoids in cassava leaves[J]. Chinese Agricultural Science Bulletin , 2016, 32 (5) : 33–36. (in Chinese) |
| [20] | 陶海腾. 木薯叶黄酮类化合物的提取与功能评价[D]. 北京:中国农业大学, 2009. TAOHai-teng.Extraction and function evaluation of flavonoids in cassava leaves[D]. Beijing: China Agricultural University, 2009.(in Chinese) |
| [21] | 曹臣, 袁梦石, 黄开颜. "陈皮须用隔年陈"之探讨[J]. 中医药导报 , 2006, 12 (6) : 92–93. CAO Chen, YUAN Meng-shi, HUANG Kai-yan. Investigation on that "orange peel should use in the next year"[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy , 2006, 12 (6) : 92–93. (in Chinese) |
| [22] | 何翠薇, 覃洁萍, 黄俏妮. HPLC法测定木薯叶中芦丁的含量[J]. 中国药房 , 2011, 22 (23) : 2160–2161. HE Cui-wei, QIN Jie-ping, HUANG Qiao-ni, et al. Content determination of rutin in manihot esculenta leaves by HPLC[J]. China Pharmacy , 2011, 22 (23) : 2160–2161. (in Chinese) |
| [23] | 柴建新, 万茵, 付桂明, 等. 杜仲叶总黄酮含量测定方法优化[J]. 中国食品学报 , 2013, 13 (4) : 225–230. CHAI Jian-xin, WAN Yin, FU Gui-ming. Optimization of determination method of total flavonoids from eucommia ulmoides oliv. leaves[J]. Journal of Chinese Institute of Food Science and Technology , 2013, 13 (4) : 225–230. (in Chinese) |
| [24] | 高晓霞, 徐荣, 陈君, 等. 不同种质黄芩中黄酮类成分测定及分析[J]. 中国现代中药 , 2016, 18 (3) : 343–347. GAO Xiao-xia, XU Rong, CHEN Jun, et al. Determination and analysis of flavonoids ingredients of different scutellariæ radix germpl-asm[J]. Modern Chinese Medicine , 2016, 18 (3) : 343–347. (in Chinese) |
| [25] | 宋洪波, 毛志怀. 干燥方法对植物产品物理特性影响的研究进展[J]. 农业机械学报 , 2005, 36 (6) : 117–121. SONG Hong-bo, MAO Zhi-huai. Review of drying methods on the physical characteristics of plant materials[J]. ransactions of the Chinese Society for Agricultural Machinery , 2005, 36 (6) : 117–121. (in Chinese) |
| [26] | 管汉亮, 钱大玮, 段金廒, 等. 银杏叶干燥方法的优化及其机制探讨[J]. 中国中药杂志 , 2013, 38 (13) : 2140–2146. GUAN Han-liang, QIAN Da-wei, DUAN Jin-ao, et al. Study on optimization of drying method and its mechanism in ginkgo biloba leaves[J]. China Journal of Chinese Materia Medica , 2013, 38 (13) : 2140–2146. (in Chinese) |
| [27] | 赵宇新. 芦丁分解速度与加热温度的相关性[J]. 中国实验方剂学杂志 , 2011, 17 (18) : 101–103. ZHAO Yu-xin. The relationship between decomposition of rutin and heated temperature[J]. Chinese Journal of Experimental Traditional Medical Formulæ , 2011, 17 (18) : 101–103. (in Chinese) |
 2017, Vol. 34
2017, Vol. 34




