文章信息
- 梁韵, 赵丽, 黄丹枫
- LIANG Yun, ZHAO Li, HUANG Dan-feng
- 土壤与基质栽培系统对生菜(Lactuca sativa)根际细菌群落的影响
- Effects of Soil and Substrate Cultivation on Lettuce Rhizosphere Bacterial Community
- 农业资源与环境学报, 2017, 34(1): 73-79
- Journal of Agricultural Resources and Environment, 2017, 34(1): 73-79
- http://dx.doi.org/10.13254/j.jare.2016.0147
-
文章历史
- 收稿日期: 2016-06-02
根系微生物与植物根系形成一个微生态系统,发生着活>的营养物质循环,根际微生物能够通过多种机制促进植物对养分的吸收[1],继而改善其品质。根际土壤相比非根际土壤,微生物多样性大大提高[2],微生物多样性一直是衡量土壤健康的重要标准,土壤微生物多样性能够反映土壤微生物的丰富度和生物群落的稳定性,土壤生态系统的功能很大程度由其微生物功能决定[3]。土壤微生物总量的70%~90% 是细菌,相对其他的微生物,其生长速度较快[4],在不同的栽培方式中它们都能迅速适应环境以达到存活和稳定的最佳水平,并且细菌群落在灭菌的土壤中能迅速重建[5]。细菌能够利用种类广泛的碳源及氮源,对土壤碳氮元素循环起着重要作用[6-7]。因此根际细菌群落能够成为栽培植物的根际营养库[8],是植物健康生长的重要因素。近年来,基质栽培以其产量高、栽培条件容易控制等优点,成为蔬菜种植中广泛采用的一种方式[9]。关于土壤和基质栽培蔬菜的农艺性状、产量和品质对比研究也越来越多。刘景霞等[10]发现基质较土壤栽培蔬菜生长势更强、开花更早,产量和品质显著提高。Selma等[11]对比基质和土壤两种栽培系统中生菜的生长情况,结果表明土培的生菜质量和可溶性糖含量较高,基质栽培的生菜中Vc 含量和质构属性更优越。栽培方式除了对地上部分有影响,也会对地下部分的根际微生物群落产生影响[12],陈双臣等[13]发现有机基质栽培较土壤栽培,微生物数量和酶活性都显著增加,不同管理模式的土壤以及不同类型的基质呈现不同的微生物群落[14-15]。然而,关于基质与土壤栽培微生物尤其细菌多样性的差异鲜有报道。本研究以不同生菜品种根际土壤和基质为供试材料,旨在探讨两种栽培系统对灭菌后重新建立的细菌群落产生的影响。
1 材料与方法 1.1 试验材料与试验设计生菜品种为“申选5号”与“罗莎红”,均购于上海市农业科学院园艺研究所。土壤采自上海交通大学(31°01’N,121°25’E),土质为黏土,土壤肥力中等,基质按照泥炭、蛭石和珍珠岩以常用配比9:3:1(V:V:V)混合而成。土壤与基质于180 ℃烘箱灭菌3 h,土壤、基质以及土壤栽培系统的微生物主要源于植物移栽,栽培植物使用的工具、灌溉水以及空气,在同一栽培条件下建立各自新的微生物群落。
试验于2015 年5—6 月在上海交通大学农业与生物学院温室内进行。以水培的方式育苗,待第一真叶展开后,分别选取长势接近的生菜定植于园艺盆(22 cm ×32 cm ×15 m)中,每盆10 株。实验设计共4个处理:“申选5 号”的土壤栽培;“申选5 号”的基质栽培;“罗莎红”的土壤栽培;“罗莎红”的基质栽培。每处理重复3次,每重复1 盆,将各盆随机排列。每7 d施1次肥,肥料为按4 倍稀释的霍格兰德营养液,按照通常施肥量每次施入250 mL,各个处理施肥量相同。不定期浇水,保持60%的湿度。
1.2 采样栽培30 d后,随机挑选5株长势接近的生菜,将根置于灭过菌的培养皿上,轻轻晃动至没有土壤/基质掉落,将土壤/基质混匀获得根际土壤/基质,于-80℃保存,用作微生物分子学分析。在5 株植物根系附近3 cm 采集5 个土壤/基质样品,混匀后保存于-20℃,用作分析土壤理化性质:pH 值、硝态氮、铵态氮、有效磷、有效钾、含水量,等。
1.3 DNA 提取以及16S rRNA PCR-DGGE 分析 1.3.1 DNA 提取取500 mg根际土壤/基质,使用土壤DNA 提取试剂盒E,Z,N,A,TMSoilDNAKitD5625-01(OMEGA,美国)提取DNA。通过微量紫外分光光度计Nan-oDrop1000(Thermo Fisher Scientific,美国)检测DNA的质量和浓度。
1.3.2 细菌16S rRNA PCR16S rRNA V3 区通过Veriti® 96-Well ThermalCycler(Applied Biosystems,USA)扩增。通过引物GCF338(5’-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAG-3’)和R518(5’-AT原TACCGCGGCTGCTGG-3’)(GC-clamp 序列为:5’-GGGCGGGGCGGGGGCACGGGGGGCCTACGGGAG -3’)进行PCR 扩增。反应体系(50 μL)包括:2.5 μLDNA 模板(40~100 ng),2.5 U DNA 聚合酶(TaKaRaLA Taq),5 μL 10×LA PCR 缓冲液域(Mg2+ plus),8μL dNTP 混合物(各2.5 mmol·L-1),上下游引物(10mol·L-1)各1 mL,2.5 μL乙酰胺,29.5 μL 菌双蒸水。PCR 反应条件为:94 ℃预变性7 min;40 个循环为94℃30 s,62 ℃45 s,72℃30s;最后在72 ℃下延伸10min。PCR反应产物用1%的琼脂糖凝胶电泳检测,4℃保存PCR 反应产物,PCR 扩增片段长约200 bp。
1.3.3 16S rRNA PCR产物的变性梯度凝胶电泳使用Bio-Rad 公司的DCodeTM Universal MutationDetection System 对16S rRNA PCR 扩增产物进行PCR-DGGE 电泳。聚丙烯酰胺凝胶浓度为8%,变性梯度为45%~64%(100% 变性剂包含7 mol·L-1 ureaand 40% formamide)。将稀释3 倍后的PCR 产物30μL 和6 μL 的6×Loading Buffer 充分混匀后加入上样孔。胶板置于1×TAE 电泳液,在70 V电压和60 ℃恒温条件下电泳15 h。电泳完毕后,取出胶板在避光条件下进行银染。
1.4 Real-Time PCR检测细菌16S rRNA 丰度通过引物338-GC/518 获得16S rRNA V3 扩增产物,用1%琼脂糖对PCR 产物电泳,使用无菌刀片对目的条带进行切胶,使用SanPrep 柱式DNA 胶回收试剂盒(上海生工生物工程股份有限公司)对条带进行回收纯化。纯化产物与pMD19-T 载体(Takara,大连)进行连接,并按照操作手册将载体转化到E.coli109(Takara,大连)感受态细胞中,在含有氨苄青霉素的LB 液体培养基中经过培养后,提取载体,使用微量紫外分光光度计NanoDrop1000(Thermo Fisher Sci-entific,美国)检测质粒的质量和浓度,将阳性质粒依次稀释10倍(1010~10)成10 个梯度,每个梯度3 次重复,选取扩增效率在101%~103% 数据,根据质粒浓度换算成的基因拷贝数制备基因拷贝数与Cq 值相关性的标准曲线。R2在0.97~0.99 间可接受,并且标准曲线的斜率在-3.1 与-3.5 间为可用的标准曲线。定量每μL DNA 中的基因拷贝数后,将拷贝数进行LOG 转换用于数据分析。
采用Real-Time PCR 试剂盒SYBR® Premix ExTaqTM(TaKaRa)在LightCycler® 96 实时荧光定量PCR仪(Roche Applied Science)上运行,扩增反应体系20μL,SYBR® Premix Ex TaqTM(2×)10 μL,上下游引物(10 mmol·L-1)各0.4 μL,DNA 模板2 μL,灭菌双蒸水7.2 μL。反应程序为:94 ℃10 min,94 ℃20 s,55 ℃20s,72℃20 s,40个循环。最后获得溶解曲线:95 ℃10 s,65 ℃60 s,97 ℃1 s。
1.5 土壤理化性质分析土样与去离子水1:5 W/V 混合震荡1 h后取过滤液测pH 值。铵态氮、硝态氮和含水量的测定采用鲍士旦[16]的方法。有效磷、有效钾的测定方法以NY/T1121《土壤检测》为标准,总氮、总碳的测定使用元素分析仪(Elemental Analysis,德国),钙、镁、铜、锌的测定使用电感耦合等离子体发射光谱仪(Perkinelmer,美国)。供试土壤/基质理化性质见表 1。
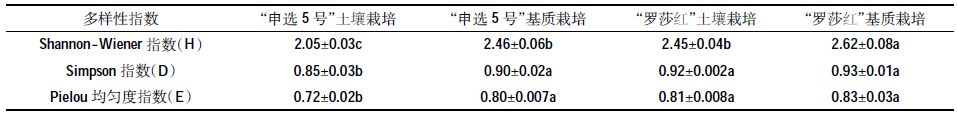
通过Bio-Rad 公司提供的凝胶成像分析软件QuantityOne 对PCR-DGGE 图谱进行分析,通过样品条带的数目和灰度来评估细菌种类和相对数量。采用UPGMA 法根据图谱OUT 矩阵得到的Dice 系数对不同的泳道进行聚类分析。土壤微生物多样性采用Shannon-Wiener 指数(H)、Simpson 指数(D),Pielou均匀度指数(E)进行评价,根据电泳图谱样品条带的数目和灰度,对H,D,E 进行分析,计算公式如下[17]:
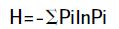
|
(1) |
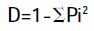
|
(2) |
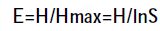
|
(3) |
其中,Pi 是单一条带的强度占所有条带强度总和的比值,S 是某一样品中所有条带数目的总和。
数据用Microsoft Excel 2007进行处理,Real-TimePCR 标准曲线的制备、聚类、主成分以及显著性分析、RDA 分析利用R3.2.3 软件进行。
2 结果与分析 2.1 土壤与基质栽培后理化性质分析栽培后基质与土壤的理化性质存在显著差异(表 2),整体来看,基质的总碳、总氮、碳氮比、含水量、铵态氮、有效磷、有效钾均显著高于土壤,而土壤的pH值显著高于基质(P<0.05)。“申选5 号”例外,其基质的硝态氮低于土壤。栽培不同生菜品种的基质中,“罗莎红”基质中的铵态氮、硝态氮、有效磷、有效钾、总碳含量显著高于“申选5号”基质。栽培不同生菜品种的土壤中,“罗莎红”土壤与“申选5 号”土壤仅pH 值存在差异,为“罗莎红”高于“申选5 号”。
根据质粒浓度换算成的基因拷贝数与Cq 值得到16S rRNA 绝对定量PCR 标准曲线为:y=-3.115x+36.752 14,R2=0.996,E=109%(y 表示Cq 值,x 表示LOG 转化后的基因拷贝数)。由图 1 可知,栽培相同品种的基质与土壤中16S rRNA 的丰度差异显著,即基质与土壤的根际细菌数量差异显著(P<0.05):基质大于土壤;相同栽培系统,品种间差异不显著,但在基质和土壤中,“申选5 号”的根际细菌数量均高于“罗莎红”。细菌数量与pH值呈显著负相关(R2=0.822 3,P=0.001),与含水量(R2=0.896 2,P<0.000 1)、碳氮比(R2=0.903 1,P<0.000 1)、铵态氮(R2=0.950 7,P<0.000 1)、硝态氮(R2 =0.724 9,P<0.001)、有效磷(R2=0.941 7,P<0.0001)、有效钾(R2=0.896 2,P<0.000 1)呈极显著正相关。

|
| 图 1 16S rRNA在各个处理中的丰度 Figure 1 The abundance of 16S rRNA in different treatments |
图 2 中可以发现每个栽培系统都有自己的特有条带:7、10为土壤特有条带,2、6为基质特有条带;相同条带灰度也存在差别:条带8 在土壤中更为明显(条带灰度较高),而1、3、5 在基质中更明显。代表不同品种的泳道中也存在条带的差异:3 为“申选5 号”特有条带,1、7、8、10 在“申选5 号”中更为明显。对于“申选5 号”,土壤的7、8 比基质的明显,并且有9、10、11 特异条带。对于“罗莎红”,基质出现更多土壤没有的明显带:6’和5’。
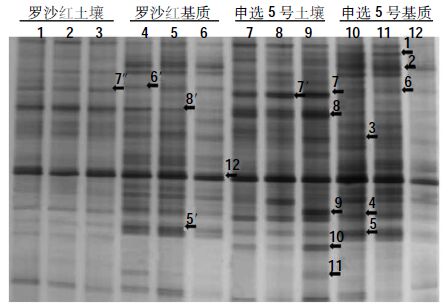
|
| 图 2 基质与土壤细菌PCR-DGGE 图谱 Figure 2 PCR-DGGE community fingerprints of 16S rRNA gene fragments obtained from substrate and soil |
土壤栽培与基质栽培的根际细菌群落多样性结果如表 3。“申选5号”基质栽培的根际细菌群落多样性显著高于土壤栽培(P<0.05)。“罗莎红”土壤栽培与基质栽培的根际细菌群落多样性指数中,Shannon-Wiener 指数有显著差异(P<0.05),同样为基质高于土壤,Simpson 指数和Pielou 均匀度指数差异不显著(P>0.05)。栽培方式是影响根际细菌群落多样性的主要因素,对于“申选5号”这种影响尤其明显。多样性指数H 与碳氮比相关性为极显著正相关(R2=0.709 0,P<0.01)。
|
UPGMA 法聚类结果表明,相同栽培系统聚为一类(图 3),DGGE 图谱中共有的条带比较多,条带灰度比较接近,即相同栽培系统共有的细菌种类比较多,细菌群落有较高的相似性,而不同栽培系统下的根际细菌优势细菌的数量以及种类均不同,呈现不同的细菌群落,体现了栽培系统对根际细菌群落的塑造作用。

|
| 聚类分析图谱由R3.2.3生成,数据分析采用DICE 系数,聚类分析使用UPGMA法,j表示基质栽培,s代表土壤栽培,a代表品种“申选5 号”,b 代表品种“罗莎红”。下同 图 3 PCR-DGGE 条带聚类分析图 Figure 3 Cluster analysis figure for PCR-DGGE bands |
通过细菌群落与土壤/基质理化性质的RDA 分析图(图 4)可以看出,12 个样品分成4 组,相同处理的菌群聚在一起,土壤菌群在y 轴上方,基质菌群基本在y轴下方,这与聚类的结果一致。土壤都在第二象限,其细菌群落分布主要受pH 值的影响。“申选5号”的基质在第三象限,主要受硝态氮影响,并且与硝态氮的含量是正相关。“罗莎红”的基质菌群基本在第四象限,主要受碳氮比、含水量、铵态氮、有效磷、有效钾的影响,并且呈正相关。细菌群落主要出现在y 轴下方,第二象限最少,即基质样品的细菌群落能代表大部分细菌,与多样性指数的结果一致。
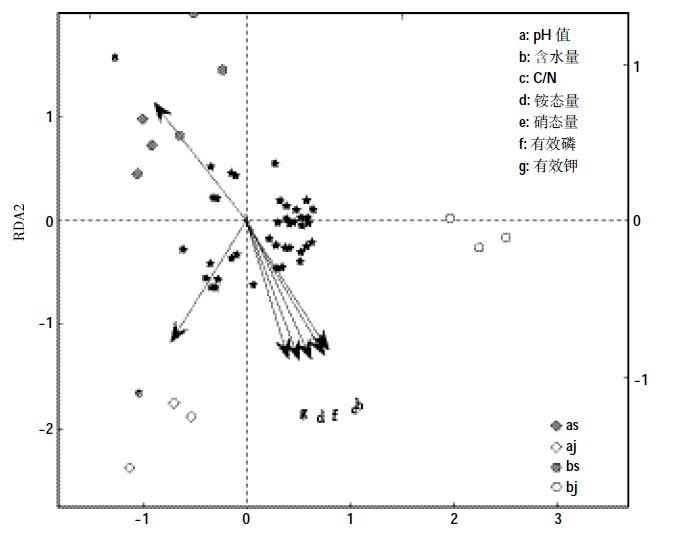
|
| ★代表DGGE图谱中条带 图 4 细菌群落与土壤/基质理化性质的RDA 图 Figure 4 RDA elucidates the relationships between bacterial community and soil and substrate physiochemical parameters |
本研究表明基质的根际细菌数量均高于土壤,这与基质中的碳氮比、含水量、铵态氮、硝态氮、有效磷、有效钾偏高相关[18],Zhang 等[19]发现土壤营养物质的增加,特别是硝态氮和有效磷,能够引起细菌数量的增加。在本研究中,除了上述因子含量较低造成以外,有可能是pH 值较高导致,较高pH 值不利于细菌生长,从而减少细菌的数量[20]。
本研究发现不同的栽培方式下,根际细菌群落的多样性有差别,基质多样性指数均高于土壤多样性指数,碳氮比、pH 值是影响多样性的主要因子,分别与多样性指数呈正相关和负相关,本研究中土壤pH 值在栽培前后都较高,土壤有可能出现适宜在弱碱性环境下生长的优势菌群,竞争抑制其他的菌群,从而细菌群落的多样性指数偏低。Fierer 等[21]的研究指出在全球范围内,土壤pH 值对于土壤细菌群落的多样性和结构具有决定性作用,Hallin 等[22]的研究中发现pH是土壤微生物群落结构的最佳预测指标。Kuang等[23]的研究同样发现不同pH值的土壤中,pH值较低的土壤多样性更高,与本文研究结果一致。Ding 等[24]发现有效磷的含量与Shannon-Wiener指数与Simpson指数有极显著的正相关,本研究中基质的有效磷含量较土壤高,也可能是基质的多样性比土壤高的原因。
对于“申选5 号”,基质中硝态氮含量低于“罗莎红”,在采样时,“申选5 号”基质栽培的地上部分干重显著高于土壤栽培,且显著高于罗莎红基质栽培(此数据在本文中未呈现),可推测“申选5 号”在基质中吸收硝态氮的能力比在土壤中强,并且比罗莎红在基质中吸收硝态氮的能力强。Pathan 等[25]发现氮利用效率高的玉米品种由于根际分泌物更加丰富,其根际细菌多样性更高,而在本研究中,“申选5号”的Shannon-Wiener指数却比罗莎红低,Simpson 指数与Pielou 均匀度指数没有差异,有可能是栽培时间有限,根际分泌物对细菌群落的塑造作用不及土壤/基质理化性质的作用,而不同品种对营养物质的吸收差异也会造成土壤/基质理化性质的差异。也有可能是因为PCR-DGGE 技术研究细菌群落的方法本身存在局限性,能探测到的细菌有限,并且DNA 提取和PCR 过程中的偏差都有可能影响多样性的结果。
土壤栽培与基质栽培的生菜根际细菌群落不同,主要起作用的理化因子是pH 值、硝态氮、碳氮比、含水量和有效磷,Ding 等[24]发现细菌群落与硝态氮的含量极显著相关,本研究中“罗莎红”的基质样品表现出独特的细菌群落可能是较高的硝态氮含量造成的,有待进一步研究。
4 结论基质与土壤在灭菌后重新建立细菌群落时,短期内基质栽培系统的根际细菌数量和多样性均高于土壤,主要原因为基质的营养物质含量高而pH 值较低。并且,品种因其对营养物质的选择性吸收,造成根际理化性质的差异,也会显著影响根际细菌。
| [1] | Richardson A E, Barea J M, McNeill A M, et al. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J]. Plant and Soil , 2009, 321 (1-2) : 305–339. DOI:10.1007/s11104-009-9895-2 |
| [2] | Mougel C, Offre P, Ranjard L, et al. Dynamic of the genetic structure of bacterial and fungal communities at different developmental stages of Medicargo truncatula Gærtn. cv. Jemalong line J5[J]. New Phytol , 2006, 170 : 165–175. DOI:10.1111/nph.2006.170.issue-1 |
| [3] | 腾齐辉. 有机肥施用对红壤氮素循环微生物相关基因多样性的影响[D].南京:南京农业大学, 2008. TENG Qi-hui. Functional gene diversity of microorganism related the circle of nitrogen under organic manure[D]. Nanjing: Nanjing Agricultural University, 2008.(in Chinese) |
| [4] | Bernard R Glick. The enhancement of plant growth by free-living bacteria[J]. Can JMicrobial , 1995, 41 : 109–117. DOI:10.1139/m95-015 |
| [5] | Marschner P, Rumberger A. Rapid changes in the rhizosphere bacterial community structure during re-colonization of sterilized soil[J]. Biology and Fertility of Soils , 2004, 40 (1) : 1–6. DOI:10.1007/s00374-004-0736-4 |
| [6] | 何莉莉, 杨慧敏, 钟哲科, 等. 生物炭对农田土壤细菌群落多样性影响的PCR-DGGE分析[J]. 生态学报 , 2014, 34 (15) : 4288–4294. HE Li-li, YANG Hui-min, ZHONG Zhe-ke, et al. PCR-DGGE analysis of soil bacterium community diversity in farmland influenced by biochar[J]. Acta Ecologica Sinica , 2014, 34 (15) : 4288–4294. (in Chinese) |
| [7] | Bardghtte R D, Freeman C, Ostle N. Microbial contributions to climate change through carbon cycle feedbacks[J]. Mulyidisciplinary Joural of Micbial Ecology , 2008, 2 (8) : 805–814. |
| [8] | Weller D M. Biological control of soilborne plant pathogens in the rhizosphere with bacteria[J]. Annual Review of Phytopathology , 1988, 26 (1) : 379–407. DOI:10.1146/annurev.py.26.090188.002115 |
| [9] | Molitor HD. Environmentally sound production in horticulture: The european way[J]. J Jpn Soc Hortic Sci , 1998, 67 (6) : 1224–1228. DOI:10.2503/jjshs.67.1224 |
| [10] | 刘景霞, 刘志敏, 朱亦赤, 等. 无土栽培基质对辣椒产量及品质的影响[J]. 南方园艺 , 2010, 21 (2) : 3–6. LIU Jing-xia, LIU Zhi-min, ZHU Yi-chi, et al. The effect of substrate on the quality and quantity of pepper[J]. South Horticulture , 2010, 21 (2) : 3–6. (in Chinese) |
| [11] | Selma M V, Luna M C, Martínez-Sánchez A, et al. Sensory quality, bioactive constituents and microbiological quality of green and red fresh-cut lettuces(Lactuca sativa L.)are influenced by soil and soilless agricultural production systems[J]. Postharvest Biology and Technology , 2012, 63 (1) : 16–24. DOI:10.1016/j.postharvbio.2011.08.002 |
| [12] | Martínez F, Castillo S, Borrero C, et al. Effect of different soilless growing systems on the biological properties of growth media in strawberry[J]. Scientia Horticulturæ , 2013, 150 : 59–64. DOI:10.1016/j.scienta.2012.10.016 |
| [13] | 陈双臣, 刘爱荣, 贺超兴, 等. 有机土栽培和土壤栽培番茄根际基质微生物和酶活性的比较[J]. 土壤通报 , 2010 (4) : 815–818. CHEN Shuang-chen, LIU Ai-rong, HE Chao-xing, et al. The difference of microbial activity and enzyme activity between organic soil cultivation and substrate cultivation[J]. Chinese Journal of Soil Science , 2010 (4) : 815–818. (in Chinese) |
| [14] | Lammel D R, Feigl B J, Cerri C C, et al. Specific microbial gene abundances and soil parameters contribute to C, N, and greenhouse gas process rates after land use change in southern Amazonian soils[J]. Frontiers in Microbiology , 2015 (6) : 1–14. |
| [15] | Koohakan P, Ikeda H, Jeanaksorn T, et al. Evaluation of the indigenous microorganisms in soilless culture: occurrence and quantitative characteristics in the different growing systems[J]. Scientia Horticulturæ , 2004, 101 (1) : 179–188. |
| [16] | 鲍士旦. 土壤农化分析(第三版)[M]. 北京: 中国农业出版社 ,2005 . BAO Shi-dan. Soil analysis(Third edition)[M]. Beijing: Chinese Agriculture Press , 2005 . (in Chinese) |
| [17] | 刘慧杰, 杨彩云, 田蕴, 等. 基于PCR-DGGE技术的红树林区微生物群落结构[J]. 微生物学报 , 2010, 50 (7) : 923–930. LIU Hui-jie, YANG Cai-yun, TIAN Yun, et al. Analyzing soil microbial community structure of red forest using PCR-DGGE technique[J]. Acta Microbiologica Sinica , 2010, 50 (7) : 923–930. (in Chinese) |
| [18] | 刘绍雄, 王明月, 王娟, 等. 基于PCR-DGGE技术的剑湖湿地湖滨带土壤微生物群落结构多样性分析[J]. 农业环境科学学报 , 2013, 32 (7) : 1405–1412. LIU Shao-xiong, WANG Ming-yue, WANG Juan, et al. Analyzing soil microbial community structure diversity from Jianhu westland lakeside zone using PCR-DGGE technique[J]. Journal of Agro-Environment Science , 2013, 32 (7) : 1405–1412. (in Chinese) |
| [19] | Zhang C, Liu G, Xue S, et al. Soil bacterial community dynamics reflect changes in plant community and soil properties during the secondary succession of abandoned farmland in the Loess Plateau[J]. Soil Biology and Biochemistry , 2016, 97 : 40–49. DOI:10.1016/j.soilbio.2016.02.013 |
| [20] | Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes:A review[J]. Plant and Soil , 2001, 237 : 173–195. DOI:10.1023/A:1013351617532 |
| [21] | Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America , 2006, 103 (3) : 626–631. DOI:10.1073/pnas.0507535103 |
| [22] | Hallin S, Jones C M, Schloter M, et al. Relationship between N-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment[J]. The ISME Journal , 2009, 3 (5) : 597–605. DOI:10.1038/ismej.2008.128 |
| [23] | Kuang J L, Huang L, HE Z L, et al. Predicting taxonomic and functional structure of microbial communities in acid mine drainage[J]. The ISME Journal , 2016, 10 (6) : 1527–1539. DOI:10.1038/ismej.2015.201 |
| [24] | Ding J, Jiang X, Ma M, et al. Effect of 35 years inorganic fertilizer and manure amendment on structure of bacterial and archæal communities in black soil of northeast China[J]. Applied Soil Ecology , 2016, 105 : 187–195. DOI:10.1016/j.apsoil.2016.04.010 |
| [25] | Pathan S I, Ceccherini M T, Pietramellara G, et al. Enzyme activity and microbial community structure in the rhizosphere of two maize lines differing in N use efficiency[J]. Plant&Soil , 2015, 387 (1) : 413–424. |
 2017, Vol. 34
2017, Vol. 34