文章信息
- 李月, 雷思聪, 石炎, 邱宇平
- LI Yue, LEI Si-cong, SHI Yan, QIU Yu-ping
- 土壤性质对1-丁基-3-甲基咪唑类离子液体吸附/脱附行为的影响
- Effects of Soil Characteristics on Sorption-Desorption of 1-butyl-3-methyl-imidazolium-based Ionic Liquids
- 农业资源与环境学报, 2017, 34(1): 30-37
- Journal of Agricultural Resources and Environment, 2017, 34(1): 30-37
- http://dx.doi.org/10.13254/j.jare.2016.0233
-
文章历史
- 收稿日期: 2016-09-28
离子液体(ILs)是一类由阴/阳离子构成的,室温下呈液态的有机熔融盐。它具有难挥发、不易燃、可设计等优良特性,被视为传统有机溶剂的“绿色”替代品[1-4]。大多数ILs 水溶性较大[2, 5],易在生产及应用过程中进入土壤/水环境,并难以生物降解[6-8]。因此,对环境而言,ILs难言“绿色”。
咪唑类ILs 工业应用广泛,其在土壤的吸附研究已有一些报道[8-10]。Stepnowski[11]最早发现土壤表面负电荷和ILs阳离子间存在静电作用。Mrozik 等[10]观察到,当长链烷基取代ILs 浓度较高时,存在双层吸附现象;二层ILs会与首层吸附的ILs形成很强的偶极相互作用。Studzińska 等[12]则认为,ILs 的吸附能力和土壤有机质含量有很大正相关性,推测ILs 疏水性基团可通过疏水作用与有机质结合,过程中可能存在氢键和π…π 作用等。从以上研究可知,ILs 在土壤中的吸附机制较为复杂,甚至存在相互冲突的学术观点。同时,由于研究的土壤样本量有限,因此得到的吸附规律还不普遍,有待更多的土壤样本来进行验证。
本文选用两种阴离子差异较大的1-丁基-3-甲基咪唑类ILs,研究了系列土壤对其的吸附-脱附行为,通过分析土壤理化性质(阳离子交换量、总有机碳含量、土壤质地等)与ILs 土壤吸附之间的定量关系,探讨了土壤对该类ILs的吸附机理。
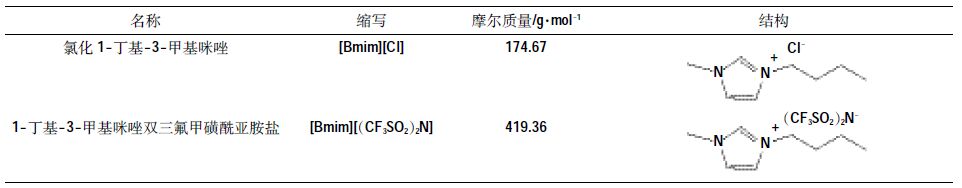
1 材料与方法 1.1 试剂与仪器试剂:CaCl2,BaCl2·2H2O,NH4Cl,MgSO4·7H2O,KH2PO4,H3PO4,乙腈,异丙醇等(国药集团化学试剂有限公司),以上所用试剂均为分析纯。氯化1-丁基-3-甲基咪唑([Bmim][Cl]),1-丁基-3-甲基咪唑双三氟甲磺酰亚胺盐([Bmim][(CF3SO2) 2N])(上海成洁化工科技有限公司),纯度均大于98%,离子液体结构式见表 1。
仪器:高效液体色谱仪HPLC-Agilent1200(AgilentTechnologies,Santa Clara,CA,USA)、总有机碳分析仪(岛津),马尔文MS-3000 粒度仪(Mastersizer 3000,Malvern Instruments,England),pH 计(雷磁),电导率仪(雷磁),旋转培养器(Kylin-Bell Lab Instruments Co.,Ltd,Haimen),恒温培养箱(上海一恒科学仪器有限公司)。
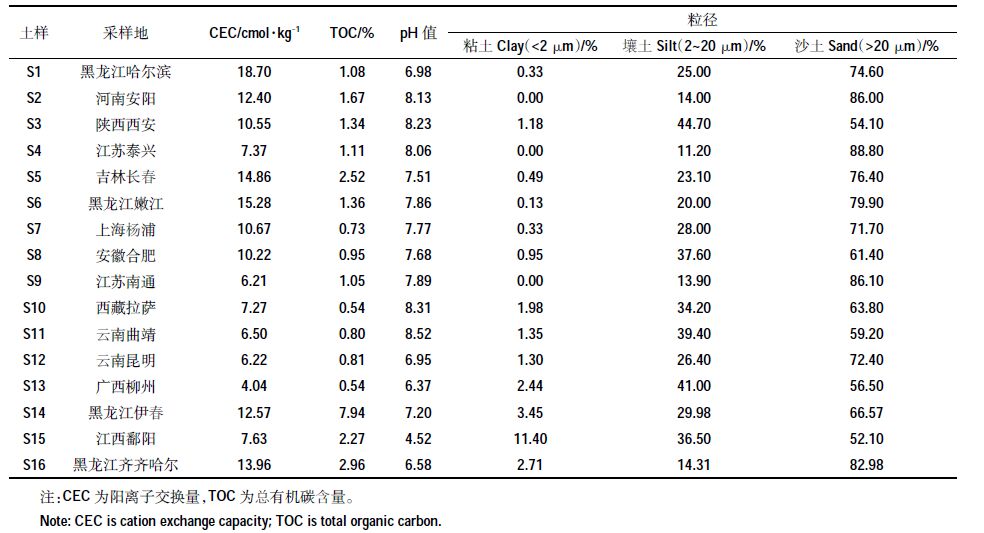
1.2 试验土壤及理化性质测定本课题的16种土壤样品采自中国不同地区的表层土壤(0~20 cm),经室温风干后研磨过筛(1 mm)备用。土壤阳离子交换量采用BaCl2-MgSO4法[13]测定;利用总有机碳分析仪测量土壤的总有机碳含量;应用马尔文MS-3000 粒度仪测定土壤的粒度分布;土壤的pH值在土壤/水比为1颐2 条件下用pH计测定。
1.3 吸附-脱附实验用0.005 mmol·L-1 CaCl2 溶液作为背景液配制ILs溶液,其浓度范围为0.5~3.0 mmol·L-1。根据OECD导则[14],采用批量平衡法测量土壤吸附ILs的量。称取0.500 0依0.001 0 g土壤于称量管中,加入20 mL不同浓度(0.5~3.0 mmol·L-1)ILs 的溶液,在25 益恒温下,置于转盘上转摇24 h,达到吸附平衡后,离心后静置澄清2 h后,取上层清液,利用高效液相色谱测量得出土壤吸附ILs量。
取出上述吸附实验平衡后上清液10 mL(含取出样品),再加入10 mL 0.005 mmol·L-1 CaCl2溶液,进行脱附实验。实验条件与吸附实验相同,转盘上转摇24h,达到平衡后静置澄清,取样测量。
1.4 样品分析方法样品利用高效液相色谱进行测量,色谱柱为C18柱(250×4.6mm,I.D.S-5μm,Waters,Milford,MA,USA),流动相为30%乙腈+80%缓冲盐(KH2PO4/H3PO4,pH=3),检测波长为218 nm,进样量为10 L,进样速度为1mL·min-1。
1.5 数据分析 1.5.1 吸附-脱附实验数据分析利用Freundlich吸附等温方程进行数据拟合qe=Kf×Ce1/n其中,qe为吸附平衡时,每克土壤吸附ILs 量,mmol·g-1;Ce 为吸附平衡时ILs 的浓度,mmol·L-1;Kf 为Freundlich 吸附系数,(mmol·g-1)·(mmol·L-1)-n;1/n 为吸附强度;Kd为吸附系数,L·g-1,当平衡吸附浓度Ce=1 mmol·L-1时,Kd在数值上等于Kf。
1.5.2 吸附-脱附滞后系数(HI)
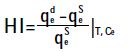
|
其中,qeS和qed分别是单次吸附、脱附平衡时,ILs 在土壤上剩余量,mmol·kg-1;下标T 和Ce 分别是反应温度和反应平衡时ILs浓度。
2 结果与分析 2.1 土壤基本理化性质土壤部分性质见表 2。其中,土样S1的阳离子交换量最大,为18.70 cmol·kg-1;土样S13 阳离子交换量最小,为4.04 cmol·kg-1。土壤样品的有机质含量除S14为7.94%之外,其余在0.54%~2.96%之间。除土样S15 pH值为4.52呈酸性外,大多土壤样品为中性或弱碱性。从粒径分布上看,土壤样品50%以上为沙土,最高达到88.80%;粘土含量较少,鄱阳土样含量最高为11.40%。
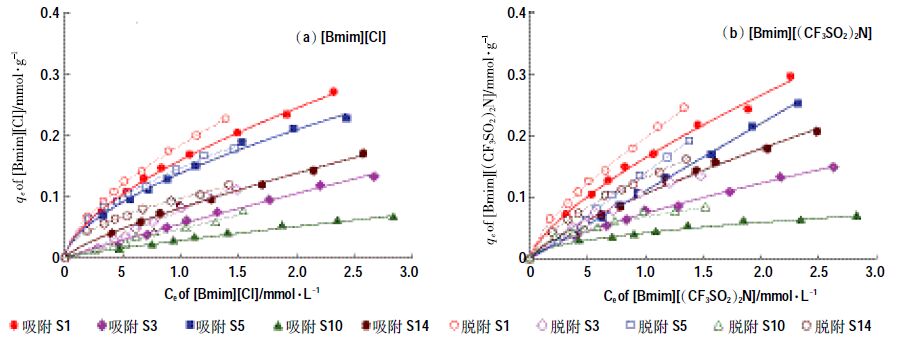
土壤对两种ILs 的吸附等温线见图 1。利用Freundlich 吸附等温方程对数据进行拟合,相关参数见表 3,除土样S11、S13 外,拟合相关系数R2均达到0.99 以上。S13 拟合效果较差的原因可能在于其ILs的吸附量极小。由拟合后的吸附等温线(图 1)可以看出,在浓度较低时(<1.0 mmol·L-1),ILs 在土壤上的吸附速率较快,随着ILs 浓度的增加,土壤上吸附位点逐渐减小,吸附速率也逐渐降低。在本实验浓度下,土壤对ILs 的平衡吸附量低于土壤的阳离子交换量,土壤上存在空缺吸附位点,表明ILs 在土壤上只存在单层吸附。

|
|
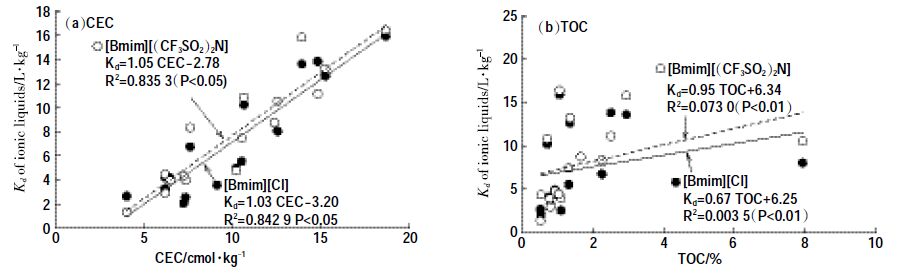
| 图 1 土壤对2 种离子液体的吸附系数Kd与CEC(a),TOC(b)之间关系 Figure 1 The relationship of Kd of IBILs and soil CEC(a,Kd of IBILs and TOC(b) |
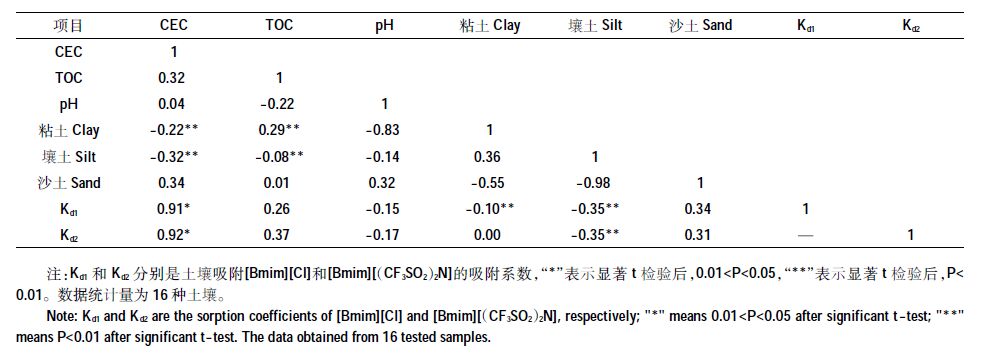
土壤对[Bmim][Cl]的吸附系数Kd 在2.5~15.9 L·kg-1 之间,对[Bmim][(CF3SO2) 2N]吸附系数Kd 在2.9~16.4 L·kg-1之间。其中土样S1 对两种ILs的吸附量均为最大,这可能与其较大的阳离子交换量(18.70cmoL·kg-1)有关。土样S13对两种ILs的吸附量均最小,这与其较小的阳离子交换量(4.04 cmoL·kg-1)和有机质含量(0.54%)有关。土样S14具有最大的有机质含量(7.94%),然而其对[Bmim][Cl]和[Bmim][(CF3SO2)2N]吸附系数并不是最大,仅分别为8.1 L·kg-1和10.5 L·kg-1,要小于土样S1、S5、S6、S7和S16的相应值(表 3)。
本研究中,大多数的土壤对[Bmim][(CF3SO2) 2N]吸附量稍大于[Bmim][Cl],这是由于前者的阴离子基团[(CF3SO2) 2N]-具有较大的水合半径,结合[Bmim]+后疏水性强于后者导致的。Ropel 等[17]证实[Bmim][(CF3SO2) 2N]和[Bmim][Cl]的辛醇-水分配系数(Kow)分别为0.620 和0.004,前者的疏水性高于后者,进而使得其与土壤有机质的疏水相互作用更强。
在水溶液中,[Bmim][Cl]几乎完全以阴、阳离子态存在[18],[Bmim][(CF3SO2) 2N]中的[Bmim]+和[CF3SO2) 2N]-会部分以离子对形式存在,Katsuta 等[19]测得[Bmim][(CF3SO2) 2N]离子对形成常数为6.3 dm3·mol-1,说明离子对的存在形态不多,还是以离子态为主。因此,2 种物质的[Bmim]+ 阳离子都可以和土壤中的Na+、K+、Ca2+、Mg2+等阳离子进行阳离子交换作用而被土壤吸附。此外,阳离子上的疏水性基团可以与土壤有机质通过疏水作用结合。因此,探讨土壤吸附ILs 量与土壤CEC 和TOC 的之间定量关系有助于分析其吸附机理。图 1a 表明,两种ILs 吸附系数Kd与16种土壤CEC之间存在较强的正相关关系,[Bmim][Cl]和[Bmim][(CF3SO2) 2N]的相关性系数R2 分别达到0.842 9和0.835 3(P<0.05);相比之下,吸附系数与TOC 的相关性较小,R2 仅分别为0.003 5和0.073 0(P<0.01)。
2.3 土壤理化性质对吸附行为的影响表 4 通过16 种土壤对[Bmim][Cl]和[Bmim][(CF3SO2) 2N] 吸附系数Kd1 和Kd2 与土壤性质之间相关性矩阵的讨论,全面直观地探讨了土壤物理化学性质对土壤吸附ILs的影响。从表 4可以看出,CEC与Kd1和Kd2 之间呈现出最高正相关性,分别为0.91 和0.92(P<0.05);TOC 与Kd1 和Kd2 相关性小于CEC,分别为0.26 和0.37,该结果和前面章节的结论是一致的。pH值与吸附系数Kd1 和Kd2 之间呈负相关性,当土壤pH 值降低时,土壤胶体微粒表面所负电荷也减少,其阳离子交换量也降低,土壤对ILs 的吸附能力将会有所下降。理论上,土壤质地越细,粘土含量越高,土壤比表面积越大,对有机物的吸附有促进作用。在本实验中,土壤吸附能力与粘土含量没有呈现出较大相关性,这与土壤样品的粘土含量普遍较低有很大关系。土壤中的CEC 主要来自于有机质和土壤交换性盐基离子(Na+、K+、Ca2+、Mg2+),从相关性矩阵中可以看出,CEC 与TOC 和沙土含量都呈现出正相关,相关性分别为0.32 和0.34。
|
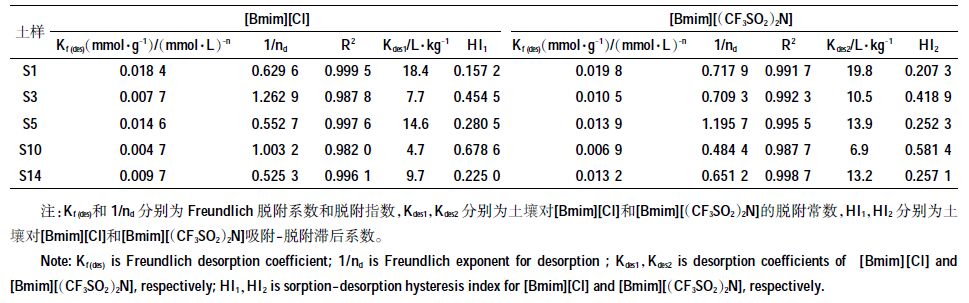
本实验从16 种土壤中选用了5 种土壤(S1,S3,S5,S10,S14)进行了ILs 的脱附研究,脱附等温线一般也符合Freundlich 方程,但是在趋势上落后于脱附等温线[20],这是由于吸附质的迁移引起的,这种现象称为滞后现象。表 5为利用Freundlich 拟合相关脱附数据,图 2 为5种土吸附/脱附等温线。从图 2 中可以看出,5 种土样对同种ILs 的脱附能力存在较大差异,总体趋势为:S1>S5>S14>S3>S10,由此看出对ILs 吸附量大的土壤与ILs 之间的结合并不牢固,ILs也较易从土壤上脱附而进入土壤溶液中。
|
|
| 图 2 两种离子液体[Bmim][Cl](a),[Bmim][(CF3SO2) 2N](b)在土壤上的吸附/脱附曲线 Figure 2 Sorption-desorption isotherms of [Bmim][Cl](a)and [Bmim][(CF3SO2) 2N](b)onto the selected soils |
土壤对有机物不可逆转的吸附现象可以用迟滞系数(HI)进行定量[21]。本研究HI 在25 益,Ce 为1mmol·L-1条件下求得,HI1、HI2分别为土壤吸附/脱附[Bmim][Cl]和[Bmim][(CF3SO2) 2N]的迟滞系数,从表 5中可以看出,迟滞系数HI 均小于1。当HI 远小于1时,可能是由于有机质和矿物引起的不可逆的热力学变化引起的[22]。
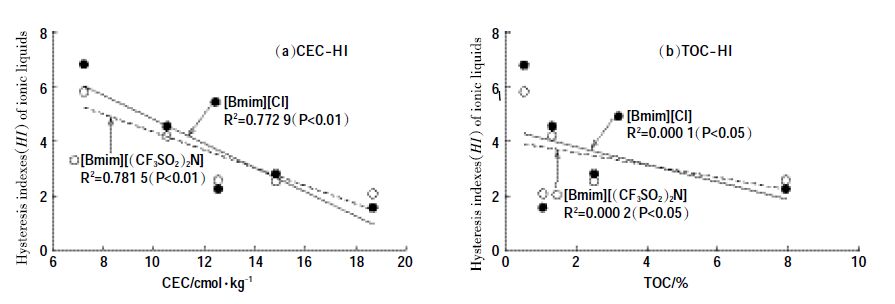
本实验进一步探究了CEC 与HI 之间的关系,对[Bmim][Cl]和[Bmim][(CF3SO2) 2N]化合物而言,其拟合相关系数R2均较大(图 3a),分别0.772 9和0.781 5(P<0.01)。表明土壤CEC 对ILs 不仅能影响土壤吸附,同时能影响土壤脱附。而TOC 与HI 间的相关系数均较小,说明二者无显著相关。
|
| 图 3 吸附-脱附迟滞系数HI与CEC(a),TOC(b)之间关系图 Figure 3 The relationship of HI of IBILs and soil CEC(a), HI of IBILs and TOC(b) |
土壤CEC 和TOC 与吸附系数Kd 之间的相关性关系研究表明,ILs 的阳离子基团与土壤的表面结合位点之间的静电作为是吸附的主要机制,这和Stepnowski 等[23]、Mrozik等[24]的研究结论相一致。相较于CEC,整体上TOC 与吸附系数Kd之间的相关性较小,说明TOC 对于吸附作用的影响有限。其中S14 土壤的TOC 为7.94%,远高于其他土壤,但对吸附能力却没有明显的促进作用。因此,在本实验样本下,ILs与土壤有机质疏水结合只是起到相对次要的作用。相比而言,Studzińska[12]的研究认为随着土壤TOC 含量增加,土壤对ILs(特别是含长链烷基链的离子液体)的吸附量会明显增大。在其研究中,TOC 含量超高(44.8%)的土样SV 对ILs 的吸附量有较大提高,对1-己基-3-甲基咪唑氯的吸附量(Kd=404 L·kg-1)明显高于1-乙基-3-甲基咪唑氯和1-丁基-3-甲基咪唑氯(Kd分别为12、92L·kg-1);而TOC含量较低的3种土样SⅠ(<0.1%)、SⅡ(0.5%)、SⅢ(4.1%)对3 种ILs 的吸附量差别并不大(均小于7 L·kg-1)。由此也可以看出,当土壤中TOC 含量较高时,ILs 与土壤有机质疏水结合也起到重要作用;而在自然土壤TOC 含量相对较低的情况下,这种作用并不明显。因此,为更好地讨论吸附过程中的疏水性作用,今后的研究应选用含较长烷基侧链的ILs,并且选择含有机质含量较大的土壤样本进行深入探究。
ILs的脱附量一定程度上随着吸附量的增加而增加,说明土壤通过静电作用与ILs 的结合并不牢固,ILs较易从土壤上解吸而进入土壤溶液中进行迁移。5种土壤对2 种ILs 的吸附-脱附滞后系数均小于1,对于非挥发性且不易降解的ILs 来说,其在土壤上出现的迟滞行为主要由于ILs 与土壤粘土矿物和有机质不可逆的结合造成的。
关于ILs 性质对吸附行为的影响,目前大多数研究认为阳离子基团是主要的影响因素,随着烷基侧连的增长,ILs在土壤上的吸附量增大[12, 24]。而关于阴离子的影响研究较少,阴离子基团对吸附行为是否有影响仍存在争议。Studzińska等[12]认为阴离子对ILs在土壤上的吸附行为影响很微弱,可以忽略;曲玉萍等[25]通过含不同阴离子的ILs 在膨润土上的吸附行为发现阴离子对吸附影响不大;而Matzke 等[26]发现IM14BF4和IM14(CF3SO2) 2N 两种ILs 在不同土壤上的吸附量存在较大差异,推断出阴离子对吸附行为有一定影响;Shi 等[27]的研究发现秸秆生物质炭对[C2min][CF3SO2) 2N]的吸附量是[C2min][Cl]的将近3 倍,阴离子对吸附行为有较大影响。在本研究中,大多数的土壤对[Bmim][(CF3SO2) 2N]吸附量稍稍大于[Bmim][Cl],但影响并不十分明显,这可能与土壤对ILs 的整体吸附量较小有关。在将来的研究中,可以选用ILs的强吸附剂来探究阴离子基团的影响。此外,土壤中生物质炭、矿物等含量的增加,可能会大大增加土壤对ILs的吸附能力,增加其土壤污染风险。
4 结论本文研究土壤理化性质对离子液体[Bmim][Cl]和[Bmim][(CF3SO2) 2N]吸附及脱附行为的影响,将土壤理化性质与吸附系数(Kd)进行相关性分析。发现土壤阳离子交换量是影响土壤吸附能力的主要因素,而土壤有机碳含量的影响相对较小。这表明ILs主要通过静电作用被吸附在土壤表面,疏水作用起到相对次要作用。吸附-脱附迟滞系数HI小于1,ILs在土壤上的迟滞行为主要由于有机质和矿物引起的不可逆的热力学变化引起的。ILs阴离子基团对吸附行为有一定的影响,由于ILs 在土壤上的吸附量较小,这种影响并不明显。
| [1] | Earle M J, Seddon K R. Ionic liquids: Green solvents for the future[J]. Pure &Applied Chemistry , 2000, 72 (16) : 1391–1398. |
| [2] | Chiappe C, Pieraccini D. Ionic liquids: Solvent properties and organic reactivity[J]. Journal of Physical Organic Chemistry , 2005, 18 (4) : 275–297. DOI:10.1002/(ISSN)1099-1395 |
| [3] | Greaves T L, Drummond C J. Protic ionic liquids: Properties and applications[J]. Chemical Reviews , 2008, 108 (1) : 206–237. DOI:10.1021/cr068040u |
| [4] | 张长波, 刘仲齐, 杨双, 等. 离子液体预处理纤维素及木质纤维素的研究进展[J]. 农业资源与环境学报 , 2013, 30 (6) : 20–24. ZHANG Chang-bo, LIU Zhong-qi, YANG Shuang, et al. Effect of ionic liquid pretreatment on the degradation efficiency of lignocellulosic biomass:A review[J]. Journal of Agricultural Resources and Environment , 2013, 30 (6) : 20–24. (in Chinese) |
| [5] | Singh M P, Singh R K, Chandra S. Ionic liquids confined in porous matrices: Physicochemical properties and applications[J]. Progress in Materials Science , 2014, 64 (10) : 73–120. |
| [6] | Marina C B, Kristina R E, Ivana R I R, et al. A brief overview of the potential environmental hazards of ionic liquids[J]. Ecotoxicology & Environmental Safety , 2014, 99 (1) : 1–12. |
| [7] | PhamT P T, Cho C W, Yun Y S. Environmental fate and toxicity of ionic liquids: A review[J]. Water Research , 2010, 44 (2) : 352–372. DOI:10.1016/j.watres.2009.09.030 |
| [8] | Jungnickel C, Mrozik W, Markiewicz M, et al. Fate of ionic liquids in soils and sediments[J]. Current Organic Chemistry , 2011, 15 (12) : 1928–1945. DOI:10.2174/138527211795703702 |
| [9] | 宋萍, 施凯顺, 邱宇平. 离子液体的土壤环境行为研究进展[J]. 环境科学与技术 , 2014, 37 (120) : 231–236. SONG Ping, SHI Kai-shun, QIU Yu-ping. Advance in research of the environmental behaviors of ionic liquids in the soils[J]. Environmental Science & Technology , 2014, 37 (120) : 231–236. (in Chinese) |
| [10] | Mrozik W, Jungnickel C, Paszkiewicz M, et al. Interaction of novel ionic liquids with soils[J]. Water Air & Soil Pollution , 2013, 224 (11) : 1759. |
| [11] | Stepnowski P. Preliminary assessment of the sorption of some Alkyl imidazolium cations as used in ionic liquids to soils and sediments[J]. Australian Journal of Chemistry , 2005, 58 (3) : 170–173. DOI:10.1071/CH05018 |
| [12] | Studzińska S, Sprynskyy M, Buszewski B. Study of sorption kinetics of some ionic liquids on different soil types[J]. Chemosphere , 2008, 71 (11) : 2121–2128. DOI:10.1016/j.chemosphere.2008.01.013 |
| [13] | Gillman G P, Sumpter E A. Modification to the compulsive exchange method for measuring exchange characteristics of soils[J]. Soil Research , 1986, 24 (1) : 61–66. DOI:10.1071/SR9860061 |
| [14] | OECD. No O T. 106: Adsorption-desorption using a batch equilibrium method[R]. OECD Guidelines for the Testing of Chemicals, 2000: 1-45. |
| [15] | Huang W, Yu H, WeberWJ. Hysteresis in the sorption and desorption of hydrophobic organic contaminants by soils and sediments1: A comparative analysis of experimental protocols[J]. Journal of Contaminant Hydrology , 1998, 31 (1-2) : 129–148. DOI:10.1016/S0169-7722(97)00056-9 |
| [16] | WeberWJ, Huang W, Yu H. Hysteresis in the sorption and desorption of hydrophobic organic contaminants by soils and sediments 2: Effects of soil organic matter heterogeneity[J]. Journal of Contaminant Hydrology , 1998, 31 (1-2) : 149–165. DOI:10.1016/S0169-7722(97)00059-4 |
| [17] | Ropel L, Belvèze L S, Aki S N V K, et al. Octanol-water partition coefficients of imidazolium-based ionic liquids[J]. Green Chemistry , 2005, 7 (2) : 83–90. DOI:10.1039/B410891D |
| [18] | Bešter-Rogačc M, Stoppa A, Hunger J, et al. Association of ionic liquids in solution: A combined dielectric and conductivity study of[J]. Physical Chemistry Chemical Physics Pccp , 2011, 13 (39) : 17588–17598. DOI:10.1039/c1cp21371g |
| [19] | Katsuta S, Ogawa R, Yamaguchi N, et al. Ion pair formation of 1-Alkyl-3-methylimidazolium salts in water[J]. Journal of Chemical & Engineering Data , 2007, 52 (52) : 248–251. |
| [20] | Raman S, Krishna M, Rao P C. Adsorption-desorption of atrazine on four soils of hyderabad[J]. Water Air & Soil Pollution , 1988, 40 (1-2) : 177–184. |
| [21] | Ma L, Southwick L M, Willis G H, et al. Hysteretic characteristics of atrazine adsorption-desorption by a Sharkey soil[J]. Weed Science , 1993, 41 (4) : 627–633. |
| [22] | Li J, Jing F, Xi X, et al. Kinetics, equilibrium, and mechanisms of sorption and desorption of 17α-ethinyl estradiol in two natural soils and their organic fractions[J]. Science of the Total Environment , 2013, 452-453 : 404–410. DOI:10.1016/j.scitotenv.2013.03.009 |
| [23] | Stepnowski P, Mrozik W, Nichthauser J. Adsorption of alkylimidazolium and alkylpyridinium ionic liquids onto natural soils[J]. Environmental Science &Technology , 2007, 41 (2) : 511–516. |
| [24] | Mrozik W, Kot Owska A, Kamysz W, et al. Sorption of ionic liquids onto soils: Experimental and chemometric studies[J]. Chemosphere , 2012, 88 (10) : 1202–1207. DOI:10.1016/j.chemosphere.2012.03.070 |
| [25] | 曲玉萍, 陆颖舟, 李春喜. 5种吸附剂对水中离子液体的吸附性能[J]. 环境工程学报 , 2012, 6 (9) : 1969–2973. QU Yu -ping, LU Ying -zhou, LI Chun -xi. Adsorption of five adsorbents for different ionic liquids aqueous solutions[J]. Chinese Journal of Environmental Engineering , 2012, 6 (9) : 1969–2973. (in Chinese) |
| [26] | Matzke M, Thiele K, Müller A, et al. Sorption and desorption of imidazolium based ionic liquids in different soil types[J]. Chemosphere , 2009, 74 (4) : 568–574. DOI:10.1016/j.chemosphere.2008.09.049 |
| [27] | Shi K, Qiu Y, Li B, et al. Effectiveness and potential of straw-and wood-based biochars for adsorption of imidazolium-type ionic liquids[J]. Ecotoxicology &Environmental Safety , 2016, 130 : 155–162. |
 2017, Vol. 34
2017, Vol. 34