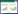文章信息
- 潘丽媛, 肖炜, 董艳, 李龚程, 张乃明, 段红平, 张仕颖
- PAN Li-yuan, XIAO Wei, DONG Yan, LI Gong-cheng, ZHANG Nai-ming, DUAN Hong-ping, ZHANG Shi-ying
- 超高产生态区水稻根际微生物物种及功能多样性研究
- Microbial Species and Functional Diversity in Rice Rhizosphere of High-yield Special Ecological Areas
- 农业资源与环境学报, 2016, 33(6): 583-590
- Journal of Agricultural Resources and Environment, 2016, 33(6): 583-590
- http://dx.doi.org/10.13254/j.jare.2016.0074
-
文章历史
- 收稿日期: 2016-03-23
2. 云南农业大学农学与生物技术学院, 云南 昆明 650201;
3. 云南大学云南省微生物研究所, 云南 昆明 650091
2. College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China;
3. Yunnan Institution of Microbiology, Yunnan University, Kunming 650091, China
微生物多样性(Microbial diversity)是生态系统中所有微生物种群在组成、结构、功能以及微生物与环境之间的相互作用等方面表现出来的多样化程度[1-2],是生态系统的基本生命特征,不仅可反映微生物在自然界的丰富度,还能代表微生物群落在整个生态系统中的稳定性,通常以土壤微生物群落变化和生物化学过程间的相互关系来表征。关于微生物多样性的研究层次,目前不同的学者有不同的划分方式,但如果将微生物多样性与整个生态系统联系起来,学者普遍认同将微生物多样性变化概括为物种多样性、功能多样性和遗传多样性三个基本特征[3]。物种多样性包括微生物物种的丰富度、均匀度、物种总量以及物种分布等相关信息[4],是微生物多样性的简单量度,多采用传统的微生物纯培养手段进行监测;功能多样性是指土壤微生物群落所能执行的功能范围以及这些功能的执行过程[5],一般采用底物诱导下的代谢响应模式测算土壤微生物群落的代谢功能多样性[6];遗传多样性又称基因多样性,是指土壤微生物在基因水平上所携带的各类遗传物质和遗传信息的总和[7],多采用现代分子生物学手段及免培养技术进行监测。云南永胜涛源乡是保持我国水稻小面积超高产纪录的特殊生态区,从1983年起就不断有水稻品种在这里刷新全国高产纪录。大量研究表明,当地优越的光温条件[8-11]和独特的土壤微生物区系[12-13]在水稻高产形成中起到关键作用,但目前的研究主要集中在气候因素和微生物群落组成方面,从微生物群落代谢特征、尤其是不同生育期微生物扮演的生态功能解释水稻高产机理的研究还比较少。因此,本文跟踪采集不同生育期及不同土层深度水稻土样品,采用平板菌落计数法和BIOLOG碳素利用法,从物种和功能两个角度揭示土壤微生物多样性,以期阐明超高产生态区土壤微生物群落组成和代谢特征与水稻高产之间的内在联系,为进一步完善水稻高产理论提供科学依据。
1 材料与方法 1.1 土壤样品的采集采用对角线五点采样法,在水稻生长的苗期、分蘖期、成熟期和轮作期,采集选定高产示范田5个点的土壤样品作为研究对象,同时采集临近普通对照田5个点的土壤样品作为对照。高产示范田和普通对照田均种植当地常规品种,在试验当年采用相同的田间管理模式进行常规大田管理。采样时,每块田随机选择5穴水稻植株,掘出面积20 cm×20 cm,深度为20~30 cm的水稻植株整株样本,利用采样器采集水稻根际土壤,并于水稻收获期加采0~10 cm和10~20 cm非根际土样。所采样品用自封袋封装,置入装有冰块的保温盒中,迅速带回实验室处理。供试土壤基本理化性状见表 1。
土壤微生物物种多样性分析采用稀释平板涂布法,分离细菌(Bacteria)使用牛肉膏蛋白胨培养基、真菌(Fungi)使用马丁氏培养基、放线菌(Actinobacteria)使用高氏一号培养基[14]。土壤微生物功能多样性分析采用BIOLOG碳素利用法[15]。称取30~40 g(精确到0.01 g)新鲜土样置于培养皿中,放入110 ℃烘箱烘烤6 h,取出称重;之后重新放回烘箱继续烘烤,每隔30 min重复称重1次,直至恒重,通过公式:H2O%=(m0-m1)÷m0×100计算土壤含水量,其中m0表示烘干前样品重;m1表示烘干后样品重。称取相当于10 g干土重的处理土样,加入90 mL磷酸缓冲液中,180 r·min-1振荡30 min,静置10 min,梯度稀释成10-3悬液,用移液器接种样品至ECO板,每孔150 μL,每个样品3个重复,25 ℃温育7 d,每隔24 h用BIOLOG自动读板仪读取590 nm吸光值[16-17]。
1.3 数据处理所有数据使用SPSS 17.0软件处理,采用单因素(one way ANOVA)方差分析和LSD法进行多重比较(P<0.05)。微生物物种多样性采用Shannon多样性指数(H)、Shannon均匀度指数(E)和Simpson指数(D)表示[18-19],土壤微生物代谢活性采用每孔颜色平均变化率(average well color development,AWCD)表示,微生物功能多样性采用Shannon指数(Shannon index)、Simpson指数(Simpson index)和McIntosh指数(McIntosh index)表示[20]。
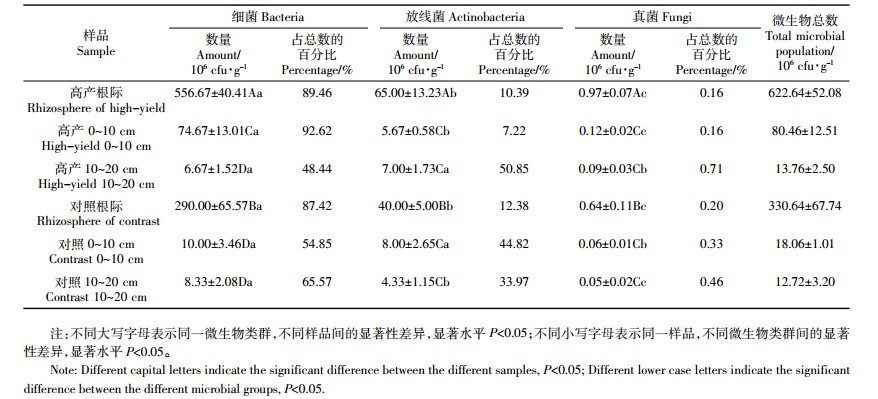
2 结果与分析 2.1 不同土层深度微生物物种多样性特征物种多样性包括物种数量、分布、丰富度和均匀度等相关信息[4],是微生物多样性的简单量度,多采用传统的微生物纯培养手段进行监测。不同土层深度微生物种群数量及组成见表 2。从表 2中可以看出,土层深度对微生物群落组成有一定影响,尤其是根际和非根际范围,微生物数量和分布差别巨大。无论是高产水稻土还是对照,根际微生物总数都远远大于非根际土壤,高产水稻土根际微生物总数接近对照2倍,说明高产水稻土中蕴含更为丰富的微生物群落,此结果与前人研究吻合[21]。从三大类微生物数量和占比来看,高产水稻土表现为细菌>放线菌>真菌,属于健康的“细菌型”土壤,细菌是高产水稻土根际微生物的重要组成部分,占微生物总数的89.46%,为根际范围内的绝对优势菌群,放线菌数量占10.39%,真菌占0.16%。从不同土层深度来看,高产水稻土0~10 cm细菌、放线菌和真菌数量之间存在显著差异,10~20 cm细菌与放线菌数量没有显著差异,但均与真菌存在显著差异,说明随着土层不断深入,高产水稻土非根际范围内有一部分细菌逐渐被放线菌取代,这与氧气含量逐渐减少有直接关系,但在根际范围内,细菌依旧是绝对优势菌群,说明水稻高产形成得益于其独特的根际微环境,与自然土层中的微生物关系不大。
 |
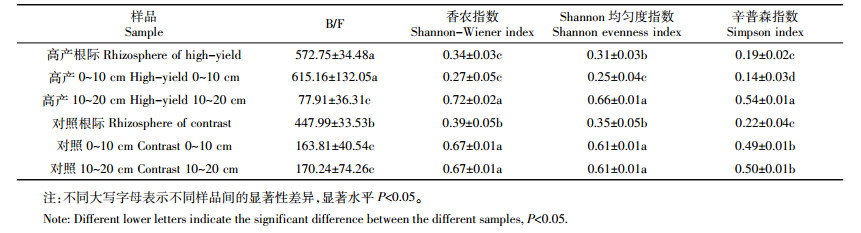
从表 3可以看出,表征土壤健康程度的B/F值高产水稻土为572.75,对照为447.99,二者达到差异显著,说明高产生态区土壤健康程度更高,是更为优化的细菌占优势的土壤微生物群落结构。物种多样性指数分析表明,高产水稻土Shannon均匀度指数(E)和Simpson指数(D)均与对照没有显著差异,Shannon多样性指数(H)与对照达到差异显著,但对照H值更高,说明微生物群落物种层面的多样性和均匀度并不是二者的主要差别,高产水稻土根际因为具有更为明显的细菌数量优势,反而多样性程度更低。
 |
不同生育期水稻根际微生物群落代谢活性变化见图 1。从图 1中可以看出,大多数样品在96~144 h期间表现出较强的碳源利用能力,144 h以后碳源利用能力逐渐趋于平稳,高产水稻土分蘖期和收获期144 h后仍呈现碳源利用能力的上升趋势,表现出旺盛的群落代谢活性。总体而言,高产水稻土4个生育期土壤微生物群落代谢活性都强于对照,温育120 h后,高产苗期AWCD值比对照高26.3%,分蘖期高61.5%,收获期高27.4%,轮作期高16.1%,这与高产水稻土中蕴含数量更为丰富的微生物群落有直接关系。二者间的差别幅度由大到小表现为分蘖期>收获期>苗期>轮作期,水稻生长越旺盛,高产水稻土与对照之间微生物碳源利用能力差别越大,说明水稻根际微生物的代谢和生长状况对水稻植株生长有重要促进作用。纵观整个生育期,高产水稻土在分蘖期和收获期表现出明显高于其他两个时期的微生物群落代谢活性,温育120 h后,分蘖期AWCD值为1.57,比最低的轮作期高75.8%,收获期AWCD值为1.11,比轮作期高24.1%,苗期和轮作期几乎重叠,其微生物群落碳源利用能力表现为分蘖期>收获期>苗期和轮作期。水稻生长的分蘖期和收获期,由于植株生长旺盛,根际分泌物丰富,根际微生物群落表现出更为强烈的代谢活性,碳源利用能力旺盛。

|
| 图 1 不同生育期土壤微生物群落AWCD值 Figure 1 AWCD of soil microbial communities in different growth stages |
采用温育120 h数据进行微生物群落功能多样性分析。Shannon指数反映微生物群落物种多样性,通常物种数量多且较均匀的群落,Shannon指数较高[22]。将Shannon指数应用于BIOLOG ECO板时,微生物能够利用的碳源种类越多,Shannon指数越大。由图 2可知,高产水稻土Shannon指数在所有生育期均高于对照,苗期和分蘖期与对照达到差异显著,说明高产生态区在水稻生长时期根际微生物数量更多,能够利用的碳源种类更多,证实高产水稻土中确实蕴含更为丰富的微生物群落。而微生物数量越多,能够利用的碳源种类越多,其代谢能力越强,进而促成高产优势。纵观整个生育期,高产水稻土Shannon指数表现为分蘖期最大,与其他3个时期达到差异显著,说明分蘖期是高产水稻生长的关键时期,此时根际微生物数量最多,可利用碳源种类也最多,水稻分蘖期旺盛的植株生长得益于数量巨大的根际微生物强烈的代谢能力和对丰富碳源底物的分解利用。
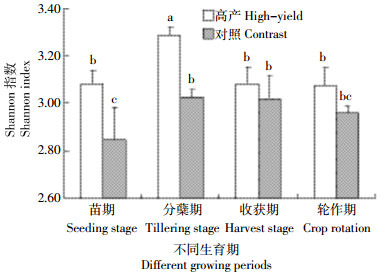
|
| 不同小写字母表示不同样品间的显著性差异,显著水平P<0.05。下同 图 2 不同生育期土壤微生物群落Shannon指数 Figure 2 Shannon index of soil microbial communities in different growth stages |
Simpson指数又称优势度指数,较多反映群落中那些数量占比较大、种类较集中的常见物种,可用于评估某些常见物种的优势度,是对群落集中性的度量,Simpson指数越高,群落常见物种优势度越高,即多样性程度越低[23]。将Simpson指数应用于BIOLOG ECO板,微生物能够利用的碳源种类越集中,Simpson指数越高,反之,微生物能够利用的碳源种类越多样,Simpson指数越低。由图 3可知,高产水稻土Simpson指数在所有生育期均小于对照,但未达到差异显著,说明高产水稻土根际常见物种优势度与对照没有差别,数量占比较大、种类较集中的常见物种并不是高产水稻土形成产量优势的重要原因。纵观整个生育期,高产水稻土Simpson指数表现为分蘖期<苗期<收获期<轮作期,分蘖期与轮作期差异显著,说明分蘖期高产水稻土根际常见种优势度最低,物种多样性最高,能够利用的碳源种类最多样。而微生物种类越丰富,可利用的碳源种类越多样,可用于分解消化的底物就越多,能够供给作物生长的营养也更富足。可见除微生物数量众多、代谢能力强外,种类繁多、代谢类型多样化也是高产水稻土根际微环境的重要特征,二者共同促进植株生长和产量形成。
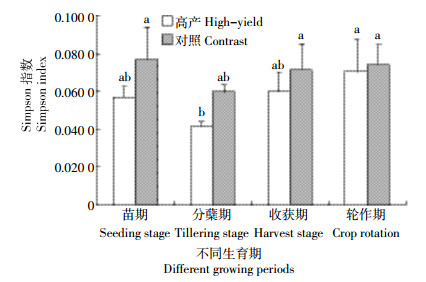
|
| 图 3 不同生育期土壤微生物群落Simpson指数 Figure 3 Simpson index of soil microbial communities in different growth stages |
McIntosh指数是用来衡量微生物群落均匀度的多样性指数,一般物种数越多,均匀度越高的群落,McIntosh值越大。将McIntosh指数应用于BIOLOG ECO板,微生物能够利用的碳源种类越多样,McIntosh指数越高。由图 4可知,高产水稻土McIntosh指数在所有生育期均大于对照,分蘖期达到差异显著,说明高产水稻土根际微生物群落分布更均匀,能够利用的碳源种类更多样化,尤其在水稻分蘖生长的关键时期,均匀的微生物群落分布为高产水稻土创造了一个更有利于植株生长的根际微环境。纵观整个生育期,高产水稻土McIntosh指数表现为分蘖期>收获期>轮作期>苗期,分蘖期与其他3个时期差异显著,说明分蘖期高产水稻土根际微生物群落分布最均匀,物种多样性最丰富,可利用碳源种类最多,再次证明分蘖期根际微生物种类繁多、代谢类型多样化是促成高产的重要原因。

|
| 图 4 不同生育期土壤微生物群落McIntosh指数 Figure 4 McIntosh index of soil microbial communities in different growth stages |
综上,3个多样性指数综合分析表明,与对照相比,高产水稻土根际微生物数量更多,代谢能力更强,微生物群落分布更均匀,多样化程度更高,能够利用的碳源种类更丰富,常见物种并不是形成产量优势的重要因素。纵观整个生育期可知,分蘖期是高产水稻生长的关键时期,此时根际微生物数量最多,代谢能力最强,微生物群落分布最均匀,物种多样性最丰富,可利用碳源种类数最多。分蘖期根际微生物数量多、种类繁、代谢能力强、代谢类型多是高产水稻旺盛生长和高产形成的关键所在。
3 讨论目前关于云南涛源超高产生态区高产理论的研究主要集中在生理和生态两个方面[24]。生态方面,温度和太阳辐射被认为是对水稻高产形成有重要影响的生态因素[25]。当日温低于20 ℃或高于35 ℃,夜温低于15 ℃或高于22 ℃时都会影响水稻生长[26]。涛源地处热带河谷,太阳辐射强烈,日温处于光合作用最适的27~32 ℃,昼夜温差11~15 ℃,非常有利于分蘖的发生和营养物质的高积累高转运[27-29]。然而让人不解的是,涛源水稻超高产生态区面积仅100 hm2左右,与之相邻的区域具备相似的光温条件和海拔高度,在高产品种选择、田间管理措施一致的情况下,却始终无法达到能与之媲美的水稻超高产水平。
土壤是作物赖以生存的物质基础,可为其提供生长所需的营养物质和矿质元素,土壤质量的好坏直接关系土壤生产力的高低,是影响作物产量的重要生态因素。土壤微生物与土壤生态系统稳定性之间存在关联[30-31],具有改善土壤质量,提高生态系统生产力的功能[32],被认为是表征土壤质量变化最有潜力的指标[33]。本研究发现,土层深度对微生物群落组成有一定影响,尤其是根际和非根际范围,微生物数量和分布差别巨大,高产根际微生物总数接近对照2倍,说明高产水稻土中蕴含更为丰富的微生物群落,这一结果与段红平等[12]和李进学等[21]研究结果一致。Zhang等[34]利用16S rRNA基因序列分析发现厚壁菌门(Firmicutes)和放线细菌门(Actinobacteria)是高产水稻土两大优势类群,而本研究从可培养微生物数量上证明细菌是高产水稻土的绝对优势菌群,其次为放线菌,真菌只占微生物总数的0.16%,说明健康的“细菌型”土壤是涛源特殊生态区水稻高产形成最根本的物质基础。李进学[13]研究发现水稻产量与水稻根际自生固氮菌、有机磷细菌、无机磷细菌有较好的相关性,与钾细菌呈显著或极显著相关;张仕颖[3]研究发现高产水稻土中富含固氮菌属(Azotobacter)、根瘤菌属(Rhizobium)、盐单胞菌属(Halomonas)和副球菌属(Paracoccus)等具有固氮、聚磷和异养硝化-好氧反硝化作用的有益微生物,还存在之前没有被发现报道过的新物种Arenimonas taoyuanensis sp nov.[34],而本研究结果从微生物功能多样性的角度证明数量占比较大、种类较集中的常见种并不是高产水稻土形成产量优势的重要原因。此外,本研究还发现高产水稻土微生物群落代谢活性总体要强于对照,尤其在水稻旺盛生长的分蘖期,高产水稻土表现出更为强烈的代谢活性和旺盛的碳源利用能力。分蘖期,光照和温度为植株生长提供了高积累、高转运的外界条件,而高产水稻土产量形成的优势可能还得益于此阶段数量巨大且种类繁多的根际微生物,微生物强烈的代谢活性和对丰富碳源底物的分解利用,使植株能够获取更多营养供生长所需。可见,超高产生态区确实在土壤微生物群落组成和代谢功能方面显示出其独特的生态特征,对水稻高产形成具有积极的促进作用。今后,有必要继续从土壤微生物遗传多样性、土壤结构、养分构成等方面开展相关工作,进一步阐明涛源特殊生态区水稻高产形成机制。
4 结论(1)物种多样性方面,土层深度对微生物群落组成有一定影响,高产根际可培养微生物总数接近对照2倍,高产水稻土中蕴含更为丰富的微生物群落;高产水稻土属于健康的“细菌型”土壤,且健康程度优于对照,是更为优化的细菌占优势的群落组成;高产水稻土Shannon均匀度指数和Simpson指数均与对照没有显著差异,Shannon多样性指数二者达到差异显著,说明微生物群落物种层面的多样性和均匀度并不是二者的主要差别,高产水稻土根际因为具有更为明显的细菌数量优势,反而多样性程度更低,因此不能简单地使用微生物群落物种多样性来评价微生物区系的优劣。
(2)功能多样性方面,AWCD值分析表明,高产水稻土群落代谢活性与其中蕴含数量更为丰富的微生物有直接关联,总体强于对照,二者间的差别幅度由大到小表现为分蘖期>收获期>苗期>轮作期,水稻生长越旺盛,与对照间碳源利用能力差别越大。在水稻生长的分蘖期和收获期,由于植株生长旺盛,根际分泌物丰富,高产水稻土根际微生物群落表现出更为强烈的代谢活性和旺盛的碳源利用能力。
(3)三个多样性指数综合分析表明,与对照相比,高产水稻土根际微生物数量更多,代谢能力更强,微生物群落分布更均匀,多样化程度更高,能够利用的碳源种类更丰富,数量占比较大、种类较集中的常见种并不是形成产量优势的重要因素。纵观整个生育期可知,分蘖期是高产水稻生长的关键时期,此时根际微生物数量最多,代谢能力最强,微生物群落分布最均匀,物种多样性最丰富,可利用碳源种类数最多。分蘖期根际微生物数量多、种类繁、代谢能力强、代谢类型多是高产水稻旺盛生长和高产形成的关键所在。
| [1] | Ramirez I, Steyer J P. Modeling microbial diversity in anaerobic digestion[J]. Water Science and Technology , 2008, 57 (2) : 265–270. DOI:10.2166/wst.2008.055 |
| [2] | Pringault O, Duran R. Temporal variations of microbial activity and diversity in marine tropical sediments(new caledonia lagoon)[J]. Microbial Ecology , 2008, 55 (2) : 247–258. DOI:10.1007/s00248-007-9272-8 |
| [3] | 张仕颖.丁草胺对高产水稻土微生物多样性的生态效应研究[D].昆明:云南农业大学, 2012. ZHANG Shi-ying. Ecological effect of butachlor-contamination on diversity of microbial communities in high-yield paddy soils[D]. Kunming:Yunnan Agricultural University, 2012. (in Chinese) |
| [4] | Ovreas L. Population and eommunity level approaches for analyzing microbial diversity in natural environments[J]. Ecology Letters , 2000, 3 (3) : 236–251. DOI:10.1046/j.1461-0248.2000.00148.x |
| [5] | 王方艳.二甲基二硫与氯化苦混用对连作土壤微生物群落结构的影响及其恢复动态研究[D].北京:中国农业科学院, 2011. WANG Fang-yan. Impact of combination of dimethyl disulfide and chloropicrin on microbial communities in continuous cropping soil and dynamics of recovery[D]. Beijing:Chinese Academy of Agricultural Sciences Dissertation, 2011. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-82101-1011158897.htm |
| [6] | Johnsen K, Jacobsen C, Torsvik V, et al. Pesticide effects on bacterial diversity in agricultural soils:A review[J]. Biology and Fertility of Soils , 2001, 33 (6) : 443–453. DOI:10.1007/s003740100351 |
| [7] | 张薇, 魏海雷, 高洪文, 等. 土壤微生物多样性及其环境影响因子研究进展[J]. 生态学杂志 , 2005, 24 (1) : 48–52. ZHANG Wei, WEI Hai-lei, GAO Hong-wen, et al. Advances of studies on soil microbial diversity and environmental impact factors[J]. Chinese Journal of Ecology , 2005, 24 (1) : 48–52. (in Chinese) |
| [8] | Ying J, Peng S, Yang G, et al. Comparison of high-yield rice in tropical and subtropical environments.Ⅰ. Determinations of grain and dry matter yields[J]. Field Crops Research , 1998, 57 : 71–84. DOI:10.1016/S0378-4290(98)00077-X |
| [9] | Ying J, Peng S, Yang G, et al. Comparison of high-yield rice in tropical and subtropical environments. Ⅱ. nitrogen accumulation and utilization efficiency[J]. Field Crops Research , 41998, 57 : 85–93. |
| [10] | Katsura K, Maeda S, Lubis I, et al. The high yield of irrigated rice in Yunnan China:A cross-location analysis[J]. Field Crops Research , 2008, 107 (1) : 1–11. DOI:10.1016/j.fcr.2007.12.007 |
| [11] | Li G, Xue L, Gu W, et al. Comparison of yield components and plant type characteristics of high-yield rice between Taoyuan, a 'special eco-site' and Nanjing, China[J]. Field Crops Research , 2009, 112 : 214–221. DOI:10.1016/j.fcr.2009.03.005 |
| [12] | 段红平, 张乃明, 李进学, 等. 超高产水稻根际微生物类群数量初探[J]. 中国农学通报 , 2007, 23 (2) : 285–289. DUAN Hong-ping, ZHANG Nai-ming, LI Jin-xue, et al. Preliminary study on physiological populations and quantity of rhizosphere main microorganism in super-yield rice fields[J]. Chinese Agricultural Science Bulletin , 2007, 23 (2) : 285–289. (in Chinese) |
| [13] | 李进学.超高产水稻根际土壤微生物类群数量及其养分状况的变化[D].昆明:云南农业大学, 2007. LI Jin-xue. Super-high rice fields rhizosphere soil microbial groups and their nutrient status changes[D]. Kunming:Yunnan Agricultural University, 2007. (in Chinese) http://mall.cnki.net/magazine/article/gzzp200701002.htm |
| [14] | NY/T 1114-2006.微生物肥料实验用培养基技术条件[S].北京:中国标准出版社, 2006. NY/T 1114-2006. Technical specifications for culture medium of microbial fertilizer experiment[S]. Beijing:China Standard Publishing House, 2006. (in Chinese) |
| [15] | Yao H Y, Bowman D, Shi W. Soil microbial community structure and diversity in a turfgrass chronosequence:Land-use change versus turfgrass management[J]. Applied Soil Ecology , 2006, 34 (2) : 209–218. |
| [16] | Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community level sole-carbon-source utilization[J]. Applied and Environmental Microbiology , 1991, 57 : 2351–2359. |
| [17] | 王文鹏, 毛如志, 陈建斌, 等. 种植方式对玉米不同生长期土壤微生物群落功能多样性的影响[J]. 中国生态农业学报 , 2015, 23 (10) : 1293–1301. WANG Wen-peng, MAO Ru-zhi, CHEN Jian-bin, et al. Analysis of functional diversity of soil microbial communities under different cultivation patterns at different growth stages of maize[J]. Chinese Journal of Eco-Agriculture , 2015, 23 (10) : 1293–1301. (in Chinese) |
| [18] | 姚槐应, 黄昌勇. 土壤微生物生态学及其实验技术[M]. 北京: 科学出版社 ,2006 . YAO Huai-ying, HUANG Chang-yong. Soil microbial ecology and its experimental technology[M]. Beijing: Science Press , 2006 . (in Chinese) |
| [19] | 董艳, 鲁耀, 董坤, 等. 轮作模式对设施土壤微生物区系和酶活性的影响[J]. 土壤通报 , 2010, 41 (1) : 53–55. DONG Yan, LU Yao, DONG Kun, et al. Effect of rotation patterns on soil microbial community and enzyme activities under protected cultivation[J]. Chinese Journal of Soil Science , 2010, 41 (1) : 53–55. (in Chinese) |
| [20] | 吴家森, 张金池, 钱进芳, 等. 生草提高山核桃林土壤有机碳含量及微生物功能多样性[J]. 农业工程学报 , 2013, 29 (20) : 111–117. WU Jia-sen, ZHANG Jin-chi, QIAN Jin-fang, et al. Intercropping grasses improve soil organic carbon content and microbial community functional diversities in Chinese hickory stands[J]. Transactions of the Chinese Society of Agricultural Engineering , 2013, 29 (20) : 111–117. (in Chinese) |
| [21] | 李进学, 段红平, 张乃明, 等. 不同生态区水稻根际微生物数量分析[J]. 耕作与栽培 , 2007, 1 : 3–5, 26. LI Jin-xue, DUAN Hong-ping, ZHANG Nai-ming, et al. The quantitative analysis of rice rhizosphere microbes in different zone[J]. Tillage and Cultivation , 2007, 1 : 3–5, 26. (in Chinese) |
| [22] | 王方艳, 王秋霞, 颜冬冬, 等. 二甲基二硫熏蒸对保护地连作土壤微生物群落的影响[J]. 中国生态农业学报 , 2011, 19 (4) : 890–896. WANG Fang-yan, WANG Qiu-xia, YAN Dong-dong, et al. Effects of dimethyl disulfide on microbial communities in protectorate soils under continuous cropping[J]. Chinese Journal of Eco-Agriculture , 2011, 19 (4) : 890–896. DOI:10.3724/SP.J.1011.2011.00890 (in Chinese) |
| [23] | Simpson E H. Measurement of diversity[J]. Nature , 1949, 163 : 688. DOI:10.1038/163688a0 |
| [24] | 张仕颖, 夏运生, 史静, 等. 超高产生态区水稻产量成因研究进展[J]. 中国农学通报 , 2014, 30 (18) : 14–17. ZHANG Shi-ying, XIA Yun-sheng, SHI Jing, et al. Progress in research on determination factors for super-high-yield rice in special eco-site of Yunnan Province[J]. Chinese Agricultural Science Bulletin , 2014, 30 (18) : 14–17. (in Chinese) |
| [25] | Sheehy J E, Mitchell P L, Ferrer A B. Decline in rice grain yields with temperature:Models and correlations can give different estimates[J]. Field Crops Research , 2006, 98 : 151–156. DOI:10.1016/j.fcr.2006.01.001 |
| [26] | Nagarajan S, Jagadish S V K, Hari Prasad A S, et al. Local climate affects growth, yield and grain quality of aromatic and non-aromatic rice in northwestern India[J]. Agriculture, Ecosystems & Environment , 2010, 138 : 274–281. |
| [27] | 徐福荣, 戴陆园, 张红生, 等. "Ⅱ优084"在永胜涛源创世界水稻单产新高的栽培模式探讨[J]. 西南农业学报 , 2004, 17 : 44–48. XU Fu-rong, DAI Lu-yuan, ZHANG Hong-sheng, et al. Discussion of high-yielding cultivation pattern of the"II You 084" that created the highest rice single-yielding in Taoyuan town of Yongsheng county so far[J]. Southwest China Journal of Agricultural Sciences , 2004, 17 : 44–48. (in Chinese) |
| [28] | 张凤文. 涛源杂交稻单产创世界纪录栽培探讨[J]. 耕作与栽培 , 2002 (1) : 19–20. ZHANG Feng-wen. Taoyuan hybrid rice yield cultivation a world record[J]. Tillage and Cultivation , 2002 (1) : 19–20. (in Chinese) |
| [29] | Tilman D, Wedin D, Knops J. Productivity and sustainability influenced by biodiversity in grassland ecosystems[J]. Nature , 1996, 379 : 718–720. DOI:10.1038/379718a0 |
| [30] | Griffiths B S, Ritz K, Bardgett R D, et al. Ecosystem response of pasture soil communities to fumigation-induced microbial diversity reductions:An examination of the biodiversity ecosystem function relationship[J]. Oikos , 2000, 90 (2) : 279–294. DOI:10.1034/j.1600-0706.2000.900208.x |
| [31] | Aboim M C R, Coutinho H L C, Peixoto R S, et al. Soil bacterial community structure and soil quality in a slash-and-burn cultivation system in Southeastern Brazil[J]. Applied Soil Ecology , 2008, 38 (2) : 100–108. DOI:10.1016/j.apsoil.2007.09.004 |
| [32] | Sharma S K Ramesh, Sharma M P, et al. Biodiversity, biofuels, agroforestry and agriculture[M]. New York: Spring Netherlands , 2011 : 317 -358. |
| [33] | Romaniuk R, Giuffre L, Costantini A, et al. Assessment of soil microbial diversity measurements as indicators of soil functioning in organic and conventional horticulture systems[J]. Ecological Indicators , 2011, 11 (5) : 1345–1353. DOI:10.1016/j.ecolind.2011.02.008 |
| [34] | Zhang Shi-Ying, Xiao Wei, Xia Yun-Sheng, et al. Arenimonas taoyuanensis sp nov., a novel bacterium isolated from rice-field soil in China[J]. Antonie van Leeuwenhoek , 2015, 107 (5) : 1181–1187. DOI:10.1007/s10482-015-0409-3 |
 2016, Vol. 33
2016, Vol. 33