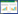文章信息
- 唐艳芬, 续勇波, 郑毅, 雷宝坤
- TANG Yan-fen, XU Yong-bo, ZHENG Yi, LEI Bao-kun
- 小麦蚕豆间作对根际土壤氮转化微生物的影响
- Effects of Wheat and Faba Bean Intercropping on Microorganism Involved in Nitrogen Transformation in the Rhizosphere Soils
- 农业资源与环境学报, 2016, 33(5): 482-490
- Journal of Agricultural Resources and Environment, 2016, 33(5): 482-490
- http://dx.doi.org/10.13254/j.jare.2016.0083
-
文章历史
- 收稿日期: 2016-03-29
2. 云南农业大学烟草学院, 云南 昆明 650201;
3. 西南林业大学, 云南 昆明 650224;
4. 云南省农业科学院农业环境资源研究所, 云南 昆明 650200
2. College of Tobacco, Yunnan Agricul-tural University, Kunming 650201, China;
3. Southwest Forestry University, Kunming 650224, China;
4. Institute of Agricultural Environment and Resources, Academy of Agricultural Sciences, Yunnan Province, Kunming 650200, China
土壤氮素生物地球化学循环是土壤物质循环的重要组成部分,不仅影响土壤质量以及农田等生态系统的生产力和可持续性,还会影响全球环境变化[1]。而土壤微生物在土壤氮循环中发挥着不可替代的作用,参与了包括固氮作用、氨化作用、硝化作用和反硝化作用等重要生态过程。现代农业主要靠施肥来促进作物生长和提高粮食产量,但是现在土壤中过多的氮素通过氨挥发、淋溶、径流和硝化与反硝化等途径带来的生态环境问题已引起广泛关注[2-3]。许多报道表明,由于现代农业追求大面积种植单一作物和农药化肥的大量施用造成农田生态系统日趋简单和脆弱,土地利用率和生物多样性的降低,病害发生频繁,作物减产,同时还造成不可再生资源不断耗竭和环境污染等严重的问题[4-5]。
间套(混)作是我国传统农业的精髓,而豆科/禾本科间作模式具有悠久历史,它能利用豆科作物的共生固氮作用,同时促进禾本科作物对氮素的吸收[6-7],其中小麦/ 蚕豆间作在我国大部分地区都有种植,在云南特别是滇中地区也是一种较为普遍的种植方式。间作系统地下部土壤氮素转化过程维系着氮素固持、释放、吸收与损失,是作物养分资源高效利用、产量优势形成和抗病性增强的前提和基础,而深入理解农作物间作体系中土壤氮素关键转化过程有助于更好地理解土壤养分的植物有效化过程,对更好地揭示地上-地下生物多样性互馈机理具有重要意义。目前对间作影响氮转化过程的程度和机理尚缺乏系统的认识,大部分研究主要集中于田间作物搭配模式、地上部光热资源利用、养分吸收利用和作物病虫害方面。因此,本试验对小麦蚕豆间作后根际土壤硝化细菌、反硝化细菌数量的变化以及主要微生物菌群的生物量、土壤硝铵态氮含量进行研究,期望为解决上述问题提供一定的理论依据。
1 材料与方法 1.1 研究区概况于2014年10月—2015年5月在云南农业大学后山试验地进行,其土壤为山原红壤,基本理化性质:有机质14.37 g·kg-1,速效钾116.42 g·kg-1,速效磷24.23 g·kg-1,碱解氮105.18 g·kg-1,pH 6.35 。
1.2 试验设计供试肥料为尿素、普通过磷酸钙和硫酸钾,单、间作小麦N肥施用量为225 kg·hm-2 (以N计),磷肥施用量为75 kg·hm-2(以P2O5计),钾肥施用量为75 kg·hm-2 (以K2O 计),不施有机肥。单、间作蚕豆氮肥用量相同,均为小麦的一半,磷、钾肥的施用量与单间作小麦相同。蚕豆氮肥、磷肥和钾肥全部作为基肥一次性施入。小麦氮肥分2次施入,50%作为基肥,50%作为追肥,磷肥和钾肥全部作为基肥一次性施入。
1.3 种植规格试验共设3个处理,即小麦单作、蚕豆单作、小麦蚕豆间作,每个处理4次重复,共12个小区,小区随机排列,小区的面积为8 m2。小麦条播,行距0.2 m,蚕豆点播,行距0.3 m,株距0.2 m。间作小区按小麦∶蚕豆=6∶2,即6行小麦2行蚕豆的方式种植,共14行,单作小麦每个小区19行,单作蚕豆每个小区11行。
1.4 研究方法 1.4.1 取样单作处理中随机取2~3个点,间作处理中取小麦和蚕豆相邻行植株,用抖土法采集根际土,制成混合土样。磷脂脂肪酸(PLFA)测试所需的土样保存在-20 ℃,硝化细菌和反硝化细菌测试土样保存在-80 ℃,剩余土样按照常规指标分析方法进行处理。
1.4.2 小麦蚕豆成熟期生物量和产量生物量:先称好干净植株的鲜重,在105 ℃下杀青0.5 h,再将温度调到60~70 ℃,烘干至恒重,称其干重。产量:1 m2中收获的小麦、蚕豆籽粒,风干至恒重。应用土地当量比LER作为衡量产量优势的指标。
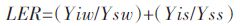
|
式中,Yiw和Yis分别代表间作总面积上小麦和蚕豆的产量或生物量;Ysw和Yss分别为单作小麦和单作蚕豆的产量或生物量。当LER>1,表明间作有优势,当LER<1为间作劣势。
1.4.3 土壤微生物群落结构的测定利用PLFA分析来研究土壤微生物群落结构组成[8-9]。称取2 g新鲜土样,采用修正的Bligh & Dyer方法进行脂类提取和PLFA 分析[10]。土样用柠檬酸缓冲液(0.1 mol·L-1,pH 4.0)、氯仿和甲醇以0.8∶1∶1.2的体积比进行提取,提取液用硅酸键合固相提取柱(Silicic acid bonded solid-phase-extraction column,SPE-SI)层析,后分别用氯仿、丙酮和无水甲醇洗脱,将含磷脂部分用氮气吹干,然后用碱性甲醇水解和皂化(甲基化)得到磷脂脂肪酸甲酯(Fatty acid methyl ester,FAME)。采用MIDI方法根据生产商的指导测定PLFA,测定时以C19(十九烷酸甲酯)作为内标。
1.4.4 土壤DNA的提取和氨氧化细菌以及反硝化细菌的定量PCR使用土壤专用的DNA提取试剂盒,用FastDNA® SPIN Kit for Soil(MP Biomedicals,Santa Ana,CA)试剂盒,根据生产商的指示从约0.5 g新鲜土样中提取DNA,DNA的质量和数量用NanoDrop分光光度计进行检测。荧光定量PCR的产物用荧光定量检测系统测定。采用大连宝生物工程有限公司的SYBR Premix Ex TaqTM Perfect Real Time试剂盒于CFX96 Real-Time PCR System扩增仪上分析。定量PCR的反应体系为20 μL,包括 2 μL DNA 模板、10 μL SYBR Premix Ex TaqTM Perfect Real Time,前、后引物各0.3 μL(10 μmol·L-1)和7.4 μL的灭菌双蒸水。实验对照用灭菌双蒸水代替DNA作为反应模板。氨氧化细菌和氨氧化古菌的引物分别是ArchamoAF/Arch-amoAR[11]和Arch-amoAF/ Arch-amoAR[12]。nirK,norB和nosZ基因定量PCR反应的引物参照文献[13]。nirK的引物是nirKF1aCu(ATCATGGTSCTGCCGCG)/nirKR3Cu(GCCTCGATCAGRTTGTGGTT);norB 的引物是cnorBBF(AIGTGGTCGAGAAGTGGCTCTA)/cnorBBR(TCTGIACGGTGAAGATCACC);nosZ的引物是nosZ2F(CGCRACGGCAASAAGGTSMSSGT)/nosZ2R(CAKRTGCAKSGCRTGGCAGAA)。
1.4.5 土壤硝铵态氮的测定称取12 g左右保存在4 ℃的土壤,用1 mol·L-1 KCl浸提,180 r·min-1震荡1 h,过滤后用流动分析仪测定。
1.4.6 数据处理与分析利用Excel进行数据处理,采用SPSS 19.0进行数据的统计分析。
2 结果与分析 2.1 小麦蚕豆间作对作物产量和生物量的影响小麦蚕豆间作可以显著增加小麦的产量和生物量,分别增加了12.6%和15.8%(表 1),且均达到显著水平(P<0.05),但蚕豆产量和生物量均没有显著影响。小麦蚕豆间作体系中籽粒产量和生物量的LER均>1,表明小麦蚕豆间作存在优势。
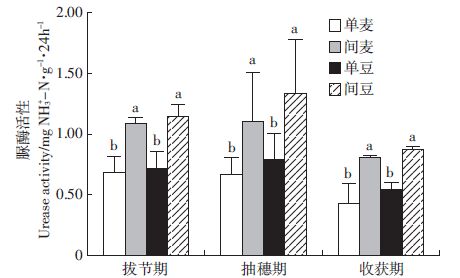
脲酶与土壤营养物质的转化能力、肥力水平、污染状况密切相关,是一种广泛存在于土壤中并对土壤有机氮分解转化起重要作用的专性酶。酶促反应产物氨是植物氮源之一,它的活性可以用来表示土壤氮素营养状况[14]。如图 1所示,无论哪个生育期,间作后小麦蚕豆根际土壤脲酶的活性都显著高于单作(P<0.05),并且随着生育期的推进,表现出先增加后减少的趋势。说明脲酶活性越强,使植物不能利用的复杂含氮化合物转化为可吸收态无机氮化合物越多,能够加速氮素转化,提高作物生长需要养分。
|
| 不同的字母表示同一采样时期单、间作处理之间差异显著(P<0.05)。下同 图 1 小麦//蚕豆脲酶活性 Figure 1 The urease activities of the wheat//faba bean intercropping |
过氧化氢酶是衡量土壤中氧化过程的方向和强度指标,其活性的高低可以反映土壤解除呼吸过程中产生的过氧化氢的能力[15]。如图 2所示,在不同生育期中,间作后小麦蚕豆根际土壤的过氧化氢酶活性也都显著高于单作。
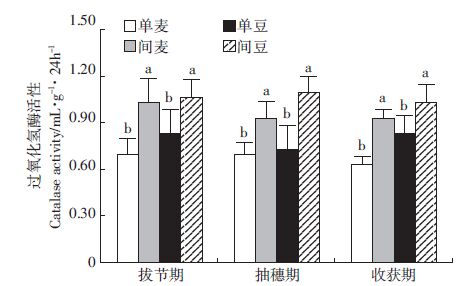
|
| 图 2 小麦//蚕豆过氧化氢酶活性 Figure 2 The catalase activities of the wheat//faba bean intercropping |
土壤中提取的PLFA可作为主要微生物类群的指示标志,特征脂肪酸的改变就可以表征某一类群的微生物群落变化[16]。虽然PLFA 分析提供的群落结构组成只是一种表型结果,但它描述的是类似于生态功能群的概念,可以指示主要群落组成及生理变化[17]。由图 3可以看出,随着生育期的推进,总的磷脂脂肪酸的生物量都在增加。在拔节期(图 3A),间作小麦根际中的细菌PLFA和放线菌PLFA显著高于单作小麦(P<0.05);间作蚕豆在放线菌的含量上也达到显著高于单作蚕豆。在抽穗期(图 3B),间作小麦、蚕豆根际中总的PLFA(TPLFA),细菌PLFA和真菌PLFA的生物量比单作均显著增加(P<0.05)。在收获期(图 3C),间作后TPLFA、细菌PLFA、真菌PLFA、放线菌PLFA与单作相比均增加,分别增加了32.2%、84.7%和49.2%。其中间作蚕豆根际土样细菌PLFA、真菌PLFA、放线菌PLFA比单作蚕豆显著增加(P<0.05)。说明间作会对根际土壤微生物群落结构产生影响。
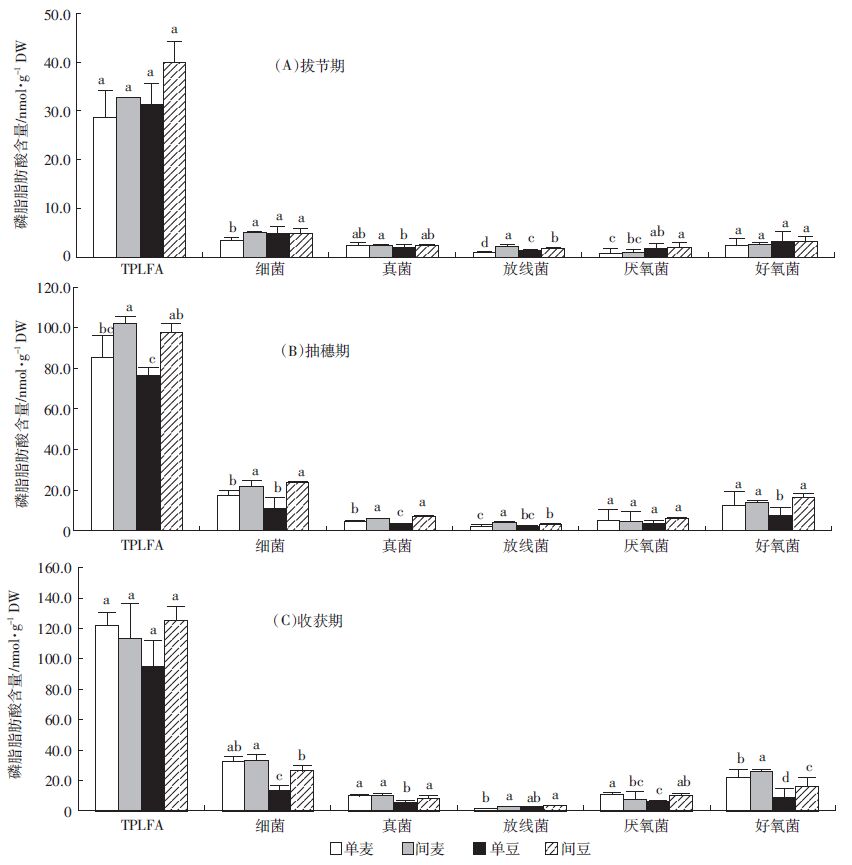
|
| 图 3 不同生育期根际土壤磷脂脂肪酸的含量 Figure 3 The content of PLFAs in different periods of durations |
氨氧化古菌(AOA)和氨氧化细菌(AOB)的amoA基因荧光定量PCR结果如图 4所示。在整个生育期中,在105~106范围内amoA基因拷贝数表现为AOB的amoA基因数量高于AOA。对于AOA的数量来说,随着生育期的推进,无论是间作还是单作总体均呈下降的趋势;对于AOB的数量来,间作小麦和单作小麦随生育期几乎没有变化,间作蚕豆随生育期的推进呈下降的趋势。
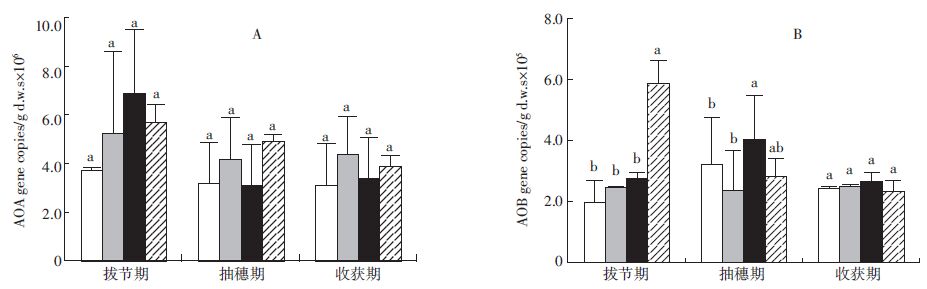
|
| 图 4 不同生育期中AOA 和AOB 的amoA 基因拷贝数 Figure 4 The amoA gene copy of AOA and AOB in different periods of durations |
反硝化细菌中nirK、norB和nosZ的基因拷贝数如图 5所示。在不同的生育期中,根际土壤中亚硝酸还原酶nirK的基因拷贝数均是间作高于单作,其中在抽穗期间作蚕豆显著高于单作(图 5A)。在小麦的拔节期,间作蚕豆norB基因拷贝数显著高于单作;在抽穗期,间作小麦显著高于单作(P<0.05),并在这个时期达到了最大值(图 5B)。在小麦的拔节期、抽穗期中,nosZ基因拷贝数表现为间作显著高于单作(P<0.05),并随着生育期呈现降低的趋势,而单作之间没有明显差异并且随生育期的变化不大(图 5C)。
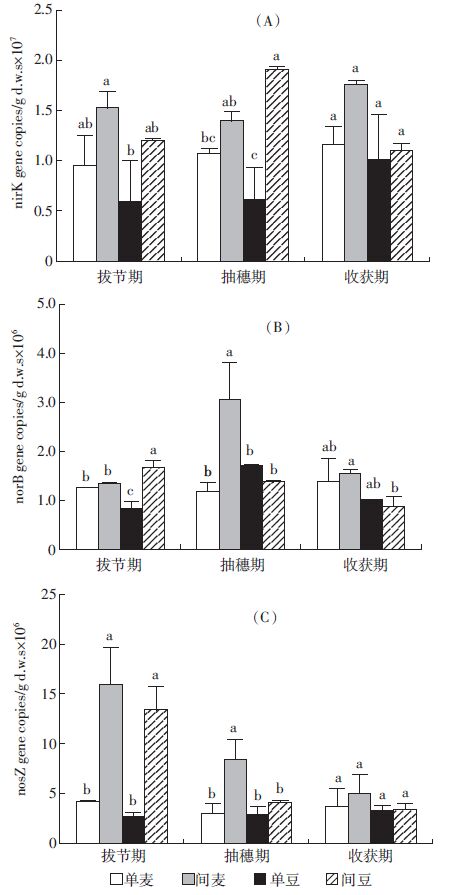
|
| 图 5 不同生育期土壤中nirK, norB和nosZ的基因拷贝数 Figure 5 The gene copies of nirK, norB and nosZ in different growth periods |
如图 6所示,在整个生育期中,小麦蚕豆间作后根际土壤中的硝态氮含量均低于单作;土壤铵态氮含量均表现出间作高于单作,并且随着生育期的推进其含量降低,但差异均不显著。
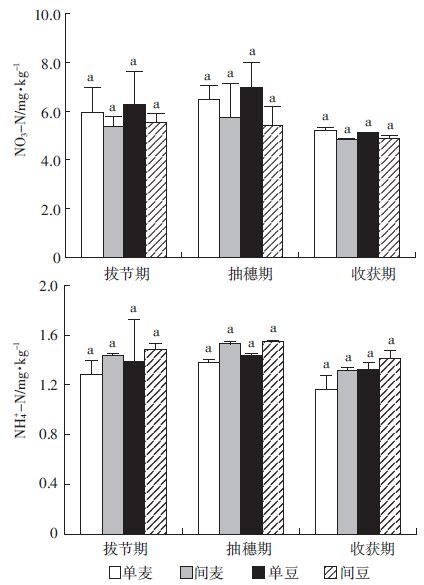
|
| 图 6 不同生育期根际土壤中硝态氮、铵态氮的含量 Figure 6 The content of NO3--N and NH4+-N in different growth periods |
土壤酶是土壤生物活性的表现,是土壤生态系统中最活跃的组分,参与土壤物质循环和能量流动,是评价土壤肥力和健康状况的重要指标之一。脲酶可以用来表征土壤中有机态氮的转化状况,过氧化氢酶可用来表征土壤的生化活性。研究表明,甘蓝与水萝卜间作后可以显著增加土壤脲酶和过氧化氢酶的活性[18];耿广东等[19]研究了玉米与姜间作栽培方式下的土壤过氧化氢酶和脲酶的活性,结果表明这2种酶均极显著地高于单作。本研究中,与单作相比,间作提高了小麦蚕豆根际土壤脲酶活性和过氧化氢酶活性。小麦蚕豆间作对地上部资源和地下部养分资源的竞争,形成了与单作不同的根际环境从而导致土壤酶活性的改变。本试验中,间作根系脲酶活性显著高于单作,说明间作根系为作物提供的氮素更多,在一定程度上为增产起到了促进作用。
3.2 间作对土壤微生物群落的影响土壤微生物作为土壤质量和生物功能评价的重要指标,也会因土地利用方式的改变而受到影响[20-21]。杨智仙等[22]的研究结果表明,小麦蚕豆间作显著提高了蚕豆根际微生物对碳源的利用强度,改变了蚕豆根际微生物群落结构。耿广东等[19]研究玉米间作姜后的土壤中细菌、放线菌和真菌的数量变化,结果表明间作均极显著地高于单作。本试验中,与单作相比,间作提高了PLFA 表征的总生物量、细菌、真菌、放线菌和好氧菌的数量。有研究发现土地利用方式转变,显著改变了土壤微生物PLFA 的组成和细菌16SrDNA丰度[23];但也有研究[24]分析认为,根系分泌物的某种成分能促进土壤中革兰氏阳性细菌、AM 以及真菌的积累,相应增加了微生物的总生物量,其次蚕豆的固氮,导致根际土壤养分的提升,可能也是小麦蚕豆间作促进土壤PLFA 表征的总生物量增加的原因;此外也有研究者[25]认为,较高的植物多样性更能够增加土壤碳源的多样性,并且能够形成更为复杂的土壤空间状态特征。综上所述,间作导致根际土壤微生物群落改变可能的原因有很多,在小麦蚕豆间作这个体系中,认为这几种因素都是存在的,并对根际土壤微生物群落造成影响。
3.3 间作对氨氧化细菌和氨氧化古菌的影响硝化过程(Nitrification)是地球生态系统N 循环的重要过程,主要由氨氧化古菌(AOA)和氨氧化细菌(AOB)执行[26]。小麦蚕豆间作后增加了根际土壤细菌、真菌和放线菌的数量[27-28],Zhang 等[29]在研究玉米蚕豆间作和根瘤菌对根际氨氧化细菌影响时发现,间作处理中氨氧化古菌(AOA)的多样性在结荚期显著,而氨氧化细菌(AOB)是在开花期;本试验中,AOB 的基因拷贝都大于AOA,但是土壤中的微生物受很多因素的影响,其中pH 值是影响氨氧化古菌和细菌组成分布的主要驱动因子之一,Nicol 等[30]也发现在不同pH 值条件(4.9~7.5)下,AOA 的数量和amoA 基因的表达能力随土壤pH 值增加明显降低,其群落组成也对pH 值变化产生响应。AOA 和AOB 在不同的土壤中的丰度不同,导致了在不同的环境条件下它们对硝化作用贡献程度不同。有研究者对我国南方酸性土壤中氨氧化细菌和氨氧化古菌群落组成进行调查,结果表明土壤的硝化潜势仅与AOA 的数量有正相关关系,与AOB无关[31-32];另外有研究发现,在酸性红壤坡地土壤上AOA 的数量与土壤硝化作用成正相关[33],而氨氧化细菌是碱性土壤中硝化作用的主要驱动者[34]。在本试验中,不论是哪个生育期AOB 的基因拷贝数都大于AOA,所以AOB 可能更能适应这个环境,硝化作用过程可能主要由AOB 承担。而对于在不同酸碱性土壤中,AOA 与AOB 分布差异的原因还没有得到明确的解释,需要进一步研究。
3.4 间作对反硝化细菌的影响反硝化作用是生态系统氮循环的重要组成部分。本研究中,间作增加了2 种作物根际中nirK 的丰度,norB和nosZ都是随着生育期的推进而减小,间作后反硝化菌的基因拷贝数总体上说是增加的。作物类型[35]、土地利用方式以及施肥等因素会对反硝化菌产生影响,而间作改变了土地的利用方式、提高了根际的养分利用,间作作物根系互作,可以使根系土壤中含有更多的维生素、碳水化合物和有机酸等,从而明显提高了土壤中微生物的数量[36-37]。已有研究表明,相比玉米单作,玉米-大豆间作有利于减少土壤氧化亚氮的排放[38],花生-玉米和苜蓿-玉米间作模式下,氨挥发量均小于玉米单作,但大豆-玉米间作模式下的氨挥发量大于玉米单作[39],而这些过程均可能与土壤中的微生物有关,说明间作后根际土壤反硝化微生物的量虽然增加,但是根际环境对反硝化的影响太小,再加上底物浓度低,使得N2O 的排放减少,对土壤保氮、蓄氮起到一定的作用,从而为作物增产以及农田生态系统的可持续性提供了保障。
3.5 间作对根际土壤NO3--N 和NH4+-N 的影响研究表明,蚕豆-玉米间作能够减少土壤硝态氮的累积[36],叶优良等[40]研究间套作体系下土壤氮素转化特征及氮素的损失途径时,发现间套作通过调节根际微生物,改善了硝化-反硝化作用,从而降低了NO3--N、NH4+-N 等无机氮在土壤中的富集,减小氮损失,提高作物对氮的有效吸收。Nie 等[3]通过两年的田间定位试验表明,豆科作物(大豆、花生和苜蓿)-玉米间作能够明显降低土壤(100~200 cm)土层中硝态氮含量,有效地减少了硝态氮的淋溶。在本试验中,小麦蚕豆间作减少了土壤硝态氮的累积,增加了根际对铵态氮的吸收,这与前人的研究一致。硝态氮是反硝化作用过程的底物,间作后减少了硝态氮的累积,底物减少,使得由微生物驱动的反硝化作用降低,对间作体系起到了保氮的作用,这些可能都是由于根系的相互作用,改变了土壤的微环境,从而减少了硝态氮的淋失,促进了作物对氮素的吸收,为农田生态系统的可持续性做出了一定的贡献。
4 结论(1)不同生育期中,间作后土壤脲酶、过氧化氢酶活性显著高于单作,根际硝态氮低于间作,说明间作改变了土壤养分条件,促进作物对氮素的吸收利用,降低了土壤氮素的淋失。
(2)在不同的生育期中,AOA 的丰度都是间作高于单作,但没有显著差异;AOB 的丰度,间作蚕豆在拔节期达到最大值,而间作小麦在抽穗期,不论哪个生育期,AOB 的基因拷贝数都高于AOA,说明不同生育期对硝化菌的影响不同,旱地红壤中的硝化作用可能主要由AOB 承担。
(3)nirK基因随生育期没有显著变化,但是间作土壤中丰度高于单作;norB 基因拷贝数在间麦和单豆根际土壤中,随生育期先增加后降低,在间豆根际土壤中一直处于降低状态,单麦则变化不大;nosZ 基因拷贝数在单作蚕豆、小麦中没有显著变化,间作土壤中拷贝数随生育期推进而减少,说明间作对土壤反硝化菌产生影响。
(4)不同生育期中表征细菌、真菌、放线菌、厌氧菌和好氧菌的磷脂脂肪酸的生物量以及TPLFA 在间作与单作间存在着一定差异,说明间作会影响土壤微生物群落结构的多样性。
| [1] | 张晶, 林先贵, 尹睿. 参与土壤氮素循环的微生物功能基因多样性研究进展[J]. 中国生态农业学报 , 2009, 17 (5) : 1029–1034. DOI:10.3724/SP.J.1011.2009.01029 ZHANG Jing, LIN Xian-gui, YIN Rui. Advances in functional gene diversity of microorganism in relation to soil nitrogen cycling[J]. Chinese Journal of Eco-Agriculture , 2009, 17 (5) : 1029–1034. DOI:10.3724/SP.J.1011.2009.01029 (in Chinese) |
| [2] | Pappa V A, Rees R M, Walker R L, et al. Nitrous oxide emissions and nitrate leaching in an arable rotation resulting from the presence of an intercrop[J]. Agriculture Ecosystems & Environment , 2011, 141 (1-2) : 153–161. |
| [3] | Nie S W, Eneji A E, Chen Y Q, et al. Nitrate leaching from maize intercropping systems with N fertilizer overdose[J]. Journal of Integrative Agriculture , 2012, 11 (9) : 1555–1565. DOI:10.1016/S2095-3119(12)60156-7 |
| [4] | Zhu Y Y, Chen H R, Fan J H, et al. Genetic diversity and disease control in rice[J]. Nature , 2000, 406 (1) : 718–722. |
| [5] | Tilman D, Reich P B, Knops J, et al. Diversity and productivity in a long term grassland experiment[J]. Science , 2001, 294 : 843–845. DOI:10.1126/science.1060391 |
| [6] | Hauggaard-Nielsen H, Gooding M, Ambus P, et al. Pea barley intercropping for efficient symbiotic N2-fixation,soil N acquisition and use of other nutrients in European organic cropping systems[J]. Field Crops Research , 2011, 113 : 64–71. |
| [7] | Li C J, Li Y Y, Yu C B, et al. Crop nitrogen use and soil mineral nitrogen accumulation under different crop combinations and patterns of strip intercropping in northwest China[J]. Plant and Soil , 2011, 342 (1) : 221–231. |
| [8] | Zhong W H, Gu T, Wang W, et al. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J]. Plant Soil , 2010, 326 (1) : 511–522. |
| [9] | Niwas, Kanekon, Okada H, et al. Effects of fine-scale simulation of deer browsing on soil micro-food web structure and N mineralization rate in a temperate forest[J]. Soil Biology and Biochemistry , 2008, 40 (3) : 699–708. DOI:10.1016/j.soilbio.2007.10.004 |
| [10] | Bligh E G, Dyer W J. A rapid method of total lipid extraction and pu-rification[J]. Canadian Journal of Biochemistry and Physiology , 1959, 37 (37) : 911–917. |
| [11] | Francis C A, Roberts K J, Beman J M, et al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the o-cean[J]. P Nat Acad Sci , 2005, 102 (41) : 14683–14688. DOI:10.1073/pnas.0506625102 |
| [12] | Rotthauwe J, Witzel K, Liesack W. The ammonia monooxygenase structural gene amoA as a functional marker: Molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Appl Environ Microbiol , 1997, 63 (12) : 4704–4712. |
| [13] | Henry S, Bru D, Stres B, et al. Quantitative detection of the nosZ gene, encoding nitrous oxide reductase, and comparison of the abundances of 16S rRNA, narG, nirK, and nosZ genes in soils[J]. Appl Environ Microb , 2006, 72 (8) : 5181–5189. DOI:10.1128/AEM.00231-06 |
| [14] | 孙瑞莲, 赵秉强, 朱鲁生, 等. 长期定位施肥对土壤酶活性的影响及其调控土壤肥力的作用[J]. 植物营养与肥料学报 , 2003, 9 (4) : 406–410. SUN Rui-lian, ZHAO Bing-qiang, ZHU Lu-sheng, et al. Effects of long-term fertilization on soil enzyme activities and its role in adjust-ing-controlling soil fertility[J]. Plant Nutrition and Fertilizer , 2003, 9 (4) : 406–410. (in Chinese) |
| [15] | 王树起, 韩晓增, 乔云发, 等. 不同土地利用和施肥方式对土壤酶活性及相关肥力因子的影响[J]. 植物营养与肥料学报 , 2009, 15 (6) : 1311–1316. WANG Shu-qi, HAN Xiao-zeng, QIAO Yun-fa, et al. Effects of land fertilization syetem on soil enyme activities and nutrients[J]. Plant Nu-trition and Fertilizer , 2009, 15 (6) : 1311–1316. (in Chinese) |
| [16] | 马琨, 杨桂丽, 马丽, 等. 间作栽培对连作马铃薯根际土壤微生物群落的影响[J]. 生态学报 , 2016, 36 (10) : 1–8. MA Kun, YANG Gui-li, MA Li, et al. Effects of intercropping on soil microbial communities after long-term potato monoculture[J]. Acta Ecologica Sinica , 2016, 36 (10) : 1–8. (in Chinese) |
| [17] | 张玉凤, 冯固, 李晓林. 丛枝菌根真菌对三叶草根系分泌的有机酸组分和含量的影响[J]. 生态学报 , 2003, 23 (11) : 30–37. ZHANG Yu-feng, FENG Gu, LI Xiao-lin. The effect of arbuscular mycorrhizal fungi on the components and concentration of organic acids in the exudates of mycorrhizal red clover[J]. Acta Ecologica Sinica , 2003, 23 (11) : 30–37. (in Chinese) |
| [18] | 覃娟, 李剑, 刘霞, 等. 甘蓝水萝卜间作对土壤理化性状及酶活性影响[J]. 北方园艺 , 2010 (7) : 20–22. QIN Juan, LI Jian, LIU Xia, et al. Effect of intercropping pattern of brassica oleracea with cherry radish on soil enyme activities and soil physic-chemical properties[J]. Northern Horticulture , 2010 (7) : 20–22. (in Chinese) |
| [19] | 耿广东, 王忠平, 冯道友, 等. 玉米与姜间作对土壤微生物和酶活性的影响[J]. 土壤通报 , 2009, 40 (5) : 1104–1106. GENG G D, WANG Z P, FENG D Y, et al. Effects of maize and ginger intercropping on the soil microorganisms and enzyme activities[J]. Chinese Journal of Soil Science , 2009, 40 (5) : 1104–1106. (in Chinese) |
| [20] | Yang Y, Guo J, Chen Q, et al. Effects of forest conversion on soil labile organic carbon fractions and aggregate stability in subtropical China[J]. Plant and Soil , 2009, 323 (1) : 153–162. |
| [21] | Tian J, Fan M, Guo J, et al. Effects of land use intensity on dissolved organic carbon properties and microbial community structure[J]. Euro-pean Journal of Soil Biology , 2012, 52 (9) : 67–72. |
| [22] | 杨智仙, 董艳, 汤利, 等. 不同品种小麦与蚕豆间作对蚕豆枯萎病发生、根系分泌物和根际微生物群落功能多样性的影响[J]. 植物营养与肥料学报 , 2014, 20 (3) : 570–579. YANG Z X, DONG Y, TANG L, et al. Effects of different wheat culti-vars intercropped with faba bean on faba bean Fusarium wilt, root exu-dates and rhizosphere microbial community functional diversity[J]. Plant Nutrition and Fertilizer Science , 2014, 20 (3) : 570–579. (in Chinese) |
| [23] | Jangid K, Williams M A, Fraozluebbers A J, et al. Land-use history has a stronger impact on soil microbial community composition than above-ground vegetation and soil properties[J]. Soil Biology and Biochemistry , 2011, 43 : 2184–2193. DOI:10.1016/j.soilbio.2011.06.022 |
| [24] | Artursson V, Jansson J K. Use of bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular mycorrhizal hyphae[J]. Applied and Environmental Microbiology , 2003, 69 (10) : 6208–6215. DOI:10.1128/AEM.69.10.6208-6215.2003 |
| [25] | Lacombe S, Bradley R L, Hamel C, et al. Do tree based intercropping systems increase the diversity and stability of soil microbial communi-ties?[J]. Agriculture, Ecosytems and Environment , 2009, 131 (12) : 25–31. |
| [26] | Koops H P, Purkhold U, Pommerening-R?Sser A, et al. The lithoau-totrophic ammonia-oxidizing bacteria. New York Springer[M]. , 2006 : 141 -147. |
| [27] | 董艳, 汤利, 郑毅, 等. 小麦蚕豆间作条件下氮素营养水平对根际微生物区系的影响[J]. 应用生态学报 , 2008, 19 (7) : 1559–1566. DONG Y, TANG L, ZHENG Y, et al. Effect of rhizosphere microorgan-ism in wheat and faba bean intercropping under nitrogen supply level[J]. Chinese Journal of Applied Ecology , 2008, 19 (7) : 1559–1566. (in Chinese) |
| [28] | 魏兰芳, 董艳, 汤利, 等. 小麦蚕豆间作条件下不同施氮量对根际微生物数量的影响[J]. 云南农业大学学报 , 2008, 28 (3) : 368–374. WEI L F, DONG Y, TANG L, et al. Effects of nitrogen supply levels in the amount of rhizosphere microorganism of crops in wheat and broad bean intercropping[J]. Journal of Yunnan Agricultural Universitty , 2008, 28 (3) : 368–374. (in Chinese) |
| [29] | Zhang Nan Nan, Sun Yan Mei, Wang En Tao, et al. Effects of inter-cropping and rhizobial inoculation on the ammonia-oxidizing microor-ganisms in rhizospheres of maize and faba bean plants[J]. Applied Soil Ecology , 2015 (85) : 76–85. |
| [30] | Nicol G W, Leininger S, Schleper C, et al. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxi-dizing archaea and bacteria[J]. Environmental Microbiology , 2008, 10 (11) : 2966–2978. DOI:10.1111/emi.2008.10.issue-11 |
| [31] | Yao H, Gao Y, Nicol G W, et al. Links between ammonia oxidizercom-munity structure, abundance, and nitrification potential in acidic soils[J]. Applied and Environmental Microbiology , 2011, 77 (13) : 4618–4625. DOI:10.1128/AEM.00136-11 |
| [32] | Qin H L, Yuan H Z, Zhang H, et al. Ammonia-oxidizing archaea are more important than ammonia-oxidizing bacteria in nitrification and NO3-N loss in acidic soil of sloped land[J]. Biology and Fertility of Soils , 2013, 49 (6) : 767–776. DOI:10.1007/s00374-012-0767-1 |
| [33] | Xia W, Zhang C, Zeng X, et al. Autotrophic growth of nitrifying commu-nity in an agricultural soil[J]. The ISME Journal , 2011, 5 (7) : 1226–1236. DOI:10.1038/ismej.2011.5 |
| [34] | Djigal D, Baudin E, Plilippot L, et al. Shifts in size, genetic structure and activity of the soil denitrifier community by nematode grazing[J]. European Journal of Soil Biology , 2010, 46 : 112–118. DOI:10.1016/j.ejsobi.2009.12.001 |
| [35] | Song Y N, Marschner P, Zhang F S, et al. Effect of intercropping on bacterial community composition in rhizoshpere of wheat (Triticumaes-tivum L.), maize(Zea mays L.)and faba bean(Viciafaba L.)[J]. Acta Ecologica Sinica , 2006, 26 (7) : 2268–2274. |
| [36] | 刘广才. 不同间套作系统种间营养竟争的差异性及其机理研究[D]. 兰州: 甘肃农业大学, 2005. Liu G C. Difference and its mechanism of interspecific nutrition compe-tition in different intercropping systems[D]. Lanzhou: Gansu Agricul-tural University, 2005.(in Chinese) |
| [37] | Dyer L, Oelbermann M, Echarte L. Soil carbon dioxide and nitrous oxide emissions during the growing season from temperate maize-soybean intercrops[J]. Journal of Plant Nutrition and Soil Science , 2012, 175 (3) : 394–400. DOI:10.1002/jpln.v175.3 |
| [38] | 聂胜委, 陈源泉, 隋鹏, 等. 玉米与不同植物间作对田间氨挥发的影响[J]. 中国农业科学 , 2011, 44 (3) : 634–640. NIE S W, CHEN Y Q, SUI P, et al. Ammonia volatilization in intercrop-ping field of maize with different crops[J]. Scientia Agriculture Sinic , 2011, 44 (3) : 634–640. (in Chinese) |
| [39] | 叶优良, 李隆, 孙建好. 3种豆科作物与玉米间作对土壤硝态氮累积和分布的影响[J]. 中国生态农业学报 , 2008, 16 (4) : 818–823. YE You-liang, LI Long, SUN Jian-hao. Effect of intercropping three legume crops with maize on soil nitrate-N accumulation and distribu-tion in the soil profile[J]. Chinese Journal of Eco-Agriculture , 2008, 16 (4) : 818–823. (in Chinese) |
| [40] | 叶优良, 李隆, 索东让. 小麦/玉米和蚕豆/玉米间作对土壤硝态氮累积和氮素利用效率的影响[J]. 生态环境 , 2008, 17 (1) : 377–383. YE Y L, LI L, SUO D R. Effect of wheat/maize and faba bean/maize intercropping on soil nitrate nitrogen concentration and accumulation[J]. Ecology and Environment , 2008, 17 (1) : 377–383. (in Chinese) |
 2016, Vol. 33
2016, Vol. 33