文章信息
- 郑雪芳, 刘波, 朱育菁, 卢舒娴, 蓝江林
- ZHENG Xue-fang, LIU Bo, ZHU Yu-jing, LU Shu-xian, LAN Jiang-lin
- 养猪发酵床垫料微生物及其猪细菌性病原群落动态的研究
- Community Dynamic of Bacteria, Fungi, Actinomycetes and Pig Bacterial Pathogens in the Stroma Cushion of Pig-on-Litter System
- 农业资源与环境学报, 2016, 33(5): 425-432
- Journal of Agricultural Resources and Environment, 2016, 33(5): 425-432
- http://dx.doi.org/10.13254/j.jare.2016.0092
-
文章历史
- 收稿日期: 2016-04-07
随着现代化猪场规模的日益扩大,养猪污染已经成为农业主要污染源,造成许多重要水源地的污染,严重制约着养猪业的发展[1]。微生物发酵床技术是一种零排放、无污染的新型养殖技术,是通过在猪舍铺设约80 cm厚度的垫料(谷壳、锯末等按一定比例混合)作为培养基,接种猪粪降解菌为先导菌,进行发酵,形成以猪粪降解菌为优势菌的微生物群落结构,以达到降解、消化猪粪便的目的[2-4]。实践证明,利用发酵床养猪除了改善环境、减少污染以外,其最大的好处是可以提高生猪的免疫力,减少疫病[4-6]。
在规模化养猪中,病毒病开始趋向缓和,而一些常见细菌性病害变得流行起来[7]。利用微生物发酵床养猪可以极大控制猪细菌性病害的发生。由于发酵床内部中心发酵层温度较高(60~80 ℃),可以有效抑制细菌性病原的生长和传播,以大肠杆菌为例,在60 ℃环境下,30 min就失去活性[8]。此外,微生物发酵床的基质垫料通过不断的发酵和分解,可以形成益生菌为优势种群的天然屏障,阻止有害微生物的侵入[9-12],从而给仔猪提供一个舒适、干净、安全的生活环境,猪运动量增大,机体抗病力增强,发病率减少,特别是呼吸道疾病和消化道疾病较传统饲养模式有了大幅度的下降[13]。郑雪芳等[14] 研究表明微生物发酵床能抑制大肠杆菌特别是携带毒素基因大肠杆菌的生长,但对于基质垫料中微生物种群结构动态变化及对猪细菌性病原——沙门氏菌的抑制作用研究尚未见报道。
为了探明微生物发酵床抑制猪细菌性病害的作用机理,本研究分析了微生物发酵床使用过程基质垫料微生物组成结构变化,并调查2个主要猪细菌性病原“大肠杆菌”和“沙门氏菌”在基质垫料中分布的时间和空间动态,得出其分布规律,分析其与基质垫料中微生物种群结构的相互关系,旨在为微生物发酵床养猪疫病防治提供依据。
1 材料与方法 1.1 培养基与试剂根据不同微生物的适宜生存条件,分别选取不同的培养基进行不同微生物的分离。大肠杆菌(Escherichia coli)用伊红美蓝培养基(北京陆桥技术有限责任公司),沙门氏菌(Salmonella enterica)用亚硫酸铋培养基(北京陆桥技术有限责任公司),其他细菌用牛肉膏蛋白胨(NA)培养基,真菌用马丁氏(PDA)培养基,放线菌用高氏一号培养基,配方参照文献[15]。DNA聚合酶和100 bp Marker购自上海英骏生物技术有限公司。
1.2 样本采集试验地点:福建福州新店部队猪场,该猪场使用微生物发酵床技术养猪,饲养密度为1头·m-2,仔猪自由采食和饮水,每日在上午9:00之前添加饲料,晚18:00再次添加。发酵床制备及相关管理参照文献[16],基质垫料由40%谷壳和60%的锯末构成,垫层厚度约80 cm;发酵床日常管理:垫料水分控制45%~55%,平时将集中的猪粪分散在发酵床面10 cm下,3个月左右,机械翻耙垫料1次,当垫料高度降至原高度90%时,应及时补充垫料。取样方法:按照1次·月-1的频率取样,连续5个月,分4层取样(第1层0~20 cm ,第2层20~40 cm ,第3层40~60 cm ,第4层60~80 cm),每层选5点,每个点取200 g,将同层次的样品充分混合后,进行微生物分离,3次重复。
1.3 微生物发酵床不同微生物的分离与培养称取样本10 g,于90 mL无菌水中稀释,充分振荡均匀后,按10-2、10-3、10-4进行浓度梯度稀释后,分别涂布于NA、PDA、高氏一号、伊红美蓝和亚硫酸铋琼脂平板,30 ℃培养,细菌培养24 h,真菌和放线菌培养3~5 d,观察菌落形态,并统计菌体数量。
1.4 微生物发酵床大肠杆菌和沙门氏菌的分子检测DNA制备:按照细菌基因组提取试剂盒(generary bitehch,美国)操作步骤进行。针对大肠杆菌的LacZ基因[17]设计其特异检测引物LacZ-1:5′-ATGAAAGCTGGCTACAGGAAGGCC-3′,LacZ-2:5′-GGTTTATGCAGCAACGAGACGTCA-3′;针对沙门氏菌的hut基因[18]设计其特异检测引物,Hut -1:5′ -ACTGGCGTTATCCCTTTCTCTGCT-3′,Hut -2:5′-ATGTTGTCCTGCCCCTGGTAAGAG A- 3′,引物由上海英俊生物技术有限公司合成。
大肠杆菌分子检测的PCR反应程序:94 ℃ 预变性3 min;接下来30个循环中94 ℃变性1 min,52 ℃ 退火30 s,72 ℃ 延伸30 s;最后72 ℃延伸5 min。
沙门氏菌的PCR反应程序:94 ℃ 预变性4 min;接下来35个循环中94 ℃变性45 s,56 ℃ 退火45 s,72 ℃ 延伸1 min;最后72 ℃延伸5 min。
PCR产物的检测:PCR产物点样于1.5%的琼脂糖凝胶中,以100 bp DNA Marker作为标准分子量,1×TAE缓冲液中,100 V电压下电泳1 h,EB染色后,利用凝胶成像系统观察并拍照。
1.5 数据处理基质垫料中细菌、真菌、放线菌分布数量的统计分析、大肠杆菌和沙门氏菌分布数量及其与基质垫料微生物群落的相关性分析均采用DPS 7.05统计软件进行。
2 结果与分析 2.1 微生物发酵床基质垫料细菌分布数量变化微生物发酵床基质垫料中细菌分布数量随着时间的延长呈现先上升后下降的趋势,如图 1所示,从时间上看,使用2个月垫料的细菌分布量最大,各层次分布总量为7.23×108 cfu·g-1。从空间上看,多数情况下,垫料表层细菌分布数量远高于其他层次的细菌量,峰值出现在第3个月,为5.33×108 cfu·g-1;第2、3层和4层细菌分布数量较小,峰值均在第2个月,分别为3.00×108、1.58×108 cfu·g-1和8.00×107 cfu·g-1。

|
| 图 1 微生物发酵床养猪猪舍基质垫层细菌的分布动态 Figure 1 Distribution of bacteria in the stroma cushion of pig-on-litter system |
微生物发酵床基质垫料中真菌分布数量较细菌低,随着垫料使用时间的延长,真菌分布数量呈逐渐减少的趋势(图 2),使用1个月垫料真菌分布量最大,各层次分布总量为2.35×106 cfu·g-1。使用5个月的垫料真菌分布数量比使用1个月减少了95.40%,各层次分布总量为1.08×105 cfu·g-1。

|
| 图 2 微生物发酵床养猪猪舍基质垫层真菌的分布动态 Figure 2 Distribution of fungi in the stroma cushion of pig-on-litter system |
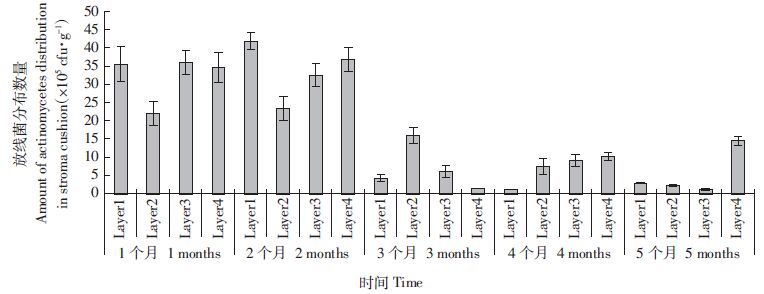
微生物发酵床基质垫料中放线菌分布数量低于细菌,略高于真菌(图 3)。随着使用时间分布数量的变化趋势与真菌相似,使用1个和2个月基质垫料中放线菌的分布数量较多,各层次的分布数量总量分别为1.28×107 cfu·g-1和1.34×107 cfu·g-1,且每个层次的分布量均在106 cfu·g-1数量级,基质垫料使用3个月后,放线菌数量明显减少,使用5个月的垫料各层次放线菌分布总量比第1个月减少了83.59%。
|
| 图 3 微生物发酵床养猪猪舍基质垫层放线菌的分布动态 Figure 3 Distribution of actinomycetes distribution in stroma cushion of pig-on-litter system |
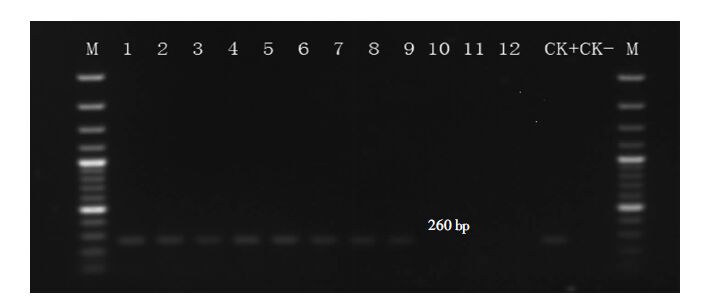
不同使用时间和层次的基质垫料中共分离得到189株形态与大肠杆菌相似菌株,经大肠杆菌特异性引物检测,其中170株扩增出一条260 bp目的条带(图 4),为阳性菌株,阳性检出率为89.94%。其中,使用1个月基质垫料分离28株菌中24株为阳性,阳性检出率为85.71%;使用2个月基质垫料分离58株疑似大肠杆菌中49株为阳性,阳性检出率为84.48%;使用3个月基质垫料的阳性检出率为100%,分离48株菌均是大肠杆菌;使用4个月基质垫料分离40株菌中35株为大肠杆菌,阳性检出率为87.5%;使用5个月基质垫料分离到14株大肠杆菌。
|
| 1~9为大肠杆菌阳性检测;10~12为大肠杆菌阴性检测;CK+为阳性对照;CK-为阴性对照;M为分子量标准 图 4 大肠杆菌特异检测图谱 Figure 4 Pattern of PCR specifical amplification with E. coli |
基质垫料中大肠杆菌分布数量变化趋势与真菌和放线菌相似,随着垫料使用时间的增加呈逐渐减少趋势(图 5)。从时间分布看,使用1个月垫料大肠杆菌分布数量最大,分布总量达5.36×106 cfu·g-1,使用3个月后,大肠杆菌数量明显下降,使用5个月垫料的第3和第4层几乎分离不到大肠杆菌,使用5个月的垫料大肠杆菌分布总量比使用1个月垫料少95.34%。从空间分布看,垫料表层大肠杆菌分布数量大于其他层次的分布量,特别是使用1个月的垫料,表层大肠杆菌分布数量最大,达到3.83×106 cfu·g-1。第2、3 层和4层的大肠杆菌分布数量最大值出现在使用2个月的垫料中,分别为1.45×106、5.00×105 cfu·g-1和8.00×105 cfu·g-1。

|
| 图 5 微生物发酵床养猪猪舍基质垫层大肠杆菌的分布动态 Figure 5 Distribution of E. coli in the stroma cushion of pig-on-litter system |
不同使用时间和层次的基质垫料中共分离到209株形态似沙门氏菌的菌株,经沙门氏菌特异性引物检测,其中85株扩增出一条495 bp目的条带(图 6),为阳性菌株,阳性检出率为40.67%,使用1、2、3、4个和5个月的基质垫料阳性检出率分别为30.23%、36.59%、53.06%、36.59%和45.71%。

|
| 1~9为沙门氏菌阳性检测;10~12为沙门氏菌阴性检测;CK+为阳性对照;CK-为阴性对照 图 6 沙门氏菌特异检测图谱 Figure 6 Pattern of PCR specifical amplification with S. enterica |
不同使用时间和层次的基质垫料中沙门氏菌的分布数量呈现先上升后下降的趋势(图 7),使用3个月的垫料沙门氏菌的分布数量最大,为1.36×107 cfu·g-1,使用5个月垫料的沙门氏菌的分布数量最低,为1.01×106 cfu·g-1,比使用3个月垫料降低92.61%,比使用1个月垫料(1.82×106 cfu·g-1 )降低44.41%。垫料表层沙门氏菌分布数量最大值出现在使用3个月的垫料,分布量为6.80×106 cfu·g-1。第2层分布量最大值为使用2个月的垫料,为5.45×106 cfu·g-1。第3和4层分布量最大为使用3个月垫料,分别为2.68×106 cfu·g-1和1.03×106 cfu·g-1。

|
| 图 7 微生物发酵床养猪猪舍基质垫层沙门氏菌的分布动态 Figure 7 Distribution of S. enterica in the stroma cushion of pig-on-litter system |
不同使用时间和层次的基质垫料中大肠杆菌、沙门氏菌、细菌、真菌和放线菌的分布数量相关性分析结果如表 1所示,大肠杆菌的分布数量与细菌呈显著的负相关,相关系数为-0.47;与放线菌呈显著正相关,相关系数为0.48;与真菌呈正相关,但相关性不显著。沙门氏菌的分布数量与细菌呈极显著的负相关,相关系数为-0.62;与真菌和放线菌均呈极显著正相关,相关系数分别为0.67和0.58。

|
微生物及其群落动态变化在垫料发酵和使用过程中起着非常重要的作用[17]。微生物发酵床基质垫料中不同微生物分布数量与垫料的养分组成、垫料的温湿度、微生物间的相互作用等多种因素密切相关[18-20]。本研究调查了不同使用时间和不同层次的基质垫料微生物种群结构,发现在垫料的使用过程中,细菌是优势种群,对垫料温度、猪粪的降解、病原菌的抑制等起主导作用,真菌和放线菌的分布数量与细菌相比,低3~4个数量级,研究结果与赵国华等[21]相吻合。从时间分布看,基质垫料中细菌数量基本呈现先上升后下降的趋势,真菌和放线菌数量随使用时间呈逐渐减少趋势,究其原因可能是使用初期垫料营养成分充足,仔猪肠道分泌的微生物在垫料中能充分、快速增长,分布数量呈现一个较快的上升趋势,随着使用时间的增加,垫料营养成分的消耗,微生物生长所需营养条件不能得到满足,限制其生长。从空间分布看,细菌在垫料表层的分布量大于其他层次,特别是使用3个月以后的垫料,2~4层次细菌分布数量明显比表层少,可能是因为随着发酵进程,垫料里层温度高,特别是发酵床3~4层温度可达80 ℃左右,抑制一些细菌的生长。
猪疫病控制是每个养猪生产者面临的主要问题。据报道,猪疫病中70%与环境空气质量相关,10%与猪粪便相关[22]。微生物发酵床养猪技术利用基质垫料对猪排出的粪尿进行降解、消化,从源头实现零排放,从而净化空气、创造干净整洁的仔猪生长环境,有效地抑制猪疫病发生[20]。此外,吴金山[23]认为,发酵床垫料能形成以有益微生物为优势种群,有效地抑制环境中有害微生物的生长,从而减少了猪疫病爆发的机会。大肠杆菌和沙门氏菌是仔猪细菌性病害两大主要病原,它们同属肠杆菌科,在自然界中分布广泛[24]。大肠杆菌作为一种指示菌,被普遍认为是判断病原体存在可能性的指标[25]。而沙门氏菌是人畜共患的肠道病原菌,目前已分离出2 500多种血清型[26],不同血清型可引发不同人畜共患病。大肠杆菌和沙门氏菌主要是通过动物的消化道感染,引起多种畜禽发生急性或慢性疾病。本研究以大肠杆菌和沙门氏菌为研究对象,跟踪调查这两种细菌在发酵床基质垫料中的分布动态,结果发现,大肠杆菌和沙门氏菌主要分布在垫料表层,且随着垫料使用时间的增加,分布量逐渐减少。究其原因可能是随着垫料发酵,所形成有益微生物种群能有效抑制大肠杆菌的生长,此外,垫料中心层次的高温也能杀死部分大肠杆菌和沙门氏菌。垫料表层这两种细菌性病原分布量普遍较里层高,所以发酵床日常管理时应注意及时翻耙,将表层垫料翻至里层深入发酵。
微生物发酵床基质垫料中大肠杆菌和沙门氏菌的分布数量与垫料中微生物群落结构密切相关。研究发现,垫料中大肠杆菌的分布量与细菌呈显著的负相关(r=-0.47),与放线菌呈显著正相关(r=0.48)。沙门氏菌的分布量与细菌呈极显著的负相关(r=-0.62),与真菌和放线菌呈极显著正相关(r=0.67,r=0.58),说明在基质垫料中细菌数量越多、真菌和放线菌数量越少时,能更好地抑制大肠杆菌和沙门氏菌的生长。
4 结论(1)大肠杆菌和沙门氏菌是人畜共患的主要肠道病原菌,其分布量可作为猪疫病特别是肠道疾病发生的指标。这两种病原细菌主要分布在垫料的表层,因此发酵床日常管理时应及时把表层垫料翻耙至里层进行发酵、降解。
(2)利用微生物发酵床养猪技术能够有效抑制基质垫料中大肠杆菌和沙门氏菌的生长,对猪舍起到疫病防控的作用,是一种无污染的健康养殖模式。
| [1] | 赵欣. 发酵床养猪技术及疾病的防控措施[J]. 养殖技术顾问 , 2010 (7) : 6–7. ZHAO Xin. Fermentation bed piggery technology and disease preven-tion and control measures[J]. Technical Advisor for Animal Husbandry , 2010 (7) : 6–7. (in Chinese) |
| [2] | 刘波, 郑雪芳, 朱昌雄, 等. 脂肪酸生物标记法研究猪舍基质垫层微生物群落多样性[J]. 生态学报 , 2008, 28 (11) : 5488–5498. LIU Bo, ZHENG Xue-fang, ZHU Chang-xiong, et al. The diversity of PLFAs biomarkers for the microbial community in the stroma cushion of non-pollution pigsty[J]. Acta Ecologica Sinica , 2008, 28 (11) : 5488–5498. (in Chinese) |
| [3] | 郑雪芳, 刘波, 林营志, 等. 利用磷脂脂肪酸生物标记分析猪舍基质垫层微生物亚群落的分化[J]. 环境科学学报 , 2009, 29 (11) : 2306–2317. ZHENG Xue-fang, LIU Bo, LIN Ying-zhi, et al. Using phospholipids fatty acid biomarkers for analysis of the microbial subcommunity in pigsty litter[J]. Acta Scientiae Circumstantiae , 2009, 29 (11) : 2306–2317. (in Chinese) |
| [4] | 蓝江林, 刘波, 唐建阳, 等. 低碳经济视角下无害化养猪微生物发酵床工程化技术体系.低碳农业导论[M]. 北京: 中国农业出版社 ,2010 : 348 -354. LAN Jiang-lin, LIU Bo, TANG Jian-yang, et al. The perspective of lowcarbon economy: Project system for innoxious raise pig using microbial fermentation bed. An introduction of low-carbon agriculture[M]. Bei-jing: China Agriculture Press , 2010 : 348 -354. (in Chinese) |
| [5] | 刘开元, 王天柱, 张利, 等. 生物发酵床养猪技术使用情况调查与思考[J]. 湖北畜牧兽医 , 2010 (1) : 15–16. LIU Kai-yuan, WANG Tian-zhu, ZHANG Li, et al. Investigation and consideration of microbial-fermentation bed feeding pig[J]. Hubei Jour-nal of Animal and Veterinary Sciences , 2010 (1) : 15–16. (in Chinese) |
| [6] | 王远孝, 李雁, 钟翔, 等. 猪用发酵床的研究与应用[J]. 家畜生态学报 , 2007, 28 (6) : 139–142. WANG Yuan-xiao, LI Yan, ZHONG Xiang, et al. Research and appli-cation of microbial-fermentation bed for pigs[J]. Journal of Domestic Animal Ecology , 2007, 28 (6) : 139–142. (in Chinese) |
| [7] | 陈焕春. 当前规模猪场病毒病趋向缓和细菌病呈上升态势[J]. 养猪 , 2008 (6) : 55. CHEN Huan-chun. Pig virus disease is going to decline and bacterial disease is on the rise in the large-scale pig farms[J]. Swine Production , 2008 (6) : 55. (in Chinese) |
| [8] | 敖日格乐, 王纯洁, 于俊娥. 牛粪堆肥中添加抑菌剂对大肠杆菌杀灭效果的研究[J]. 安微农业科学 , 2009, 37 (1) : 243–244. AORI Ge-le, WANG Chun-jie, YU Jun-e. Sterilization effects of bacte-rial inhibitor on Escherichia coli in cattle manure compost[J]. Journal of Anhui Agricultural Sciences , 2009, 37 (1) : 243–244. (in Chinese) |
| [9] | 王诚, 盛清凯, 武英, 等. 冬季水泥地面猪舍与发酵床猪舍养猪效果比较[J]. 黑龙江畜牧兽医 , 2009 (4) : 56–57. WANG Cheng, SHENG Qing-kai, WU Ying, et al. Comparative study on the cement floor and fermentation bed hog house in winter[J]. Hei-longjiang Animal Science and Veterinary Medicine , 2009 (4) : 56–57. (in Chinese) |
| [10] | 盛清凯, 王诚, 武英, 等. 冬季发酵床养殖模式对猪舍环境及猪生产性能的影响[J]. 家畜生态学报 , 2009, 30 (1) : 82–85. SHENG Qing-kai, WANG Cheng, WU Ying, et al. Effects of deep-lit-ter systems on environment in swine house productivity in cold seasons[J]. Journal of Domestic Animal Ecology , 2009, 30 (1) : 82–85. (in Chinese) |
| [11] | 朱洪, 常志州, 叶小梅, 等. 基于畜禽废弃物管理的发酵床技术研究: 芋高湿热季节养殖效果评价[J]. 农业环境科学学报 , 2008, 27 (1) : 354–358. ZHU Hong, CHANG Zhi-zhou, YE Xiao-mei, et al. Study on deep lit-ter system for management of livestock manure evaluation on effects of deep litter system on pig growth in high temperature and RH season[J]. Journal of Agro-Environment Science , 2008, 27 (1) : 354–358. (in Chinese) |
| [12] | 王诚, 张印, 王怀忠, 等. 发酵床饲养模式对猪舍环境、生长性能、猪肉品质和血液免疫的影响[J]. 山东农业科学 , 2009 (11) : 110–112. WANG Cheng, ZHANG Yin, WANG Huai-zhong, et al. Effects of mi-crobial-fermentation bed piggery on environment, growth performance, meat quality and immunity of the blood[J]. Shandong Agricultural Sci-ences , 2009 (11) : 110–112. (in Chinese) |
| [13] | 杨群, 谢金防, 韦启鹏, 等. 浅谈发酵床养猪的优缺点[J]. 江西畜牧兽医杂志 , 2009 (4) : 24–25. YANG Qun, XIE Jin-fang, WEI Qi-peng, et al. Discussion of the ad-vantages and disadvantages of fermentation bed feeding pig[J]. Jiangxi Journal of Animal Husbandry & Veterinary Medicine , 2009 (4) : 24–25. (in Chinese) |
| [14] | 郑雪芳, 刘波, 蓝江林, 等. 微生物发酵床对猪舍大肠杆菌病原生物防治作用的研究[J]. 中国农业科学 , 2011, 44 (2) : 4728–4739. ZHENG Xue-fang, LIU Bo, LAN Jiang-lin, et al. Study on the biocon-trol effects of microbial-fermentation bed on the pig pathogen Es-cherichia coli in the piggery[J]. Scientia Agricultura Sinica , 2011, 44 (2) : 4728–4739. (in Chinese) |
| [15] | 沈萍, 陈向东. 微生物学实验[M]. 北京: 高等教育出版社 ,2007 : 15 -20. SHEN Ping, CHEN Xiang-dong. Microbiological experiment[M]. Beijing: China Higher Education Press , 2007 : 15 -20. (in Chinese) |
| [16] | 刘波, 朱昌雄. 微生物发酵床零污染养猪法标准操作技术[J]. 农业知识:科学养殖 , 2010 (3) : 17. LIU Bo, ZHU Chang-xiong. Standard technique of microbial-fermen-tation bed piggery[J]. Agricultural Knowledge: Science Culture , 2010 (3) : 17. (in Chinese) |
| [17] | 李庆康, 吴雷, 刘海琴, 等. 我国集约化畜禽养殖场粪便处理利用现状及展望[J]. 农业环境保护 , 2000, 19 (4) : 251–254. LI Qing-kang, WU Lei, LIU Hai-qin, et al. Status and prospect of treatment and utilization of manure on intensive livestock and poultry farms[J]. Agro-Environmental Protection , 2000, 19 (4) : 251–254. (in Chinese) |
| [18] | 朱红, 常志州, 王世梅, 等. 基于畜禽废弃物管理的发酵床技术研究:发酵床剖面特征研究[J]. 农业环境科学学报 , 2007, 26 (2) : 754–758. ZHU Hong, CHANG Zhi-zhou, WANG Shi-mei, et al. Deep litter sys-tem for management of livestock manure: Profile characteristics of litter in deep-litter system[J]. Journal of Agro-Environment Science , 2007, 26 (2) : 754–758. (in Chinese) |
| [19] | 卫亚红, 梁军锋, 黄懿梅, 等. 家畜粪便好氧堆肥中主要微生物类群分析[J]. 中国农学通报 , 2007, 23 (11) : 242–248. WEI Ya-hong, LIANG Jun-feng, HUANG Yi-mei, et al. Analysis of dominant microflora during livestock manure aerobic composting[J]. Chinese Agricultural Science Bulletin , 2007, 23 (11) : 242–248. (in Chinese) |
| [20] | 刘波, 李兆龙, 唐建阳, 等. 微生物发酵床大栏养殖猪群管理的研究[J]. 福建农业学报 , 2014, 29 (11) : 1051–1057. LIU Bo, LI Zhao-long, TANG Jian-yang, et al. Breeding management for large population of pigs in large-scale piggery of microbial fermen-tation bed[J]. Fujian Journal of Agricultural Sciences , 2014, 29 (11) : 1051–1057. (in Chinese) |
| [21] | 赵国华, 方雅恒, 陈贵. 生物发酵床养猪垫料中营养成分和微生物群落研究[J]. 安微农业科学 , 2015, 43 (8) : 98–99. ZHAO Guo-hua, FANG Ya-heng, CHEN Gui. Study on the nutritional components and microbial community in beddings of pig raising by bio-fermentation bed[J]. Journal of Anhui Agricultural Sciences , 2015, 43 (8) : 98–99. (in Chinese) |
| [22] | 刘滨疆. 环境安全型鸡舍的配置分析与实践[J]. 中国禽业导刊 , 2009, 10 : 21–23. LIU Bin-jiang. What's the safe establishment for the hennery[J]. Guide to Chinese Poultry , 2009, 10 : 21–23. (in Chinese) |
| [23] | 吴金山. 发酵床养猪技术的应用价值[J]. 中国畜禽种业 , 2009 (12) : 61–63. WU JIN-shan. Application of pig-fermentation technology[J]. The Chinese Livestock Breeding , 2009 (12) : 61–63. (in Chinese) |
| [24] | 李刚. 猪胴体淋巴结中致病性大肠杆菌和沙门氏菌的分离与鉴定[J]. 中国动物检疫 , 2008, 25 (10) : 33–34. LI Gang. Isolation and identification of the pathogenic E. coli and Salmonella in carcass iymph nodes[J]. China Journal of Animal Quar-antine , 2008, 25 (10) : 33–34. (in Chinese) |
| [25] | Gong C M, Inoue K, Inanaga S, et al. Survival of pathogenic bacteria in compost with special reference to Escherichia coli[J]. Journal of Envi-ronmental Sciences , 2005, 17 (5) : 770–774. |
| [26] | 陆承平. 兽医微生物学[M]. 北京: 中国农业出版社 ,2003 . LU Cheng-ping. Veterinary microbiology[M]. Beijing: China Agricul-ture Press , 2003 . (in Chinese) |
 2016, Vol. 33
2016, Vol. 33