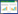文章信息
- 徐仁扣
- XU Ren-kou
- 秸秆生物质炭对红壤酸度的改良作用:回顾与展望
- Progresses on Amelioration of Red Soil Acidity with Crop Straw Biochar: A Review
- 农业资源与环境学报, 2016, 33(4): 303-309
- Journal of Agricultural Resources and Environment, 2016, 33(4): 303-309
- http://dx.doi.org/10.13254/j.jare.2016.0097
-
文章历史
- 收稿日期: 2016-04-13
我国南方热带和亚热带地区分布大面积的酸性红壤,近30年来由于酸沉降的持续影响及农业生产中铵态氮肥的大量施用,红壤酸化呈加速发展趋势[1, 2, 3],对农林业生产和生态环境造成严重危害[4, 5]。施用石灰等碱性物质可有效中和土壤酸度,提高土壤pH 值,是改良酸性土壤的常用方法。但长期施用石灰也会对土壤性质造成负面影响,如会导致土壤板结以及造成土壤 Ca、Mg 和 K 等养分不平衡。因此,近年来,人们一直在研发改良酸性土壤的新方法。
生物质炭是农业有机废弃物及其他废弃的生物质材料在厌氧条件下低温热解的产物[6],由于富含 K、Ca、Mg 和 P 等养分元素及丰富的孔隙结构,可用作土壤改良剂,提高土壤肥力[6, 7, 8]。一些生物质炭呈碱性,施入酸性土壤可中和土壤酸度,提高土壤 pH 值,可用作酸性土壤改良剂[7, 8, 9, 10]。因此,近年来生物质炭的碱性特征及其对酸性土壤的改良效果受到国内外学者的关注,并对此开展了广泛的研究[9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19]。本文总结了利用秸秆生物质炭改良红壤酸度研究取得的主要进展。
1 秸秆原料对生物质炭性质及其改良红壤酸度效果的影响作物在生长过程中通过其根系从土壤中吸收矿质养分,这些养分包括无机阳离子和阴离子。一般作物吸收阳离子养分的数量多于阴离子,为了保持体内正电荷与负电荷数量相等,植物会在体内积累有机阴离子,这些有机阴离子是羧基和酚羟基等弱酸基去质子化的产物,是一种碱[20]。因此,农作物秸秆等农业废弃物含有一定量的碱性物质,可以直接用于酸性土壤改良[21, 22, 23, 24, 25, 26, 27]。
当将农作物秸秆在厌氧条件下热解制备成生物质炭时,秸秆中的碱性物质会转移并富集在生物质炭中,这是秸秆生物质炭呈碱性的一个重要原因[13]。也因为这一原因,生物质炭的含碱量一般高于相应的秸秆[13]。红外光谱(FTIR)的分析结果表明,秸秆及其在350℃下制备的生物质炭中均含丰富的羧基和酚羟基等含氧官能团,证明了这一论述[28]。当然秸秆在热解过程中部分官能团发生变化,如糖醇基和烷基发生烧失[28]。生物质炭的红外光谱还表明,除含氧有机官能团外,还产生碳酸根等无机阴离子,说明生物质炭制备过程中产生新的碱性物质碳酸盐[28]。因此,碳酸盐是生物质炭中碱的另一重要形态,它主要存在于生物质炭制备过程中形成的灰分中。X-射线衍射分析结果表明,油菜秸秆、小麦秸秆、稻草、稻壳、玉米秸秆、大豆秸秆、蚕豆秸秆、豌豆秸秆和绿豆秸秆等10种农业废弃物在350℃下制备的生物质炭中碳酸盐主要以无定形形态存在,仅在花生秸秆炭和绿豆秸秆炭中观察到少量方解石和白云石等结晶态碳酸盐[28]。定量分析结果表明,碳酸盐对上述10种生物质炭总碱含量的贡献在20%~73%之间,不同生物质炭之间存在很大差异[28]。
生物质炭的总碱含量也随制备物料而变化,一般豆科植物秸秆制备的生物炭的碱含量高于非豆科植物秸秆制备的生物质炭[9, 28],这是因为豆科植物在其生长过程中从土壤中吸收的阳离子与阴离子数量的差值大于非豆科类植物,因此豆科植物秸秆比非豆科植物秸秆积累更多的碱性物质[27],这是豆科类植物秸秆制备的生物质炭的碱含量高于非豆科植物秸秆制备的生物质炭的主要原因。在非豆科类农作物中,油菜秸秆和玉米秸秆制备的生物质炭的碱含量较高,而稻草和小麦秸秆制备的生物质炭的碱含量较低[28]。
通过室内培养实验研究了油菜秸秆、小麦秸秆、稻草、稻壳、玉米秸秆、大豆秸秆、蚕豆秸秆和绿豆秸秆等9种农业废弃物在350℃下制备的生物质炭对红壤酸度的改良效果,结果表明所有生物质炭均可提高红壤 pH 值,降低土壤交换性酸和交换性铝,豆科类植物秸秆制备的生物质炭的改良效果优于非豆科类植物秸秆制备的生物质炭,与生物质炭的含碱量的大小相一致[9]。进一步研究表明,生物质炭对红壤酸度的改良效果与生物质炭的含碱量高度相关[9],说明含碱量是决定生物质炭对红壤酸度改良效果的关键因子,可用作筛选高效生物质炭改良剂的参数。生物质炭富含 Ca、Mg 和 K 等盐基性养分离子,而这正是酸性土壤广泛缺乏的,因此,添加生物质炭可以提高红壤的交换性盐基阳离子的含量。土壤交换性酸以交换性铝为主,交换性铝与交换性盐基阳离子含量呈此消彼长的关系。当向酸性土壤中添加生物质炭时,生物质炭中的盐基阳离子与交换性铝发生阳离子交换反应,使部分交换性铝释放进入土壤溶液中,此时生物质炭中的碱中和由于铝离子水解产生的 H+,促进溶液中铝由活性形态向惰性的氢氧化铝转变。这是生物质炭增加土壤交换性盐基阳离子、降低土壤交换性铝的主要机制,也是生物质炭改良红壤酸度的主要机制[28]。
2 制备温度对生物质炭性质及其改良红壤酸度效果的影响制备温度是影响生物质炭的性质和对红壤酸度改良效果的另一个重要因素。比较了由油菜秸秆、玉米秸秆、大豆秸秆和花生秸秆在300、500℃和700℃下制备的生物质炭的性质,结果表明,生物质炭的 pH值、含碱量和盐基阳离子的含量均随制备温度的升高而增加,但生物质炭的产率呈相反的变化趋势[11]。因此,较高温度下制备的生物质炭对红壤酸度的改良效果优于较低温度下制备的生物质炭[14]。研究发现,生物质炭中的总碳酸盐和结晶态的碳酸盐(方解石和白云石)含量也随制备温度的升高而增加;但生物质炭表面有机阴离子的含量随温度升高而减小,因为随着温度升高,农作物秸秆表面的有机官能团发生部分烧失[11]。因此碳酸盐对生物质炭碱含量的贡献随温度升高而增加,而有机阴离子对生物质炭碱含量的贡献随温度升高而减小。
虽然高热解温度下制备的生物质炭含碱量高,对土壤酸度的中和效果也最好,但生物质炭的产率随温度升高显著减小。考虑生物质炭的综合效率,建议选择500℃作为制备用于酸性土壤改良的秸秆生物质炭的最佳温度[11]。这一温度下制备的生物质炭具有较高的碳酸盐含量、一定量的有机阴离子和中等的产率。
用我们自行设计、委托加工制造的秸秆炭化炉在400~500℃制备生物质炭,用于红壤酸度改良的田间小区试验,以验证田间条件下生物质炭对红壤酸度的改良效果。结果表明:添加油菜秸秆炭、花生秸秆炭和稻壳炭1年后均可提高土壤的 pH 值,其中油菜秸秆炭和花生秸秆炭的效果较明显[19]。与对照相比,油菜秸秆炭显著增加了土壤的 pH 值(P<0.05)。在接下来的第2年和第3年内,虽然生物质炭处理的土壤 pH值有降低趋势,但与对照相比油菜秸秆炭和花生秸秆炭增加土壤 pH 值的效果仍较明显,施用3年后仍使红壤pH 提高0.24个单位,表明一次施用大量生物质炭可在较长间内起到对土壤酸度的改良效果[19]。施用生物质炭也明显提高了油菜籽的产量,其中油菜秸秆炭和花生秸秆炭对油菜籽产量的增加作用达到了显著水平(P<0.05),7 500 kg·hm-2的油菜秸秆炭和花生秸秆炭使油菜籽产量分别增加了90.9% 和67.4% [19]。
3 生物质炭对红壤表面电荷和 pH 缓冲容量的影响生物质炭表面含丰富的含氧官能团,如羧基和酚羟基等,这些官能团在碱性条件下主要以阴离子存在,使生物质炭表面带负电荷。由于生物质炭表面负电荷主要来源于弱酸性官能团的去质子化,因此生物质炭表面负电荷数量随介质 pH 值而变化。Zeta 电位的测定结果表明,在 pH 值3~7范围内,上述9种农作物秸秆在350℃下制备的生物质炭的 Zeta 电位均为负值,说明在这一 pH 值范围内生物质炭表面带净负电荷[9]。随着 pH 值升高,生物质炭的 Zeta 电位绝对值增加,说明生物质炭表面负电荷数量增多。不同温度下制备的生物质炭的 Zeta 电位结果表明,随着制备温度升高,Zeta 电位绝对值减小,表明生物质炭表面负电荷的数量随生物质炭制备温度的升高而减小[11],与生物质炭表面羧基和酚羟基的数量随制备温度的升高而减小的变化趋势一致。
由于生物质炭表面带有大量负电荷,因此其具有很高的 CEC。通常秸秆生物质炭的 CEC 为热带和亚热带地区土壤 CEC 的10倍以上[13]。因此,从理论上预测,添加生物质炭应可提高热带和亚热带地区土壤的 CEC。Yuan 等[13]的研究结果表明,按土壤重量的1%向采自安徽皖南的红壤中添加由豌豆秸秆、大豆秸秆、油菜秸秆和稻壳在350℃下制备的生物质炭,该红壤的 CEC 显著增加。但也有研究表明,向酸性土壤中添加由废弃木材和核桃壳制备的生物质炭并未显著提高土壤的 CEC[8, 29]。这些结果说明,生物质炭对土壤 CEC 的影响不仅与生物质炭的性质有关,可能还与土壤本身的性质有关。为了验证这一点,笔者比较了几种秸秆生物质炭对3种初始 CEC 不同的可变电荷土壤的 CEC 的影响。3种土壤分别为采自海南、由玄武岩发育的砖红壤,采自海南、由花岗岩发育的红壤,采自湖南、由第四纪红色黏土发育的红壤。结果表明[28],按土重的1%添加由稻壳、小麦秸秆、玉米秸秆、蚕豆秸秆、大豆秸秆、花生秸秆和绿豆秸秆制备的6种生物质炭均显著增加砖红壤的 CEC,土壤 CEC由55.4 mmol(+)·kg-1增加至62.7~67.1 mmol(+)·kg-1。添加玉米秸秆炭、蚕豆秸秆炭、花生秸秆炭和绿豆秸秆炭增加海南红壤的 CEC,土壤 CEC 由71.1 mmol(+)·kg-1增加至74.5~79.2 mmol(+)·kg-1;但添加稻壳炭和小麦秸秆炭没有显著增加该红壤的 CEC。对湖南红壤,由于其本身 CEC 较高,为115.5 mmol(+)·kg-1,添加6种生物质炭均未增加该土壤的 CEC。因此,秸秆生物质炭可以显著提高初始 CEC 较低的酸性红壤的 CEC,但生物质炭对初始 CEC 较高的土壤的 CEC 的影响较小。研究还发现,秸秆生物质炭对红壤 CEC 的提升作用随生物质炭添加量的增加而显著增加。
土壤的 pH 缓冲容量是决定土壤酸化难易程度的重要参数,在相同外源酸加入量下,土壤 pH 缓冲容量越大,土壤越不容易发生酸化。研究还发现,红壤的 pH 缓冲容量与土壤的 CEC 呈显著正相关,随着土壤 CEC 增加,土壤 pH 缓冲容量增加[30]。向3种酸性红壤中添加秸秆生物质炭增加了土壤 CEC,因此显著提高了这些土壤的 pH 缓冲容量(表 1)。随着2种生物质炭添加量的增加,土壤 CEC 的增幅增加,土壤pH 缓冲容量的增幅也相应增加(表 1)。比较2种生物质炭的结果,可以发现花生秸秆炭在提高土壤 CEC和增加土壤 pH 缓冲容量方面的效果大于油菜秸秆炭,与花生秸秆炭表面含氧官能团的数量高于油菜秸秆炭的结果一致[28]。
从上述分析可以看出,向酸性红壤中添加生物质炭不仅可以提高土壤 pH 值,增加土壤交换性盐基阳离子含量,降低土壤交换性酸和交换性铝,而且可以增加土壤的 CEC 和土壤的 pH 缓冲容量,因此不仅中和了红壤的酸度,而且提高了红壤的肥力,增强了红壤对外源酸的抵抗能力。与传统的石灰改良剂相比,生物质炭具有改良红壤酸度,同时提高土壤肥力的综合优势。但由于单位质量的生物质炭所含碱性物质的量低于石灰,要达到相似的酸度中和效果所需生物质炭的数量远高于石灰。如果将生物质炭与其他改良方法配合使用,可以更好发挥生物质炭的综合效应。
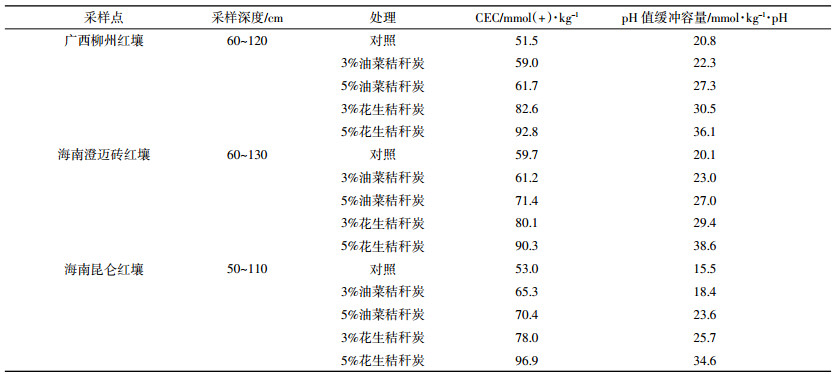
4 生物质炭与其他改良方法的配合通过室内培养实验和温室盆栽实验研究了碱渣与秸秆生物质炭配合施用对红壤酸度的改良效果并与单一碱渣、生物质炭和石灰的改良效果进行比较[31]。碱渣是铵碱法生产纯碱的副产品,主要含氧化钙和氧化镁等碱性物质。室内培养研究表明,石灰虽然对土壤酸度有很好的改良效果,但仅能同时提高土壤交换性 Ca2+含量,碱渣不仅能改良土壤酸度,提高土壤交换性 Ca2+含量,还能增加土壤交换性 Mg2+含量。生物质炭对土壤酸度的改良效果低于石灰和碱渣,但它可以提高土壤交换性 Ca2+、Mg2+、K+含量。将碱渣和生物质炭配合施用,不仅对土壤酸度有很好的改良效果,而且能有效提高土壤交换性 Ca2+、Mg2+、K+和有效磷含量。盆栽实验结果与培养实验一致,进一步验证了这些改良剂对土壤酸度的改良效果。盆栽实验结果还表明,碱渣与生物质炭配合施用还促进了大豆等植物对N、P、K、Ca、Mg 等养分的吸收(表 2),因此是一种优良的改良土壤酸度的方法,能够更好地改良红壤酸度并提高土壤养分含量。
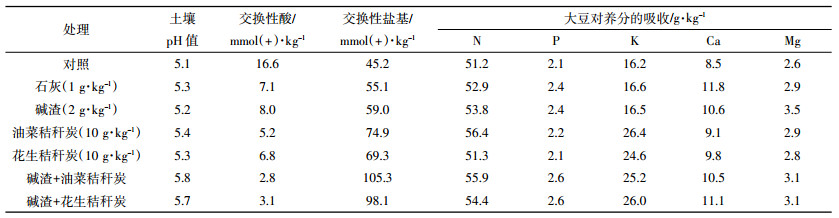
当向植物供应硝态氮肥时,植物根系吸收硝酸根,并同时向根际土壤中释放氢氧根,可以提高根际土壤的 pH 值,据此可以建立酸化红壤的植物修复方法[32, 33]。但是,如果土壤已发生严重酸化,此时植物无法正常生长,硝态氮的作用就难以发挥。如果将生物质炭与硝态氮配合施用,利用生物质炭对土壤酸度的改良作用以维持植物正常生长,作物生长促进其对硝态氮的吸收,并向根际土壤中释放氢氧根,可以增强对土壤酸度的中和作用。盆栽实验结果验证了这一假设[34]。研究结果表明,将秸秆生物质炭与硝态氮肥配合施用可以取得比单一改良方法更好的改良效果(表 3)。生物质炭对土壤酸度的改良作用促进了玉米生长,增加生物量,进而促进了玉米对硝态氮的吸收,玉米根系释放更多的 OH-。因此两者的改良作用不是简单加和,而是相互促进,最终的效果大于2种方法单独使用时改良效果的加和(表 3)。
生物质炭表面含丰富的有机官能团,并带大量负电荷,因此对 Cu(Ⅱ)、Pb(Ⅱ)和 Cd(Ⅱ)等重金属阳离子具有很强的吸附能力和很高的吸附容量[35, 36, 37]。向红壤中添加生物质炭可以增强这类酸性土壤对这些重金属的吸附能力[38, 39, 40]。生物质炭可以通过2种机制促进重金属在红壤表面的吸附:添加生物质炭增加土壤表面负电荷,增加重金属的静电吸附量;生物质炭表面官能团与重金属阳离子形成表面络合物,促进土壤对重金属的专性吸附[38, 39, 40]。比较了生物质炭对1种砖红壤和2种红壤吸附 Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)的影响,结果表明油菜秸秆炭和花生秸秆炭主要通过非静电吸附机制促进土壤对 Cu(Ⅱ)的吸附,而静电吸附机制和非静电吸附机制均对生物质炭促进红壤吸附Pb(Ⅱ)和 Cd(Ⅱ)有贡献 [40]。生物质炭对红壤吸附Cu(Ⅱ)和 Pb(Ⅱ)的促进作用大于其对红壤吸附Cd(Ⅱ)的促进作用[40]。红外光谱的分析结果表明,Cu2+可与生物质炭表面官能团形成络合物[37],Zeta 电位的测定结果表明,生物质炭吸附 Cu(Ⅱ)使 Zeta 电位绝对值减小,说明 Cu(Ⅱ)吸附使生物质炭表面负电荷减少,进一步证明 Cu(Ⅱ)在生物质炭表面发生了专性吸附[37]。这些结果为解释生物质炭促进红壤吸附重金属的机制提供了证据。
由于添加生物质炭可以显著提高红壤对重金属的吸附能力,因此,生物质炭可以用作有机改良剂钝化污染红壤中的重金属[41],以降低其对植物的毒性和生物有效性。研究表明,生物质炭对 Cu(Ⅱ)和 Pb(Ⅱ)在酸性土壤中的钝化作用与生物质炭表面官能团含量呈正相关[42],说明生物质炭表面官能团与重金属阳离子的络合作用在钝化土壤重金属中发挥重要作用。生物质炭钝化污染红壤中重金属的另一机制是提高土壤 pH 值,促进重金属阳离子形成沉淀产物。比较了2种机制对重金属钝化的贡献,发现沉淀作用的贡献小于形成表面络合物的贡献[43]。如在 pH 5.0时,Cu(Ⅱ)、Pb(Ⅱ)和 Cd(Ⅱ)在花生秸秆炭表面形成沉淀对表观吸附量的贡献分别为23%、24%和17%[40]。这进一步说明生物质炭的表面官能团在钝化酸性红壤中重金属过程中发挥重要作用,也为筛选钝化土壤重金属的高效生物质炭改良剂提供依据。
6 展望 6.1 加强田间条件下生物质炭对红壤酸度改良效果的验证研究目前生物质炭对红壤酸度的改良研究以室内模拟实验为主,田间条件下的改良研究开展得很少。今后要加强田间条件下生物质炭改良红壤酸度效果和机制的验证研究,为实际的推广应用提供依据。
6.2 研发生产大量生物质炭的新方法,为大面积推广应用创造条件目前开展生物质炭改良红壤酸度的田间实验和大面积推广应用的主要制约因素是缺少大批量生产生物质炭的廉价方法。研发廉价和高效的生物质炭批量制备方法是未来的研究重点之一。秸秆气化站利用农业废弃物厌氧热解生产燃气,副产品为生物质炭。因此,结合秸秆气化生产批量生物质炭是一个较好的选择。但目前秸秆气化所用原料主要为稻壳,不能直接使用农作物秸秆做原料,限制了高效生物质炭改良剂的生产。未来应加强对秸秆气化设备的改造研究,使其能够直接以各种农作物秸秆为原料生产燃气,同时获得高效生物质炭改良剂。另一方面,研制田间条件下秸秆的原位快速炭化方法是一项极具挑战性的课题,应与机械和工程等方面的专家加强合作,推动生物质炭生产方法的创新,为生物质炭改良剂的大面积推广应用创造条件。
6.3 田间条件下钝化重金属的效果及长期效果的验证与红壤酸度改良相似,目前对生物质炭钝化污染红壤中重金属的研究也主要以室内模拟实验为主,缺少田间条件下的效果验证。未来应加强田间条件下生物质炭钝化土壤重金属的效果和机制的验证研究,而且还应关注生物质炭钝化重金属的长期效果。因为生物质炭的表面官能团会随时间的增加发生变化,导致部分已钝化的重金属再次活化。
6.4 专用生物质炭改良剂的研制从以上分析可知,生物质炭的性质随制备原料和制备条件而变化,根据这一特点,可以通过筛选原料和选择合适条件制备专用生物质炭改良剂。如可以选择碱含量高的作物秸秆在中等温度下制备酸性土壤改良剂;选择表面官能团丰富的作物秸秆在较低温度下制备钝化污染红壤中重金属的生物质炭改良剂;选择富钾的作物秸秆制备富钾生物质炭,用以补充红壤钾素养分的不足。
| [1] | Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968):1008-1010. |
| [2] | Vogt R D, Seip H M, Larssen T, et al. Potential acidifying capacity of deposition-experiences from regions with high NH4+ and dry deposition in China[J]. Science of the Total Environment, 2006, 367(1):394-404. |
| [3] | Zhao Y, Duan L, Xing J, et al. Soil acidification in China:Is controlling SO2 emissions enough?[J]. Environmental Science and Technology, 2009, 43(21):8021-8026. |
| [4] | 赵其国. 中国东部红壤地区土壤退化的时空变化、机理及调控[M]. 北京:科学出版社, 2002. ZHAO Qi-guo. Temporal and spatial variation, mechanisms and control of red soil degradation in east of China[M]. Beijing:Science Press, 2002. (in Chinese) |
| [5] | 徐仁扣. 土壤酸化及其调控研究进展[J]. 土壤, 2015, 47(2):238-244. XU Ren-kou. Research progresses in soil acidification and its control[J]. Soils, 2015, 47(2):238-244. (in Chinese) |
| [6] | Sohi S P, Krull E, Lopez-Capel E, et al. A review of biochar and its use and function in soil[J]. Advances in Agronomy, 2010, 105:47-82. |
| [7] | Chan K Y, van Zwieten L, Meszaros I, et al. Agronomic values of greenwaste biochar as a soil amendment[J]. Australian Journal of Soil Research, 2007, 45(8):629-634. |
| [8] | Novak J M, Busscher W J, Laird D L, et al. Impact of biochar amendment on fertility of a southeastern coastal plain soil[J]. Soil Science, 2009, 174(2):105-112. |
| [9] | Yuan J H, Xu R K. The amelioration effects of low temperature biochar generated from nine crop residues on an acidic Ultisol[J]. Soil Use and Management, 2011, 27(1):110-115. |
| [10] | 袁金华, 徐仁扣. 生物质炭对酸性土壤改良作用的研究进展[J]. 土壤, 2012, 44(4):541-547. YUAN Jin-hua, XU Ren-kou. Research progress of amelioration effects of biochars on acid soils[J]. Soils, 2012, 44(4):541-547.(in Chinese) |
| [11] | Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102(3):3488-3497. |
| [12] | Yuan J H, Xu R K, Wang N, et al. Amendment of acid soils with crop residues and biochars[J]. Pedosphere, 2011, 21(3):302-308. |
| [13] | Yuan J H, Xu R K, Qian W, et al. Comparison of the ameliorating effects on an acidic Ultisol between four crop straws and their biochars[J]. Journal of Soils and Sediments, 2011, 11(5):741-750. |
| [14] | Wan Q, Yuan J H, Xu R K, et al. Pyrolysis temperature influences ameliorating effects of biochars on acid soil[J]. Environmental Science and Pollution Research, 2014, 21(4):2486-2495. |
| [15] | Dai Z M, Wang Y N, Muhammad N, et al. The effects and mechanisms of soil acidity changes, following incorporation of biochars in three soils differing in initial pH[J]. Soil Science Society of America Journal, 2014, 78(5):1606-1614. |
| [16] | Chintala R, Mollinedo J, Schmumacher T E, et al. Effect biochar on chemical properties of acidic soil[J]. Archives of Agronomy and Soil Science, 2014, 60(3):393-404. |
| [17] | Martinsen V, Alling V, Nurida N L, et al. pH effects of the addition of three biochars to acidic Indonesian mineral soils[J]. Soil Science and Plant Nutrition, 2015, 61(5):821-834. |
| [18] | Zong Y T, Xiao Q, Lu S G. Acidity, water retention, and mechanical physical quality of a strongly acidic Ultisol amended with biochars derived from different feedstocks[J]. Journal of Soil and Sediments, 2016, 16(1):177-190. |
| [19] | 李九玉, 赵安珍, 袁金华, 等. 农业废弃物制备的生物质炭对红壤酸度和油菜产量的影响[J]. 土壤, 2015, 47(2):334-339. LI Jiu-yu, ZHAO An-zhen, YUAN Jin-hua, et al. Amelioration effects of crop residue-derived biochars on soil acidity and canola yield in red soil[J]. Soils, 2015, 47(2):334-339. (in Chinese) |
| [20] | Yan F, Schubert S. Soil pH changes after application of plant shoot materials of faba bean and wheat[J]. Plant and Soil, 2000, 220:279-287. |
| [21] | Noble A D, Zenneck I, Randall P J. Leaf litter ash alkalinity and neutralization of soil acidity[J]. Plant and Soil, 1996, 179:293-302. |
| [22] | Pocknee S, Sumner M E. Cation and N contents of organic matter determine its soil liming potential[J]. Soil Science Society of America Journal, 1997, 61:86-92. |
| [23] | Tang C, Sparling G P, McLay C D A, et al. Effect of short-term legume residue decomposition on soil acidity[J]. Australian Journal of Soil Research, 1999, 37:561-573. |
| [24] | Xu R K, Coventry D R. Soil pH changes associated with lupin and wheat plant materials incorporated in a red brown earth soil[J]. Plant and Soil, 2003, 250:113-119. |
| [25] | Xu J M, Tang C, Chen Z L. The role of plant residues in pH change of acid soils differing in initial pH[J]. Soil Biology and Biochemistry, 2006, 38:709-719. |
| [26] | Wang N, Li J Y, Xu R K. Use of various agricultural by-products to study the pH effects in an acid tea garden soil[J]. Soil Use and Management, 2009, 25:128-132. |
| [27] | Wang N, Xu R K, Li J Y. Amelioration of an acid Ultisol by agricultural by-products[J]. Land Degradation and Development, 2011, 22:513-518. |
| [28] | Yuan J H, Xu R K. Effects of biochars generated from crop residues on chemical properties of acid soils from tropical and subtropical China[J]. Soil Research, 2012, 50(7):570-578. |
| [29] | Steiner C, Teixeira W G, Lehmann J, et al. Long-term effects of manure, charcoal, and mineral fertilization on crop production and fertility on a highly weathered central Amazonian upland soil[J]. Plant and Soil, 2007, 291:275-290. |
| [30] | Xu R K, Zhao A Z, Yuan J H, et al. pH buffering capacity of acid soils from tropical and subtropical regions of China as influenced by incorporation of crop straw biochars[J]. Journal of Soils and Sediments, 2012, 12(4):494-502. |
| [31] | Masud M M, Li J Y, Xu R K. The use of alkaline slag and crop residue biochars to promote base saturation and reduce soil acidity in an acidic Ultisol[J]. Pedosphere, 2014, 24(6):791-798. |
| [32] | Tang C, Conyers M K, Nuruzzaman M, et al. Biological amelioration of subsoil acidity through managing nitrate uptake by wheat crops[J]. Plant and Soil, 2011, 338:383-397. |
| [33] | Masud M M, Guo D, Li J Y, et al. Hydroxyl release by maize(Zea mays L.) roots under acidic condition due to nitrate absorption as related with amelioration of an acidic Ultisol[J]. Journal of Soils and Sediments, 2014, 14(5):845-853. |
| [34] | Mehmood K, Li J Y, Jiang J, et al. Effect of low energy consuming biochars in combination with NO3--N fertilizer on soil acidity amelioration and maize growth[J]. Journal of Soils and Sediments, 2015, doi:10.1007/s11368-015-1219-y. |
| [35] | Mohan D, Pittman Jr CU, Bricka M, et al. Sorption of arsenic, cadmium, and lead by chars produced from fast pyrolysis of wood and bark during bio-oil production[J]. Journal of Colloid and Interface Science, 2007, 310:57-73. |
| [36] | Cao X, Ma L, Gao B, et al. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science and Technology, 2009, 43:3285-3291. |
| [37] | Tong X J, Li J Y, Yuan J H, et al. Adsorption of Cu(Ⅱ) by biochars generated from crop straws[J]. Chemical Engineering Journal, 2011, 172:828-834. |
| [38] | 蒋田雨, 姜军,徐仁扣,等. 稻草生物质炭对可变电荷土壤吸附Cd(II)的影响[J]. 农业环境科学学报, 2012, 31(6):1111-1117. JIANG Tian-yu, JIANG Jun, XU Ren-kou, et al. Effect of biochar from rice straw on adsorption of Cd(Ⅱ) by variable charge soils[J]. Journal of Agro-Environment Science, 2012, 31(6):1111-1117. (in Chinese) |
| [39] | Jiang T Y, Jiang J, Xu R K, et al. Adsorption of Pb(Ⅱ) on variable charge soils amended with rice-straw derived biochar[J]. Chemosphere, 2012, 89:249-256. |
| [40] | Xu R K, Zhao A Z. Effect of biochars on adsorption of Cu(Ⅱ), Pb(Ⅱ) and Cd(Ⅱ) by three variable charge soils from southern China[J]. Environmental Science and Pollution Research, 2013, 20:8491-8501. |
| [41] | Jiang J, Xu R K, Jiang T Y, et al. Immobilization of Cu(Ⅱ), Pb(Ⅱ) and Cd(Ⅱ) by the addition of rice straw derived biochar in a simulating polluted Ultisol[J]. Journal of Hazardous Materials, 2012, 229-230:145-150. |
| [42] | Uchimiya M, Chang S, Klasson K T. Screening biochars for heavy metal retention in soil:Role of oxygen functional group[J]. Journal of Hazardous Materials, 2011, 190:432-441. |
| [43] | Jiang J, Xu R K. Application of crop straw derived biochars to Cu(Ⅱ) contaminated Ultisol:Evaluating role of alkali and organic functional groups in Cu(Ⅱ) immobilization[J]. Bioresource Technology, 2013, 133:537-545. |
 2016, Vol. 33
2016, Vol. 33