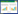文章信息
- 杨继业, 崔冠慧, 习彦花, 李亚冰, 张根伟, 张丽萍, 程辉彩
- YANG Ji-ye, CUI Guan-hui, XI Yan-hua, LI Ya-bing, ZHANG Gen-wei, ZHANG Li-ping, CHENG Hui-cai
- 产黄纤维单胞菌CR-14菌株诱变选育及发酵条件优化
- Screening and Mutation Breeding of the Celloulonmonas flavigena CR-14 and Optimization of Its Fermentation Conditions
- 农业资源与环境学报, 2016, 33(3): 262-267
- Journal of Agricultural Resources and Environment, 2016, 33(3): 262-267
- http://dx.doi.org/10.13254/j.jare.2015.0269
-
文章历史
- 收稿日期: 2015-11-11
我国每年产生秸秆约6亿t,约占全世界总量的25%,大部分秸秆被焚烧,不仅污染环境,同时也造成了资源浪费[1]。目前利用秸秆厌氧发酵产沼气,可以回收高达52 %的能源,既高效利用资源又减少了环境污染,因此具有较高的发展潜力[2]。 秸秆直接发酵产气效率比较慢,这与秸秆中纤维素含量较高有关,纤维素只有被纤维素酶水解成小分子糖才能充分利用[3, 4, 5]。产黄纤维单胞菌CR-14是本课题组从牛瘤胃中筛选的一株兼性厌氧纤维素酶产生菌,其纤维素酶活为6.31 U,可以显著促进秸秆厌氧发酵水解效率[6]。为了进一步提高菌株CR-14产纤维素酶活力,对菌株进行诱变处理,目前诱变方法主要是化学诱变、物理诱变。本文采用亚硝酸、紫外线诱变[7]及复合诱变对CR-14进行菌种改良。为了对后续产业化生产提供理论依据,本文并对诱变选育出的高效菌株进行发酵条件优化。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株产黄纤维单胞菌CR-14菌株:河北省科学院生物研究所微生物室保藏。
1.1.2 培养基初筛培养基(g·L-1)[6]:刚果红 1.5、CMC-Na 5.0、MgSO4 0.5、K2HPO4 10.0、(NH4)2SO4 2.0、NaCl 0.5、琼脂 15.0,pH7.2~7.4。
种子培养基:PB培养基。
发酵培养基(g·L-1)[6]:CMC-Na 10.0、蛋白胨5.0、牛肉膏 2.5、MgSO4 0.5、K2HPO4 10.0、(NH4)2SO4 2.0、NaCl 2.5,pH7.2~7.4。
1.1.3 药品及溶液配制羧甲基纤维素钠购于天津市巴斯夫化工有限公司,其他药品均为国产分析纯。(pH 4.6乙酸-乙酸钠缓冲液;0.1 mol·L-1亚硝酸钠溶液;0.07 mol·L-1、pH 8.6 Na2HPO4缓冲液)。
1.1.4 仪器设备MLS-3020型全自动高压灭菌锅;VS-1300U型超净工作台;SPX-250B-Z型生化培养箱;WFZ752型可见紫外分光光度计;YP-502型电子天平。
1.2 试验方法 1.2.1 CR-14菌株的诱变 1.2.1.1 菌悬液的制备将CR-14菌株接于种子培养基,32 ℃、200 r·min-1摇床培养12 h后,用0.9%的生理盐水洗涤2次后,制备成菌悬液,调节菌液浓度约1.0 ×107 cfu·mL-1。
1.2.1.2 亚硝酸诱变吸取1 mL上述菌悬液于9 mL乙酸-乙酸钠缓冲液(pH 4.6)中,然后按1:9的比例与亚硝酸钠溶液(0.1 mol·L-1)混匀,室温放置,每5 min取1 mL菌悬液加入9 mL Na2HPO4(0.07 mol·L-1、pH 8.6)缓冲液中,终止反应,以未经亚硝酸钠处理的菌悬液作为对照。稀释涂布,于30 ℃培养,每个处理3次重复,计算致死率和正突变率[8]。
1.2.1.3 紫外诱变吸取5 mL 1.2.1.1中菌悬液于无菌培养皿中。选用20 W紫外灯,预热30 min后,分别照射0、10、20、30、40、50、60、70、80、90 s,照射距离为30 cm。然后对各个照射时间的菌悬液进行稀释涂布,避光培养,每个处理3次重复,计算致死率以及正突变率。
1.2.1.4 亚硝酸-紫外复合诱变先选取亚硝酸诱变致死率为70%~75%的时间,对CR-14菌株进行处理,再选取紫外诱变致死率为70%~80%的时间,再对其进行紫外线照射处理,然后将处理后的菌悬液进行稀释涂布,每个处理3次重复,计算致死率和正突变率。
1.2.2 菌株的选育 1.2.2.1 初筛将诱变处理的菌株涂布于刚果红平板上,培养2 d后,挑选菌落透明圈与直径比值较大的菌株,接种于半固体穿刺培养基中。
1.2.2.2 复筛将初筛所得菌株和初始菌株CR-14分别接种于种子培养基中,30 ℃、200 r·min-1摇床培养36 h后,接种于发酵培养基中,经30 ℃、200 r·min-1摇床培养60 h后,将其发酵液于4 ℃、8 000 r·min-1离心10 min,然后测定上清液纤维素酶活力,试验设置3次重复[9]。
酶活测定:按照中华人民共和国农业行业标准GB 20287—2006,对菌株发酵液中纤维素酶活力进行测定。将发酵液在 4 ℃、8 000 r·min-1离心 15 min,取上清液,作为粗酶液。取 4 支大试管,1支作空白对照,其余作为3个平行。样品管中加1.0 mL的粗酶液,然后4支试管分别加入4.0 mL已预热至60 ℃的CMC缓冲液,在60 ℃的水浴锅中反应20 min后,立即加入3.0 mL DNS显色剂,摇匀,向对照管中加1.0 mL的粗酶液。4支试管放在沸水浴中显色5 min后立即取出,流水冷却,以空白对照调零点,在 490 nm波长下测定样品管的OD值并记录结果。
酶活力定义:1 mL酶液在一定条件下1 min水解羧甲基纤维素产生1 μg葡萄糖为1个纤维素酶活力单位(U)。
1.2.2.3 突变株遗传稳定性将筛选所得菌株进行连续传种8代,同时测定每代发酵液的纤维素酶活性,检验菌株产酶性状遗传的稳定性,每代实验均设3次重复。
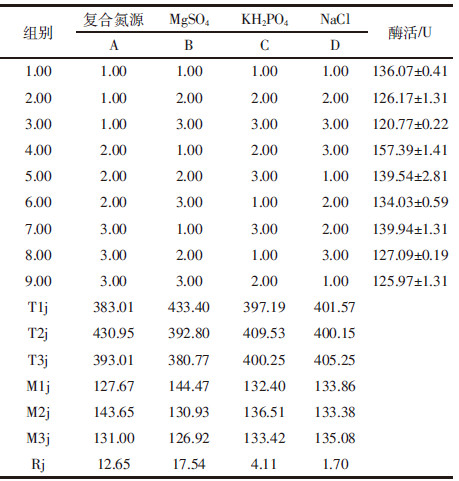
1.2.3 培养基组成优化前期本实验室在适宜工业生产的基础上,已对合适的碳源和氮源做了大量研究,选定1.0%秸秆粉为碳源,0.15%蛋白胨+0.15%豆饼粉为氮源,然后按正交试验表L9(34)对氮源、MgSO4、KH2PO4和NaCl进行4因素3水平试验,同时设计3次重复[10],以确定培养基最佳成分配比,如表 1所示。
 |
由于前期对菌株CR-14的发酵条件进行过大量实验,诱变选育后,Y-UA-18菌株的分类地位没有改变,仍是产黄纤维单胞菌,通过正交实验确定突变菌株培养基主要成分和含量后,采用单因素实验,即可确定温度、时间、通气量以及表面活性剂Tween80等因素对菌株发酵水平的影响。因此为了简单、快捷,这里不再考虑正交实验设计。
1.2.4.1 温度和时间对产酶的影响按5%接种量接种于上述优化的培养基中,分别于 20、25、30、37 ℃摇床培养24 h,每个处理3次重复,测定发酵液中的纤维素酶活。
1.2.4.2 初始pH值对产酶的影响按5%接种量接种于初始 pH值分别为5.0、6.0、7.0、8.0、9.0的培养基中,30 ℃摇床培养72 h,每个处理3次重复,测定发酵液中纤维素酶活。
1.2.4.3 通气量对产酶的影响按5%接种量分别接种于瓶装量为50、100、150 mL三角瓶中,同时按相同的接种量接种于100 mL的厌氧瓶中,充抽氮气6次后灭菌,30 ℃摇床培养72 h,每个处理3次重复,测定发酵液中纤维素酶活。
1.2.4.4 Tween80对产酶的影响按5%接种量分别接种不添加Tween80(空白对照)、添加 0.1%Tween80,瓶装量为150 mL培养基中,30 ℃摇床培养72 h,每个处理3次重复,测定发酵液中纤维素酶活。
1.2.5 数据处理试验数据采用SPSS Statistics 17.0软件,Duncan’s检验进行方差分析。
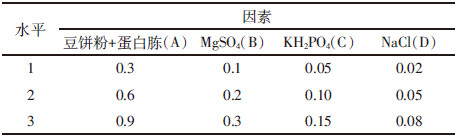
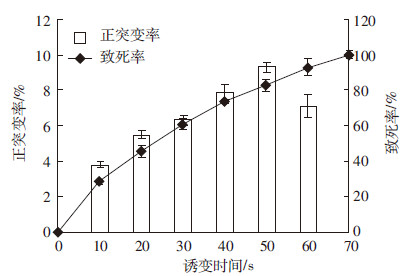
2 结果与讨论 2.1 CR-14菌株的诱变时间确定由图 1、图 2可知,随着亚硝酸诱变和紫外诱变时间的延长,菌株的致死率也随之增高,最终达到100%。菌株的正突变率随时间延长呈现先增加后降低的趋势,在亚硝酸诱变和紫外线诱变的时间分别为15 min、50 s,正突变率达到最高,分别为9.77%、9.25%,此时菌株的致死率也较高,分别为74.71%、82.43%,这与许多研究结果一致,诱变致死率在70%~80%范围内,菌株正突变率最高,便于筛选[11],所以选取这两个时间作为复合诱变的处理时间。

|
| 图 1 亚硝酸诱变 Figure 1 The mutation effect of HNO2 |
|
| 图 2 紫外线诱变 Figure 2 The mutation effect of UV irradiation |
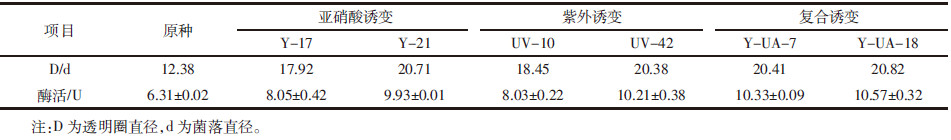
如表 2所示,通过初筛比较透明圈直径/菌落直径的方法,共选育出6株突变株,然后对这6株突变株进行发酵,通过测定发酵液的酶活进行复筛,得到突变株Y-UA-18产酶活力最高达10.57 U,为原菌株CR-14产酶活力的1.67倍。
 |
为测定突变株Y-UA-18的遗传稳定性,对其进行连续传种8代,然后8代同时发酵培养,测定发酵液酶活,通过对8代发酵液酶活进行方差分析,其差异均不显著(P>0.05),如表 3所示,说明菌株的遗传性能稳定,可以作为后续试验菌株。
 |
从表 4中可以看出,各因素对菌株发酵影响的主次顺序为B>A>C>D,即MgSO4对菌株Y-UA-18发酵产酶影响最为显著,这可能由于Mg2+一方面是酶的激活剂,另一方面可以维持蛋白质结构的完整性,因此对菌株的代谢具有促进作用。培养基成分最优配比为B1A2C2D3,即复合氮源0.6%、MgSO4 0.1%、NaCl 0.08%、KH2PO44 0.1%、秸秆粉1.0%。
 |
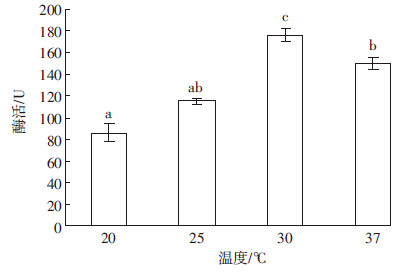
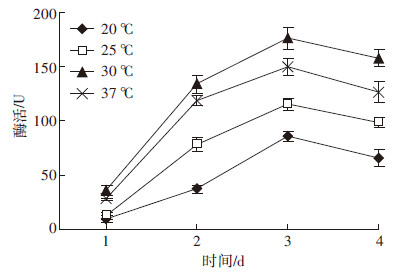
温度对菌株的生长代谢具有很大的影响,所以本试验对菌株在不同温度下进行发酵,并测定酶活,结果如图 3、图 4所示。从图 3中可知,菌株Y-UA-18在30 ℃下发酵液酶活最高为170.29 U,37、25、20 ℃条件下发酵液酶活与之相比显著降低(P < 0.05),分别降低了17.65%、29.66%、46.77%。由图 4可知,不同温度条件下,前3 d时,菌株发酵液酶活随着发酵时间的延长而增强,第3 d时各温度条件下酶活均达到最高,而且发酵温度为30 ℃的酶活始终高于其他温度,最高达170.16 U。第4 d时,酶活开始降低,这可能由于菌株发生老化,从而产酶能力下降。
|
| 图 3 各温度对产酶的影响 Figure 3 Effect of different temperature on producing-cellulase |
|
| 图 4 各温度条件下发酵时间对产酶的影响 Figure 4 Effect of fermentation time on producing-cellulase at different temperature |
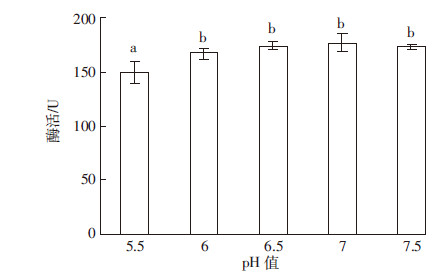
将培养基初始pH值调至为5.5~7.5,考察不同起始pH值对菌株发酵产酶的影响。从图 5中可以看出,初始pH值在6.0~7.5范围内,菌株的酶活差异不显著(P>0.05)。初始pH值为7.0时发酵液的酶活力最高为172.45 U。初始pH值为5.5时,发酵液酶活为148.52 U,显著低于pH 7.0(P<0.05)。这可能由于在酸性条件下,菌株一些代谢的酶受到影响,导致菌株无法进行正常的新陈代谢,从而使发酵液中的酶活降低。
|
| 图 5 初始pH值对产酶的影响 Figure 5 Effect of intial pH value on producing-cellulase |
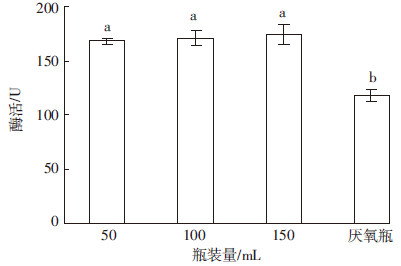
通气量对菌株代谢产酶的影响如图 6所示,将菌株分别接种于不同瓶装量的培养基中,结果表明瓶装量为50、100、150 mL的发酵液酶活没有显著差异(P>0.05),其中150 mL发酵液酶活略高为174.30 U。但在厌氧瓶中发酵液酶活仅为118.49 U,显著低于其他3组(P<0.05)。这可能由于菌株CR-14在厌氧条件下发酵,代谢产酸后,菌株的生长受到抑制进而产酶较低。
|
| 图 6 通气量对产酶的影响 Figure 6 Effect of different ventilation on producing-cellulase |
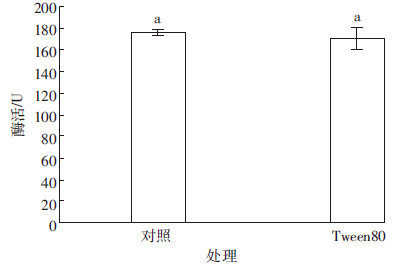
表面活性剂一方面可以改变菌株细胞膜的通透性,有利于代谢产物排出;一方面可以使疏水界面压力降低,提高氧在气液界面的传输速度。由图 7可知,在培养基中添加0.1%的Tween80发酵液酶活为170.38 U,与对照相比没有显著提高(P>0.05),反而比对照的酶活略低。这可能由于添加Tween80浓度较小,菌株的细胞膜的通透性没有受到影响,代谢产物没能及时排出胞外,这需要进一步的试验验证。
|
| 图 7 吐温80对产酶的影响 Figure 7 Effect of Tween 80 on producing-cellulase |
通过对CR-14菌株进行亚硝酸诱变和紫外诱变,筛选出一株产纤维素酶活较高,且能够稳定遗传的菌株Y-UA-18,其纤维素酶活为10.57 U,为原菌株的1.67倍。通过单因素试验和正交试验确定了菌株Y-UA-18产酶最佳培养基成分配比秸秆粉1.0%、复合氮源0.6%、KH2PO44 0.1%、MgSO4 0.1%、NaCl 0.08%和最佳发酵条件初始pH值7.0,培养温度30 ℃,发酵时间3 d,为该菌种的工业化生产奠定基础。
| [1] | 李飞跃, 汪建飞. 中国粮食作物秸秆焚烧排碳量及转化生物炭固碳量的估算[J]. 农业工程学报, 2013, 29(14):1-7. LI Fei-yue, WANG Jian-fei. Estimation of carbon emission from burning and carbon sequestration from biochar producing using crop straw in China[J]. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(14):1-7. (in Chinese) |
| [2] | 焦翔翔, 靳红燕, 王明明. 我国秸秆沼气预处理技术的研究及应用进展[J]. 中国沼气, 2011, 29(1):29-33. JIAO Xiang-xiang, JI Hong-yan, WANG Ming-ming. The research and application advances of straw gas pretreatment technology[J]. Chinese Biogas, 2011, 29(1):29-33. (in Chinese) |
| [3] | Ma L, Zhang J, Zou G, et al. Improvement of cellulase activity in trichoderma reesei by heterologous expression of a Beta-glucosidase gene from penicillium decumbens[J]. Enzyme and Microbial Technology, 2011, 49:366-371. (in Chinese) |
| [4] | 刘振华. 产纤维素酶微生物对低温沼气发酵的影响[D]. 呼和浩特:内蒙古农业大学, 2014. LIU Zhen-hua. The affect of microorganisms producing cellulase for methane fermentation in low temperature[D]. Hohhot:Inner Mongolia Agricultural University, 2014. (in Chinese) |
| [5] | 崔海洋, 程仕伟, 黄田红, 等. 产纤维素酶的解淀粉芽孢杆菌分离鉴定及酶学性质研究[J]. 食品科学技术学报, 2014, 32(3):43-47. CUI Hai-yang, CHENG Shi-wei, HUANG Tian-hong, et al. The separation and identification of Bacillus amyloliquefaciens producing cellulase and the research of characterization[J]. Food Technology of Science, 2014, 32(3):43-47. (in Chinese) |
| [6] | 张丽萍, 李亚冰, 程辉彩, 等. 一株兼性厌氧纤维素酶产生菌的筛选、鉴定及其酶学性质研究[J]. 华北农学报, 2010, 25(6):139-143. ZHANG Li-ping, LI Ya-bing, CHENG Hui-cai, et al. The separation and identification of facultative anaerobic bacteria producing cellulase and the research of characterization[J]. Acta Agriculturae Boreali-Sinica, 2010, 25(6):139-143. (in Chinese) |
| [7] | 唐雪鹭, 崔 春, 雷芬芬, 等. 紫外结合亚硝酸诱变选育中性蛋白酶高产菌株[J]. 食品工业科技, 2015, 7(6):163-166. TANG Xue-lu, CUI Chun, LEI Fen-fen, et al. The breeding of strain producing neutral protease by UV combined nitrite[J]. Food Science & Technology, 2015, 7(6):163-166. (in Chinese) |
| [8] | 单夕文. 产纤维素酶菌株的诱变选育及其产酶条件的研究[D]. 兰州:兰州理工大学, 2014. SHAN Xi-wen. The mutation breeding of strain producing cellulase and the research of conditions for enzyme production[D]. Lanzhou:Lanzhou University of Technology, 2014. (in Chinese) |
| [9] | 中华人民共和国农业部. 中华人民共和国农业行业标准(GB20287-2006)农业微生物菌剂(第一版)[M]. 北京:中国标准出版社, 2006:14-15. Ministry of Agriculture People's Republic of China. People's Republic of China agricultural industry standards(GB 20287-2006)agricultural microbial agents[M]. Beijing:China Standard Press, 2006:14-15. (in Chinese) |
| [10] | 孙旭东, 黄晓梅, 陈秀玲, 等. 产纤维素酶菌株的筛选鉴定及发酵条件优化[J]. 基因组学与应用生物学, 2014, 33(6):1281-1287. SUN Xu-dong, HUANG Xiao-mei, CHEN Xiu-ling, et al. The separation and identification of strains producing cellulase and optimization of fermentation conditions[J]. Genomics and Applied Biology, 2014, 33(6):1281-1287. (in Chinese) |
| [11] | 郑 哲, 贾翠英, 张玉辉. 一株产纤维素酶细菌紫外诱变研究[J]. 生物学杂志, 2011, 28(3):66-69. ZHENG Zhe, JIA Cui-ying, ZHANG Yu-hui. The studies of ultraviolet mutagenesis for a strain of bacteria producing cellulase[J]. Journal of Biology, 2011, 28(3):66-69. (in Chinese) |
 2016, Vol. 33
2016, Vol. 33