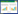文章信息
- 李彦林, 陈吉祥, 周永涛, 杨智, 王永刚, 张继义, 岳靓
- LI Yan-lin, CHEN Ji-xiang, ZHOU Yong-tao, YANG Zhi, WANG Yong-gang, ZHANG Ji-yi, YUE Liang
- 西北半干旱荒漠草原与耕地土壤可培养微生物多样性及分布特征比较
- Diversity and Distribution of Culturable Microbial Communities of Semiarid Desert Steppe and Cultivated Land in Northwestern China
- 农业资源与环境学报, 2016, 33(3): 244-252
- Journal of Agricultural Resources and Environment, 2016, 33(3): 244-252
- http://dx.doi.org/10.13254/j.jare.2015.0257
-
文章历史
- 收稿日期: 2015-10-28
2. 兰州理工大学能源与动力工程学院可再生能源与环境工程系, 甘肃 兰州 730050;
3. 中石油北京天然气管道有限公司, 北京 100101
2. Renewable Energy and Environmental Engineering,College of Energy and Power Engineering, Lanzhou University of Technology, Lanzhou 730050, China;
3. Petrochina Beijing Gas Pipeline Co Ltd, Beijing 100101, China
我国西部地区面积辽阔、土地资源丰富,由于气候变化和人类活动等原因造成的荒漠化现象严重,而大面积土地荒漠化严重阻碍当地农业可持续发展,对生态环境构成极大威胁[1]。荒漠草原是我国西部草原的重要组成部分,属草原区向荒漠区过渡的草原类型,荒漠草原与其他类型草原相比,自然环境恶劣,生态系统脆弱,对人为干扰更为敏感[2]。荒漠草原作为陆地生态系统重要组成部分,是防治沙漠入侵的最后屏障。
微生物是土壤生态系统的重要组成部分,在土壤生态系统物质循环和能量转化中发挥重要作用[3],土壤微生物群落结构变化反映土壤物理化学和生物特性的变化,是土地退化、利用及管理效应的重要指标之一,研究土壤微生物多样性具有重要意义[4, 5, 6]。国外对不同地区荒漠及荒漠草原土壤微生物生态有较多报道,如美国加利福尼亚州南部的因皮里尔河谷沙漠农业土壤、墨西哥北部奇瓦瓦沙漠、智利北部阿塔卡玛沙漠及内盖夫沙漠土壤微生物的多样性研究[7, 8, 9, 10]。吴永胜等[11]发现内蒙古不同退化程度荒漠草地土壤细菌群落结构和土壤细菌类群发生明显变化。代金霞等[12]发现宁夏荒漠草原不同植被类型土壤中以细菌占绝对优势,真菌数量最少,同一土层各种微生物数量随植被类型不同有明显差异,土壤微生物数量垂直动态分布明显。张俊忠等[13]对东祁连山高寒地带不同草地类型土壤真菌、细菌、放线菌数量时空动态进行了研究。高婷等[14]对荒漠草原土壤微生物数量和土壤酶活性进行研究,探讨了土壤微生物与植被类型和放牧强度关系,但有关干旱及半干旱荒漠及荒漠草原土壤微生物多样性,尤其是可培养细菌、放线菌及真菌的组成及群落结构还有待系统和深入研究。
甘肃省中部的白银区位于黄河上游,属于腾格里沙漠和祁连山余脉到黄土高原的过渡地带,属中温带半干旱区向干旱区过渡地带,该区域含大部分荒漠和荒漠草原。有关其土壤微生物生态研究少有报道,本文采用分离培养及16S rDNA序列分析方法研究了白银荒漠草原土壤可培养细菌、放线菌、真菌的主要类群及分布特征,并比较了荒漠草原和耕地土壤微生物多样性,为荒漠草原土壤的演变机制和科学管理提供理论依据。
1 材料与方法 1.1 研究区概况白银位于黄河上游、甘肃省中部,东经103°3′~105°34′和北纬35°33′~37°38′之间,属干旱半干旱性季风气候,年降水量176~498 mm,太阳年均辐射总量130~1 404 cal·cm-2,年日照时数2 500~2 800 h。年平均气温为0~10 ℃,冬夏温差较大。年平均最高气温出现在7月份,为19~20 ℃,最低气温出现在1月份,为-8~7.7 ℃,年际温差30 ℃左右,年均日温差在12.4~13.6 ℃之间。
1.2 土壤样品采集与处理各样地采用混合采样法。样地分别为白银区荒漠草原土壤(104°17′23″E /36°22′47″N)及耕地土壤(104°18′45″E /36°22′41″N)。采样点定位后做土壤垂直剖面,根据植被根系深度,确定采样深度为0~10、10~20、20~30 cm 3个垂直区段。把取好的土样装入灭菌牛皮纸袋内,封好袋口,并记录取样时间和地点。将采集的土样带进实验室于4 ℃保存,在一周内进行试验。
1.3 土壤理化性质测定试验区土壤水分含量测定采用烘干法[15],土壤pH测定利用电位法[16]。
1.4 可培养微生物数量测定称取预处理土样10 g加入到盛有90 mL无菌水的锥形瓶中,振荡20~30 min,使土样中菌体均匀分散,制成10-1稀释度土壤稀释液。再按10倍稀释法制成10-2、10-3、10-4、10-5系列土壤稀释液。取稀释度为10-2、10-3、10-4土壤悬浮液各100 μL,分别接种于琼脂培养基平板,涂布均匀,每个浓度3个重复,30 ℃恒温培养l~4 d,选取1个稀释度统计菌落数,按下列公式计算微生物数量:

细菌鉴定:从Luria-Bertani(LB)琼脂培养基分离单菌落,按《一般细菌常用鉴定方法》[17]和《常见细菌鉴定手册》[18],根据菌落与细胞形态、革兰氏染色、芽孢染色等初步鉴定,再经16S rDNA 序列分析[19, 20]。利用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)及1492R(5′-GGTTACCTTGTTACGA CTT-3′)进行PCR扩增,上海生工生物工程公司测序,NCBI BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)进行分析,通过 CLASTALX 和 MEGA5.1软件构建系统发育树。
放线菌鉴定:从高氏一号琼脂培养基分离单菌落,用插片法和印片法培养,参照《放线菌的分类和鉴定》手册[21],根据菌落形态和细胞形态及分生孢子形态进行分属鉴定。
1.6 主要试剂及仪器主要试剂:DNA提取试剂盒、dNTP、10×PCR Buffer、25 mmol·L-1 MgCl2、Taq DNA 聚合酶等(大连宝生物工程有限公司)。
主要仪器:IS-RDH2恒温振荡器(美国精骐有限公司);Neofuge 15R台式高速冷冻离心机(上海力申科学仪器有限公司);TC-96/G/H基因扩增仪(杭州博日科技有限公司);Tanon-3500凝胶图像处理系统(上海天能科技有限公司);AE-7300水平电泳仪(上海天能科技有限公司)等。
1.7 数据处理实验数据进行3个重复测定,并使用Excel和Origin 8.5软件对数据进行统计分析和处理。其中细菌、放线菌、真菌3类微生物计数的平均结果使用SPSS 19.0软件进行统计分析,采用单因素方差分析检验不同土壤理化性质处理之间的差异(P=0.05)。所有数据均为平均值±标准误差。
2 结果与分析 2.1 不同土壤结构理化指标不同区域土壤含水率、pH及温度如表 1所示。荒漠草原及耕地土壤均偏碱性,而荒漠草原平均pH为7.94,水分含量9.24%。耕地表层土壤水分含量高,为14.73%,pH为7.83。不同土壤深度水分含量、pH有较大差异。荒漠草原表层水分含量极低,为5.63%,耕地表层水分含量略高,但与10~20 cm和20~30 cm差异不显著。
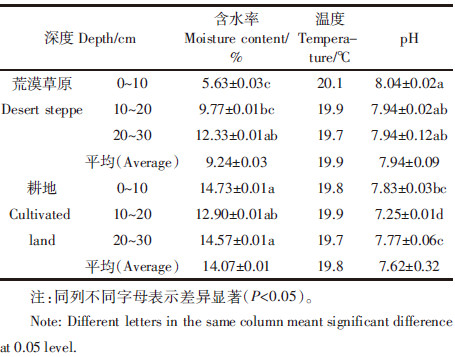
荒漠草原及耕地土壤不同土层可培养微生物数量如表 2所示。荒漠草原可培养细菌、放线菌、真菌数量分别为1.23×106、0.19×106、0.18×106 cfu·g-1,而耕地三类微生物数量分别是3.03×106、0.53×106、0.05×106 cfu·g-1。总体上,荒漠草原与耕地土壤中细菌分别占总菌数的77.0%和84.0%,占绝对优势。放线菌次之,分别占11.7%和15.0%。真菌数量最少,分别占11.3%和1.0%。整体表现为细菌>放线菌>真菌,符合一般土壤微生物三大菌群分布规律,但荒漠草原可培养微生物低于耕地可培养微生物。
 |
不同区域土壤微生物数量具有较明显垂直分布差异,荒漠草原地带0~10 cm土层微生物数量占三层土壤微生物总数的29.0%,10~20 cm土层细菌、放线菌、真菌数量最低,占总数的17.7%,而在20~30 cm的土层数量达到了一个峰值,占53.3%。耕地土壤,细菌、放线菌、霉菌都是在0~10 cm土层分布最多,占三层土壤微生物总数之和的48.3%,而在10~20 cm及20~30 cm的土壤层中分布较少,中层和底层可培养微生物数量差别较小。
荒漠草原和耕地土壤微生物的层化率,结果如表 3所示。耕地总菌数层化比率为2.09;荒漠草原总菌数层化率较低为0.56,各类菌层化率都远低于2。
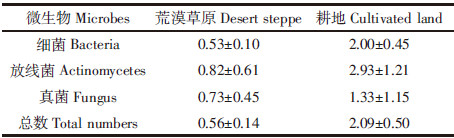
从荒漠草原和耕地土壤共分离了33株细菌,其中荒漠草原14株,耕地19株。对所分离细菌进行了鉴定(表 4)。发现荒漠草原土壤细菌主要为芽孢杆菌属、赖氨酸芽孢杆菌属、土壤芽孢杆菌属、噬冷杆菌属、气球菌属、皮球菌属6个属,优势菌属为芽孢杆菌属和噬冷杆菌属。耕地土壤可培养细菌主要为微杆菌属、节杆菌属、微球菌属、考克氏菌属、芽孢杆菌属、根瘤菌属、中华根瘤菌属、假单胞菌属8个属,其中放线菌门的细菌占57.9%,而优势菌属仍为芽孢杆菌属。表层土壤主要以芽孢杆菌属、气球菌属等好氧菌为主,底层土壤主要以微杆菌属等兼性厌氧菌为主。对这些菌株进行系统发育及多样性分析见图 1和图 2。
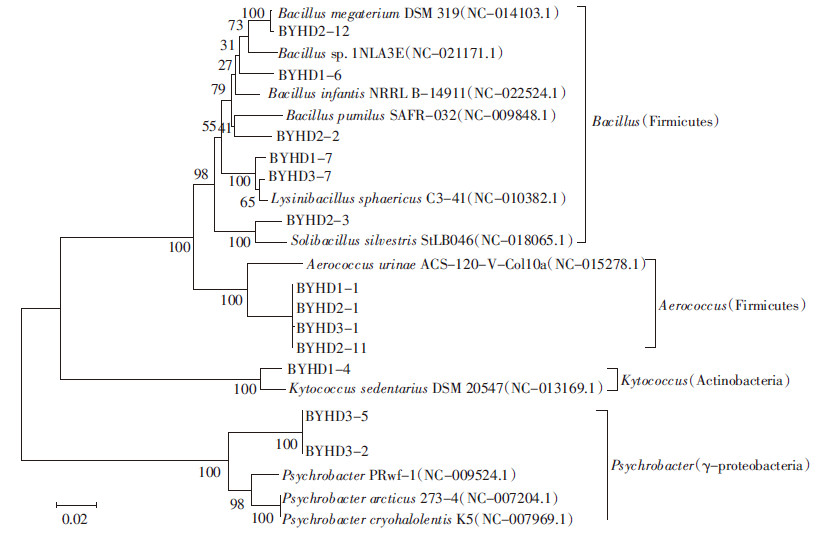
|
| 图 1 荒漠草原土壤细菌群落系统发育树 Figure 1 Phylogenetic tree of bacterial community of desert steppe |

|
| 图 2 耕地土壤细菌群落系统发育树 Figure 2 Phylogenetic tree of bacterial community of cultivated land |
从荒漠草原和耕地土壤分离出放线菌17株,其中荒漠草原8株,耕地9株(表 5)。主要为链霉菌属、小单孢菌属、链轮丝菌属、间孢囊菌属。无论耕地或是荒漠草原,链霉菌属都是优势菌群,其中荒漠草原和耕地链霉菌属分别占50.00%和44.44%。
从荒漠草原和耕地土壤分离出真菌共17株,其中荒漠草原7株,耕地10株(表 6)。荒漠草原真菌类型单一,主要为交链孢霉属,占85.71%,而耕地真菌种类多样性较高,有6个属,主要为青霉属,占30.00%,还有曲霉属、毛霉属、芽枝霉属、链孢霉属、交链孢霉属等。
荒漠草原生态系统脆弱,作为荒漠土壤生态系统的重要组成部分,微生物群落结构的变化反应了土地植被退化及利用等特征,不同地区及不同类型植被土壤微生物数量及类群差异较大。高婷等[14]对宁夏中部干旱带荒漠草原不同植被类型微生物数量检测发现,细菌数量范围在(8.9~45.27)×106个·g-1,放线菌为(10.57~42.57)×104个·g-1,真菌为(3.03~11.73)×103个·g-1。焦迎春等[23]发现青海大通地区耕地和荒地微生物总数分别为1.05×106个·g-1和0.75×106个·g-1。微生物种类以细菌为主,放线菌和真菌次之。吕桂芬等[24]发现内蒙古不同类型荒漠草原土壤的细菌、放线菌、真菌数量范围分别是(1.28~1.64)×106个·g-1、(6.01~9.68)×104个·g-1、(1.73~3.32)×103个·g-1,退化对多数土壤微生物数量没有明显影响。李晨华等[25]研究了准葛尔盆地南缘盐生荒漠与绿洲农田土壤微生物群落组成变化特征,发现荒漠开垦为绿洲后,土壤细菌明显增加,真菌无明显变化,放线菌显著减少。细菌在绿洲农田土壤矿化作用中占主导,真菌则在荒漠中占优势。Qiao 等[26]对新疆地区森林土壤细菌、放线菌、真菌组成与数量做了对比研究。白银地区属于腾格里沙漠和祁连山余脉到黄土高原的过渡地带,通过对白银地区半干旱荒漠草原及耕地土壤可培养微生物数量检测,发现该地区荒漠草原与当地耕地土壤可培养细菌分别为1.23×106 cfu·g-1和3.03×106 cfu·g-1,放线菌为0.19×106 cfu·g-1和0.53×106 cfu·g-1,真菌0.18×106 cfu·g-1和0.05×106 cfu·g-1。荒漠草原与耕地土壤可培养细菌、放线菌、真菌数量符合一般规律,即细菌>放线菌>真菌。荒漠草原细菌和放线菌数量明显低于耕地土壤,而真菌数量却明显高于耕地土壤。
不同区域土壤微生物数量具有较明显垂直分布规律,耕地土壤微生物数量总体上表现出随土层深度加深而减少,而荒漠草原土壤微生物数量却在20~30 cm土层出现一个峰值,这可能是由于荒漠草原长期处于风蚀及日光暴晒,表层水分含量极低5.63%,而耕地表层水分含量较多,有充足空气和光照供微生物呼吸、利用,还可能与土壤表层植物覆盖率和植物根系分布有关,或者与当地植物种类相关,凋落植物和根系为微生物生长繁殖提供了较为充足营养物质[27, 28]。土壤微生物垂直分布与土壤养分存在着一定的关系,土壤养分含量随土壤深度表现出的层化现象在许多自然生态系统中十分普遍。李涛等[29]提出土壤微生物数量随土壤深度呈层化分布,将这种层化现象以比例形式表示出来,即表层土壤所含的微生物数量与底层土壤所含的微生物数量的比值,称为土壤微生物层化比率。比率明显小于2或者异常的高,说明土壤存在退化现象,比率大于2或在2附近说明土壤状况比较良好。白银地区耕地总菌数的层化比率为2.09,荒漠草原总菌数的层化率仅为0.56,各类菌层化率都远低于2,说明荒漠草原生态条件极端脆弱,缺乏稳定性,土壤严重退化。
通过分离培养及16S rDNA序列分析比较了荒漠草原与耕地土壤可培养细菌类群多样性。发现荒漠草原可培养细菌主要来源于厚壁菌门、γ-变形菌纲、放线菌门,其中厚壁菌门细菌4个属,占71.43%,优势菌属为芽孢杆菌属。耕地可培养细菌主要来源于放线菌门、厚壁菌门、ɑ-变形菌纲、γ-变形菌纲,与荒漠草原相比多样性明显增加,其中放线菌门的细菌占57.89%,而优势菌属仍为芽孢杆菌属,这与他人研究结果相似。Kim等[7]研究表明,美国加利福尼亚州南部的因皮里尔河谷沙漠农业土壤微生物主要由ɑ-变形菌纲,浮霉菌门(Planctomycetes)和放线菌门构成。Jiang等[30]认为我国东北部科尔沁沙地土壤细菌群落主要由ɑ-变形菌纲、γ-变形菌纲、芽单孢菌门(Gemmatimonas)、绿弯菌门(Chloroflex)构成;高婷等[14]研究发现宁夏干旱区灰钙土荒漠草原土壤可培养细菌主要属于厚壁菌门、放线菌门、ɑ-变形菌纲、β-变形菌纲、γ-变形菌纲、拟杆菌门(Bacteroides),其中γ-变形菌纲的细菌占优势。安红丽[31]从新疆荒漠地区不同类型土样品中共分离纯化了400多株细菌,分属于5个门、37个科和53个属,优势菌株属于放线菌门,其次为变形杆菌门。Liu等[32]发现新疆古尔班通古特沙漠土壤微生物的群落主要为放线菌门和变形菌纲,尤其是ɑ-变形菌纲。值得注意的是我们发现白银荒漠草原土壤中γ-变形菌纲的噬冷杆菌属较多,而在耕地土壤中没有发现这种菌属。荒漠草原放线菌门分布在表层,厚壁菌门在不同的土层都有出现,变形菌门的细菌主要分布在较深层。而在耕地土壤中厚壁菌门的细菌表层分布较多,变形菌门和放线菌门分布在不同土层。另外,从荒漠草原分离的14株细菌中,有13株的16S rDNA序列与已知细菌的相似性小于97%,占总数的92.84%,有8株细菌的相似性小于94%。一般认为16S rDNA 相似度达90%~91%可定义为同科,相似度达 95%~96%可以定位同属,相似度达97%~99%的菌株属于不同种[33]。说明荒漠草原微生物未知的多样性,它们可能是潜在的新分类单元。而在耕地土壤分离菌株中只有6株细菌的16S rDNA序列与已知细菌的相似性小于96%~97%。
从荒漠草原和耕地分离的放线菌主要为链霉菌属、小单孢菌属、链轮丝菌属、间孢囊菌属,无论耕地或是荒漠草原链霉菌属都是优势菌群,其中荒漠草原链霉菌属占50.00%,耕地土壤44.44%,没有明显差别。荒漠草原真菌类型单一,主要为交链孢霉属,占85.71%,而耕地真菌种类多样,有6个属,主要为青霉属,占总菌属的30.00%。高婷等[14]发现宁夏干旱区灰钙土荒漠草原土壤放线菌有9个属,包括链霉菌属、链轮丝菌属、小单孢菌属、游动放线菌属、游动单孢菌属、间孢囊菌属、北里孢菌属、螺孢菌属、链孢囊菌属。真菌有7个属,分别为青霉属、曲霉属、头孢霉属、镰孢霉属、芽枝霉属、交链孢霉属、毛霉属,其中紧沙土植被类型中真菌种类只有青霉属。
4 结论西北半干旱荒漠草原土壤微生物总数量远低于耕地,但土壤三大类菌群始终符合一般规律:细菌>放线菌>真菌;从荒漠草原土壤中分离出来的细菌种类少于耕地,而且菌群明显异于耕地土壤,尤其是嗜冷杆菌属在耕地中没有发现。荒漠草原分离出来的放线菌种类多于耕地,真菌种类单一,大部分为交链孢霉属,只有少数芽枝霉属。不同质地的土壤微生物数量有明显的垂直分布差异,而且不同质地土壤微生物层化比率不同,说明荒漠草原土壤质量差,需采取一定措施进行改善。本文对荒漠草原与耕地土壤微生物的对比调查结果为更好保护生态环境提供了理论基础。
| [1] | 慈龙骏. 极端干旱荒漠的""荒漠化""[J]. 科学通报, 2011, 56(31):2621-2626. CI Long-jun. Desertification of extra-arid deserts[J]. Chinese Science Bulletin, 2011, 56(31):2621-2626. (in Chinese) |
| [2] | 李德新. 短花针茅荒漠草原动态规律及其生态稳定性[J]. 中国草地学报, 1990(4):1-5. LI De-xin. Dynamics and ecological stability of form stipa breviflora desert steppe[J]. Chinese Journal of Grassland, 1990(4):1-5. (in Chinese) |
| [3] | 徐 雄, 张 健, 张 猛, 等. 果-草人工生态系统中土壤微生物、土壤酶与土壤养分的关系[J]. 水土保持学报, 2005, 19(6):178-181. XU Xiong, ZHANG Jian, ZHANG Meng, et al. Relationship between biological factors and soil nutrients in artificial fruit-grass ecosystem[J]. Journal of Soil and Water Conservation, 2005, 19(6):178-181. (in Chinese) |
| [4] | Harris A J. Measurements of the soil microbial community for estimating the success of restoration[J]. Journal of Soil Science, 2003, 54(4):801-808. |
| [5] | Heijen M G A, Wagg C. Soil microbial diversity and agro-ecosystem functioning[J]. Plant Soil, 2013, 363(1-2):1-5. |
| [6] | Kennedy A C, Smith K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant and Soil, 1995, 170(1):75-86. |
| [7] | Kim J S, Dungan R S, Crowley D. Microarray analysis of bacterial diversity and distribution in aggregates from a desert agricultural soil[J]. Biology and Fertility of Soils, 2008, 44(8):1003-1011. |
| [8] | Liu X, Lindemann W C, Whitford W G, et al. Microbial diversity and activity of disturbed soil in the northern Chihuahuan Desert[J]. Biology and Fertility of Soils, 2000, 32(3):243-249. |
| [9] | Neilson J W, Quade J, Ortiz M, et al. Life at the hyperarid margin:Novel bacterial diversity in arid soils of the Atacama Desert, Chile[J]. Extremophiles, 2012, 16(3):553-566. |
| [10] | Saul-Tcherkas V, Unc A, Steinberger Y. Soil microbial diversity in the vicinity of desert shrubs[J]. Microb Ecol, 2013, 65(3):689-699. |
| [11] | 吴永胜, 马万里, 李 浩, 等. 内蒙古退化荒漠草原土壤细菌群落结构特征[J]. 生态学报, 2010, 30(23):6355-6362. WU Yong-sheng, MA Wan-li, LI Hao, et al. Characteristics of bacterial community structure in degraded desert steppe of Inner Mongolia[J]. Acta Ecological Sinica, 2010, 30(23):6355-6362. (in Chinese) |
| [12] | 代金霞, 赵 辉. 宁夏荒漠草原固沙植物群落土壤微生物数量及土壤酶活性研究[J]. 江苏农业科学, 2011, 39(4):460-462. DAI Jin-xia, ZHAO Hui. Study on soil microorganism quantity and soil enzyme activity of desert grassland sand-fixation plant community in "Ningxia[J]. Jiangsu Agricultural Sciences, 2011, 39(4):460-462. (in Chinese) |
| [13] | 张俊忠, 陈秀蓉, 杨成德, 等. 东祁连山高寒草地土壤微生物三大类群的时空动态特征[J]. 水土保持学报, 2008, 22(5):167-171. ZHANG Jun-zhong, CHEN Xiu-rong, YANG Cheng-de, et al. Spatiotemporal and characteristic of the soil microbial of Alpine Grassland in eastern Qilian Mountains[J]. Journal of Soil and Water Conservation, 2008, 22(5):167-171. (in Chinese) |
| [14] | 高 婷, 张源沛. 荒漠草原土壤微生物数量与土壤及植被分布类型的关系[J]. 草业科学, 2006, 23(12):22-25. GAO Ting, ZHANG Yuan-pei. Study on the relationship between edaphon amount and distributing type of vegetation and soil in desert grassland[J]. Pratacultural Science, 2006, 23(12):22-25. (in Chinese) |
| [15] | 王洪涛, 金研铭, 马丽华, 等. 不同复层次群落下土壤理化性质分析[J]. 安徽农业科学, 2011, 39(13):7661-7662. WANG Hong-tao, JIN Yan-ming, MA Li-hua, et al. Analysis on soil physical and chemical properties of multiple level community[J]. Journal of Anhui Agricultural Sciences, 2011, 39(13):7661-7662. (in Chinese) |
| [16] | 张成娥, 杜社妮, 白岗栓, 等. 黄土源区果园套种对土壤微生物及酶活性的影响[J]. 土壤与环境, 2001, 10(2):121-123. ZHANG Cheng-e, DU She-ni, BAI Gang-shuan, et al. Influence of intercropping in the garden on soil microbe and enzymatic activity in highland of loess Plateau[J]. Soil and Environmental Sciences, 2001, 10(2):121-123. (in Chinese) |
| [17] | 中国科学院微生物研究所. 一般细菌常用鉴定方法[M]. 北京:科技出版社, 1978. Institute of Microbiology Chinese Academy of Sciences. The identification method of general bacteria[M]. Beijing:Science Press, 1978. (in Chinese) |
| [18] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001. DONG Xiu-zhu, CAI Miao-ying. Common bacteria system identification manual[M]. Beijing:Science Press, 2001. (in Chinese) |
| [19] | Von W F, Bocker S, Schloteburg C, et al. Basic-specific fragmentation of amplified 16S rRNA genes analyzed by mass spectrometry:A tool for rapid bacterial identification[J]. PNAS, 2002, 99(10):7039-7044. |
| [20] | George M G, William B W, Aidan C P. Bergey's manual of systemaic bacteriology[M]. New York:Springer-Verlag, 2005. |
| [21] | 阎逊初. 放线菌的分类与鉴定[M]. 北京:科学出版社, 1992. YAN Xun-chu. Taxonomy and identification of actinomycetes[M]. Beijing:Science Press, 1992. (in Chinese) |
| [22] | 魏景超. 真菌鉴定手册[M]. 上海:上海科技出版社, 1979. WEI Jing-chao. Manual of fungal identification[M]. Shanghai:Shanghai Science and Technology Press, 1979. (in Chinese) |
| [23] | 焦迎春, 卢素锦. 青海大通周边地区不同土壤结构微生物种群研究[J]. 北方园艺, 2013(8):178-180. JIAO Ying-chun, LU Su-jin. Study on microbial population in different soil structures in surrounding areas of Datong of Qinhai[J]. Northern Horticulture, 2013(8):178-180. (in Chinese) |
| [24] | 吕桂芬, 吴永胜, 李 浩, 等. 荒漠草原不同退化阶段土壤微生物、土壤养分及酶活性的研究[J]. 中国沙漠, 2010, 30(1):104-109. LÜ Gui-fen, WU Yong-sheng, LI Hao, et al. Microorganisms, soil nutrient and enzyme activity changing with the proceeding of desert steppe degradation in Inner Mongolia[J]. Journal of Desert Research, 2010, 30(1):104-109. (in Chinese) |
| [25] | 李晨华, 李 彦, 谢静霞, 等. 荒漠-绿洲土壤微生物群落组成与其活性对比[J]. 生态学报, 2007, 27(8):3391-3399. LI Chen-hua, LI Yan, XIE Jing-xia, et al. Comparative on microbial community composition and microbial activities in desert and oasis soils[J]. Acta Ecological Sinica, 2007, 27(8):3391-3399. (in Chinese) |
| [26] | Qiao H L, Tian C M, Luo Y Q, et al. Diversity of soil microorganisms in natural Populus euphratica forests in Xinjiang, northwestern China[J]. Frontiers of Forestry in China, 2008, 3(3):347-351. |
| [27] | 高雪峰, 张 功, 卢 萍. 内蒙古荒漠草原土壤微生物的分布特征及季节动态变化研究[J]. 内蒙古师范大学学报, 2007, 36(4):484-487. GAO Xue-feng, ZHANG Gong, LU Ping. Research on dynamic changes with seasons and distribution of soil microorganisms in Stipabreviflora Desert Steppe of Inner Mongolia[J]. Journal of Inner Mongolia Normal University, 2007, 36(4):484-487. (in Chinese) |
| [28] | 张桂玲, 胡文革, 庄 丽, 等. 荒漠土壤植被改造过程中土壤微生物区系研究[J]. 北方园艺, 2010(7):1-5. ZHANG Gui-ling, HU Wen-ge, ZHUANG Li, et al. Study on soil microflora in the composting process of desert reformation[J]. Northern Horticulture, 2010(7):1-5. (in Chinese) |
| [29] | 李 涛, 潘志华, 安萍莉, 等. 北方农牧交错带(武川县)土壤微生物数量分布及层化比率研究[J]. 水土保持学报, 2006, 20(1):99-102. LI Tao, PAN Zhi-hua, AN Ping-li, et al. Distribution character of soil microbial numbers and soil microbial stratification ratio at crossing belt. (Wuchuan County) of agriculture and animal husbandry[J]. Journal of Soil and Water Conservation, 2006, 20(1):99-102. (in Chinese) |
| [30] | Jiang D M, Cao C Y, Zhang Y, et al. Plantations of native shrub species restore soil microbial diversity in the Horqin Sandy Land, northeastern China[J]. J Arid Land, 2014, 6(4):445-453. |
| [31] | 安红丽. 新疆荒漠地区可培养细菌的多样性及四个潜在新种的多相分类学研究[D]. 武汉:武汉大学, 2010. AN Hong-li. Study on diversity of culturable bacteria in Xinjiang Desert and polyphasic taxonomy study of four novel species[D]. Wuhan:Wuhan University, 2010. (in Chinese) |
| [32] | Liu R Y, Li K, Zhang H X, et al. Spatial distribution of microbial communities associated with dune landform in the Gurbantunggut Desert, China[J]. Journal of Microbiology, 2014, 52(11):898-907. |
| [33] | Staekebrandt E, Goebel B M. Taxonomic note:A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. International Journal of Systematic and Bacteriology, 1994, 44(4):846-849. |
 2016, Vol. 33
2016, Vol. 33