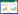文章信息
- 晏静, 张瑞海, 宋振, 张国良, 刘玉升, 付卫东
- YAN Jing, ZHANG Rui-hai, SONG Zhen, ZHANG Guo-liang, LIU Yu-sheng, FU Wei-dong
- 黄顶菊(Flaveria bidentis)凋落物对土壤无脊椎动物群落的影响
- Impact of Flaveria bidentis Litter on Communities of Invertebrates in Soil in Different Habitats
- 农业资源与环境学报, 2016, 33(2): 182-193
- Journal of Agricultural Resources and Environment, 2016, 33(2): 182-193
- http://dx.doi.org/10.13254/j.jare.2015.0245
-
文章历史
- 收稿日期: 2015-10-14
2. 山东农业大学植物保护学院, 山东 泰安 271018
2. College of Plant Protection, Shandong Agricultural University, Tai'an 271018, China
黄顶菊(Flaveria bidentis)属菊科(Asteraceae),黄菊属(Flaveria),原产于南美洲,2001年在我国天津南开大学与河北衡水相继发现,现已扩散蔓延至河北省邯郸、邢台等56个县(市、区)、河南、山东及天津部分地区[1, 2]。黄顶菊植株能迅速占领有利空间,导致农作物减产,降低生物多样性,种子小且种子量极多,易传播蔓延。黄顶菊入侵可以改变土壤养分和土壤酶活性,改变入侵地的土壤状况,形成有利于其入侵的环境,并借此增强其竞争能力,抑制其他生物的生长,实现种群的进一步扩张[3, 4]。
土壤动物是土壤养分的制造者并参与自然界中的物质循环,自然界中物质循环的原动力主要来源于众多的土壤生物,其不但促进植物的生长,还加速土壤的发育,是土壤质量的指标[5, 6]。土壤动物影响凋落物的分解,而凋落物分解是生态系统物质循环和能量转换的主要途径,通过凋落物的分解逐步把养分归还给土壤,因而凋落物的分解过程和速率对土壤肥力有重要影响[7, 8]。植物凋落物分解与生态系统过程之间有着密切的联系,在凋落物分解过程中,土壤动物群落结构发生变化,凋落物类型或组成、数量与质量都会对土壤动物产生影响[9, 10]。刘宁等[11]研究了黄顶菊对地表土壤动物群落的影响,但并未就黄顶菊凋落物对土壤动物群落结构的影响进行探讨。本文以黄顶菊为研究对象,采用生物多样性评价方法分析黄顶菊入侵林地、荒地与沟渠等3种生境后的土壤无脊椎动物群落结构变化,综合评价黄顶菊入侵后的生态效应,为防治黄顶菊提供理论依据。
1 材料与方法 1.1 研究区域概况巨鹿县隶属河北省邢台市,属暖温带季风区中的大陆性气候。年平均气温13 ℃,1月平均气温-3.9 ℃,极端最低气温-23.0 ℃;7月平均气温28.8 ℃,极端最高气温42.7 ℃。生长期年平均206 d,无霜期年平均192 d,11月至来年4月上旬为霜冻期。年平均降水量585 mm,多集中在7、8月,年日照2 738 h,雨热同期,光照充足。土壤类型以潮土类为主,该地区黄顶菊发生早且危害严重[11]。
1.2 生境选取3种生境的基本状况见表 1。
每个入侵生境中设置处理组与对照组,每个处理5个小区,小区大小6 m×6 m,相邻小区间隔10 m,小区分布采用随机排列。
1.4 取样进行五点取样,每种生境50个样点,总计150个样点。为防止土壤动物逃逸,利用环刀(直径20 cm,高10 cm)分3层取样[6, 12, 13]:未分解层(叶片较为完整,尚未分解,破损不超过20%)、半分解层(叶片呈半分解状态,破损严重,该层没有无机质土壤混入)以及0~2 cm表层腐殖土,分别记作A、B、C。将采集的样品装入自封袋,标记后带回。取样时间为2014年10月23日。
1.5 样品处理用Tullgren法分离中小型土壤节肢动物[14]。土壤节肢动物标本分类鉴定依据《中国土壤动物检索图鉴》[15]和《昆虫分类检索》[16]。
将取回的的凋落物于80 ℃烘干至恒重后,粉碎过100目筛,测定有机碳、全氮、全磷、全钾含量。将带回的土壤样品风干后,过100目筛,测定有机质、全氮、全磷、全钾含量。有机质测定采用重铬酸钾法,全氮测定采用半微量开氏法,全磷测定采用NaOH碱熔钼锑抗比色法,全钾测定采用NaOH熔融法[17]。
1.6 数据处理在土壤无脊椎动物调查中,将每个生境中同一小区内5个样点合并为一个样本。10%以上为优势类群,1%~10%为常见类群,1%以下为稀有类群[18]。节肢动物群落多样性指标:
丰富度(Species richness):指一个群落或环境中物种数目的多寡,亦表示生物群聚(或样品)中种类丰富度程度的指数。本研究中以土壤无脊椎动物类群数表示。
香农威纳多样性指数(Shannon-Wiener diversity index):H′=-∑pilnpi式中,Pi=Ni/N,Ni为第i类群的个体数,N为群落总个体数。
辛普森多样性指数(Simpson-Yule index):D=1/∑pi2,式中pi同上。
均匀度指数(Pieloueveness index):E= H′/lnS式中,H′为Shannon-Wiener多样性指数,S为丰富度。
运用多重方差分析(ANOVA)比较同一处理不同层的土壤无脊椎动物群落多样性,基于独立样本t检验(T-test)分析比较不同处理同一层土壤无脊椎动物群落多样性,运用典范对应分析环境因子与土壤无脊椎动物群落的相关性。其中多重方差分析和t检验使用SPSS 17.0软件,典范对应分析使用国际标准通用软件Canoco 4.5 软件包[19]完成。
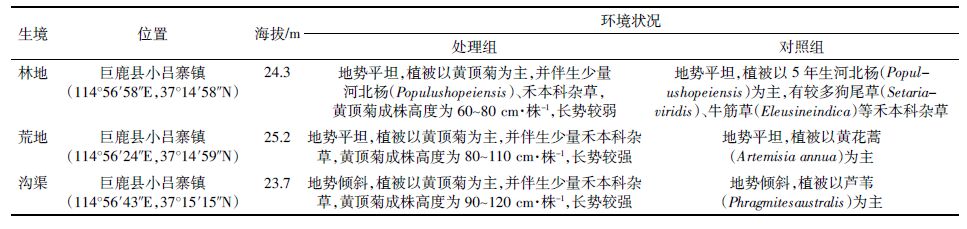
2 结果与分析 2.1 林地生境土壤无脊椎动物群落结构研究 2.1.1 林地生境土壤无脊椎动物群落组成及多样性林地生境共捕获地表土壤无脊椎动物34 268头,隶属2门7纲15目(表 2)。处理组捕获16 304头,占总捕获量的47.58%;对照组捕获17 964头,占总捕获量的52.42%。优势类群是蜱螨目(83.23%)和弹尾目(13.31%),常见类群是啮虫目(2.21%),其他类群相对多度较小。从处理组与对照组的土壤无脊椎动物群落结构看,蜱螨目均为优势类群,啮虫目均为常见类群,处理组中弹尾目为优势类群(17.25%),而对照组中弹尾目为常见类群(9.74%)。
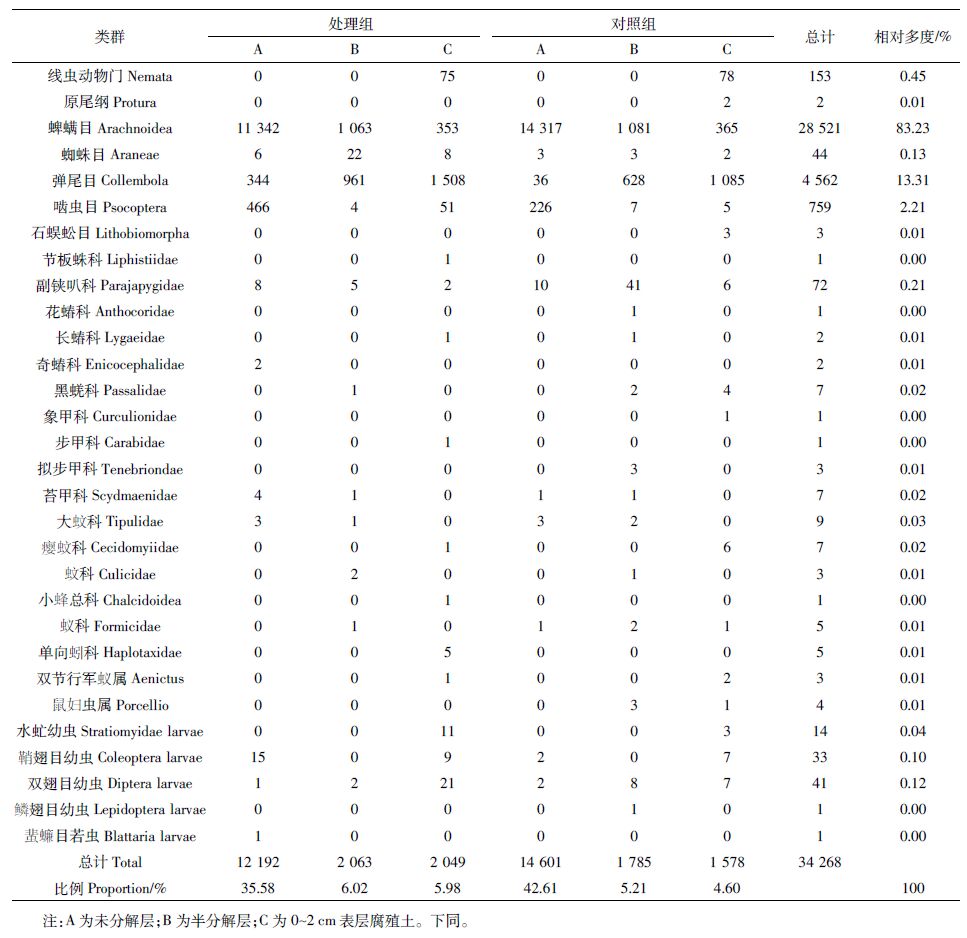
林地生境中土壤无脊椎动物多样性见表 3。处理组与对照组的多样性指标各层比较分别可知,处理组的丰富度、香农威纳多样性指数、辛普森多样性指数略高于对照组,差异不显著;处理组半分解层均匀度指数显著高于对照组半分解层(P=0.010)。此结果表明,黄顶菊入侵林地生境后,凋落物未分解层、半分解层、表层腐殖土中的土壤无脊椎动物多样性均有升高,且半分解层差异显著。
处理组3层的多样性指标进行比较可知,表层腐殖土的丰富度显著高于未分解层(P=0.043)、半分解层(P=0.003),表层腐殖土、半分解层的香农威纳多样性指数(P=0.04,P=0.006)、辛普森多样性指数(P=0.023,P=0.04)、均匀度指数(P=0.021,P=0.03)均显著高于未分解层。此结果表明,土壤无脊椎动物在黄顶菊凋落物及表层腐殖土中自上往下多样性升高。
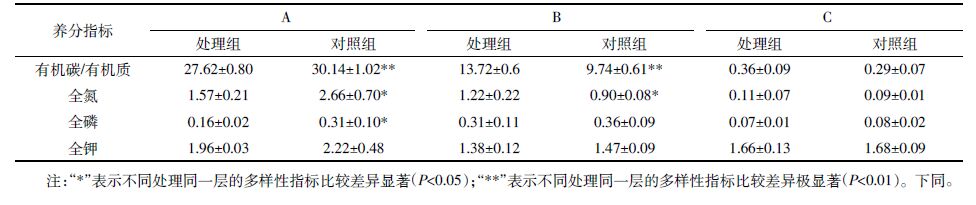
2.1.2 典范对应分析林地生境凋落物与表层腐殖土主要养分指标见表 4。未分解层对照组的有机碳、全氮、全磷显著高于处理组(P=0.003、P=0.010、P=0.015),半分解层处理组的有机碳、全氮显著高于对照组(P=0.000、P=0.015),表层腐殖土处理组的有机质、全氮略高于对照组,全磷、全钾略低于对照组,差异均不显著。说明黄顶菊凋落物未分解层养分指标低于对照植物,半分解层的养分指标有所提高,且黄顶菊入侵林地生境后提高了表层腐殖土的有机质、全氮含量。
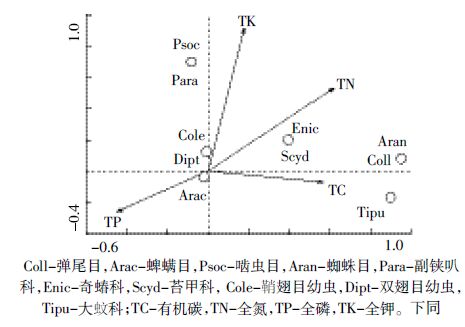
采用典范对应分析方法,研究黄顶菊林地生境中凋落物未分解层主要养分指标与土壤无脊椎动物类群的相关性。如图 1所示,前两轴分别能解释数据变异的65.1%和27.5%,第一轴与全氮有较强的相关性(相关系数为0.713),第二轴与全钾有较强的相关性(相关系数为0.873),全磷对类群分布的影响较大(P=0.002)。弹尾目、蜘蛛目、奇蝽科、苔甲科位于全磷箭头的负方向上,说明未分解层中凋落物全磷含量越低,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊未分解层中凋落物全磷含量较低,上述土壤无脊椎动物多样性升高。
|
| Coll-弹尾目,Arac-蜱螨目,Psoc-啮虫目,Aran-蜘蛛目,Para-副铗叭 科,Enic-奇蝽科,Scyd-苔甲科,Cole-鞘翅目幼虫,Dipt-双翅目幼虫, Tipu-大蚊科;TC-有机碳,TN-全氮,TP-全磷,TK-全钾。下同 图 1 林地生境凋落物未分解层典范对应分析结果 Figure 1 Canonical correspondence analysis result of undecomposed litter layer in forestland habitat |
采用典范对应分析方法,研究黄顶菊林地生境中凋落物半分解层主要养分指标与土壤无脊椎动物类群的相关性。如图 2所示,前两轴分别能解释数据变异的83.0%和10.8%,第一轴与全磷、全钾、全氮有较强的相关性(相关系数分别为-0.978、0.927、0.917),全磷对类群分布的影响较大(P=0.002)。弹尾目、蜘蛛目位于全磷箭头的负方向上,说明半分解层中凋落物全磷含量越低,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊半分解层中凋落物全磷含量较低,上述土壤无脊椎动物多样性升高。

|
| Anth-花蝽科,Lyga-长蝽科,Pass-黑蜣科, Culi-蚊科,Form-蚁科。下同 图 2 林地生境凋落物半分解层典范对应分析结果 Figure 2 Canonical correspondence analysis result of semidecomposed layer in forestland habitat |
采用典范对应分析方法,研究黄顶菊林地生境中土壤无脊椎动物类群与表层腐殖土主要养分指标的相关性。如图 3所示,前两轴分别能解释数据变异的49.3%和20.4%,第一轴与有机质有较强的相关性(相关系数为0.787),第二轴与全氮有较强的相关性(相关系数为0.709),全磷对类群分布的影响较大(P=0.002)。弹尾目、啮虫目、水虻幼虫、双翅目幼虫位于全磷箭头的负方向上,说明表层腐殖土中全磷含量越低,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊的入侵降低了表层腐殖土全磷含量,从而使上述土壤无脊椎动物多样性升高。

|
| Nema-线虫,Prot-原尾纲,Lith-石蜈蚣目,Cara-步甲科, Chal-小蜂总科,Stra-水虻幼虫,OM-有机质。下同 图 3 林地生境表层腐殖土典范对应分析结果 Figure 3 Canonical correspondence analysis result of humus in forestland habitat |
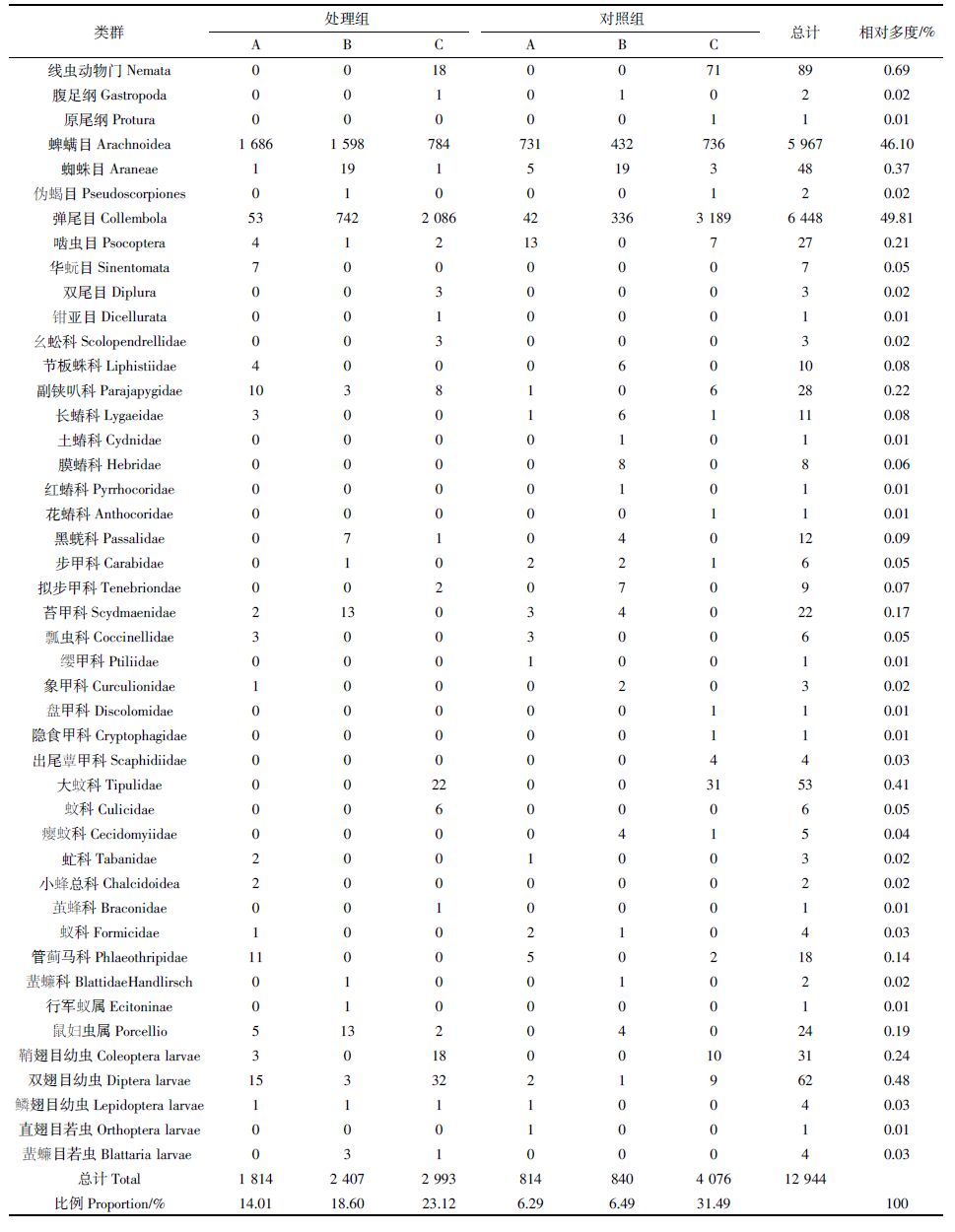
荒地生境共捕获土壤无脊椎动物12 944头,隶属2门9纲16目(表 5)。处理组捕获7 214头,占总捕获量的55.73%,对照组捕获5 370头,占总捕获量的44.27%。优势类群是蜱螨目(46.10%)和弹尾目(49.81%),其他类群相对多度较小。从处理组与对照组的土壤无脊椎动物群落结构看,蜱螨目、弹尾目均为优势类群,对照组中线虫为常见类群(1.24%),而处理组中线虫为稀有类群(0.25%)。
 |
荒地生境中土壤无脊椎动物多样性见表 6。处理组与对照组的多样性指标各层比较分别可知,处理组3层的丰富度、香农威纳多样性指数、辛普森多样性指数略高于对照组,差异不显著。此结果表明,黄顶菊入侵荒地生境后,未分解层、半分解层、表层腐殖土中的土壤无脊椎动物多样性并未下降,反而略有升高。
处理组3层的多样性指标对比可知,半分解层、表层腐殖土的丰富度、香农威纳多样性指数、辛普森多样性指数、均匀度指数略高于未分解层,差异不显著。此结果表明,土壤无脊椎动物在黄顶菊凋落物层与表层腐殖土中自上往下多样性升高。
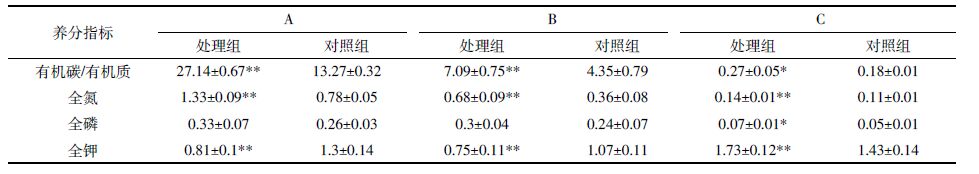
2.2.2 典范对应分析荒地生境凋落物与表层腐殖土主要养分指标见表 7。未分解层处理组的有机碳、全钾显著高于对照组(P=0.002、P=0.004),半分解层处理组的全钾显著高于对照组(P=0.004),表层腐殖土处理组的全氮、全磷显著高于对照组(P=0.002、P=0.039)。说明黄顶菊凋落物主要养分指标大部分高于对照植物,黄顶菊入侵荒地生境后,提高了表层腐殖土的主要养分含量,全钾含量略有下降。
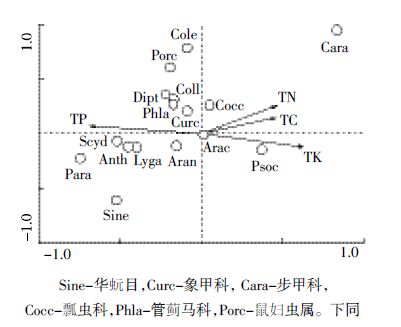
如图 4所示,前两轴分别能解释数据变异的57.8%和30.7%,第一轴与全磷有较强的相关性(相关系数为-0.721),全磷对类群分布的影响较大(P=0.002)。弹尾目、象甲科、管蓟马科、鼠妇虫属、鞘翅目幼虫、双翅目幼虫位于全磷箭头的正方向上,说明未分解层中凋落物全磷含量越高,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊未分解层凋落物全磷含量较高,上述土壤无脊椎动物多样性升高。
|
| Sine-华蚖目,Curc-象甲科,Cara-步甲科, Cocc-瓢虫科,Phla-管蓟马科,Porc-鼠妇虫属。下同 图 4 荒地生境未分解层典范对应分析结果 Figure 4 Canonical correspondence analysis result of undecomposed litter layer in uncultivated land habitat |
如图 5所示,前两轴分别能解释数据变异的39.8%和24.9%,第一轴与有机碳、全氮有较强的相关性(相关系数分别为0.803、-0.747),第二轴与全钾有较强的相关性(相关系数为-0.736),有机碳对类群分布的影响较大(P=0.002)。弹尾目、副铗叭科、苔甲科、双翅目幼虫、蜚蠊目若虫位于有机碳箭头的反方向上,说明半分解层中凋落物有机碳含量越低,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊半分解层凋落物有机碳含量较低,上述土壤无脊椎动物多样性升高。
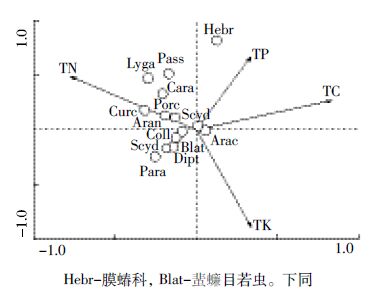
|
| Hebr-膜蝽科,Blat-蜚蠊目若虫。下同 图 5 荒地生境半分解层典范对应分析结果 Figure 5 Canonical correspondence analysis result of semi-decomposed layer in uncultivated land habitat |
如图 6所示,前两轴分别能解释数据变异的63.3%和15.5%,第二轴与全氮、全钾有较强的相关性(相关系数分别为-0.611、-0.764),全钾对类群分布的影响较大(P=0.004)。腹足纲、幺蚣科、蚊科、鞘翅目幼虫位于全钾箭头的负方向上,说明表层腐殖土中全钾含量越低,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊的入侵降低了表层腐殖土全钾含量,从而使上述土壤无脊椎动物多样性升高。

|
| Gast-腹足纲,Dipl-双尾目,Scol-幺蚣科,Scap-出尾蕈甲科。下同 图 6 荒地生境表层腐殖土典范对应分析结果 Figure 6 Canonical correspondence analysis result of humus in uncultivated habitat |
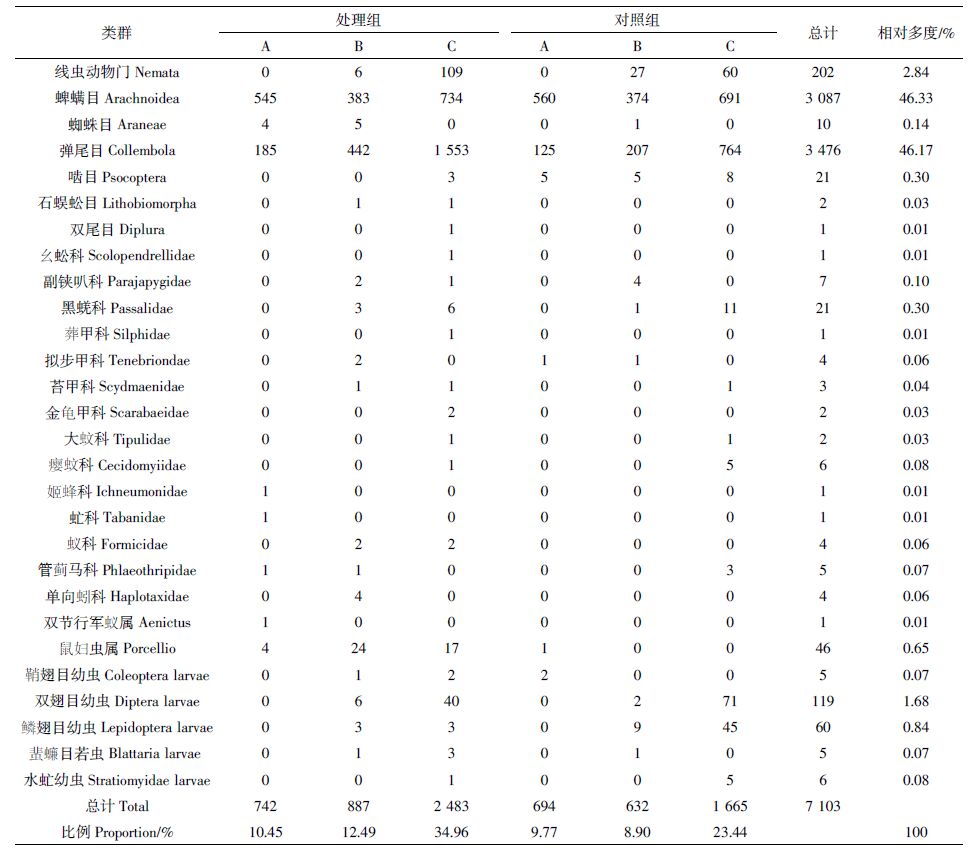
沟渠生境共捕获土壤无脊椎动物7 103头,隶属2门8纲15目(表 8)。处理组捕获4 112头,占总捕获量的57.89%,对照组捕获2 991头,占总捕获量的42.11%。优势类群是蜱螨目(46.33%)和弹尾目(46.17%),常见类群是线虫(2.84%)和双翅目幼虫(1.68%),其他类群相对多度较小。从处理组与对照组的土壤无脊椎动物群落结构看,蜱螨目、弹尾目均为优势类群,处理组中线虫(2.8%)、鼠妇虫属(1.09%)、双翅目幼虫(1.12%)为常见类群;对照组中线虫(2.91%)、双翅目幼虫(2.44%)、鳞翅目幼虫(1.81%)为常见类群。
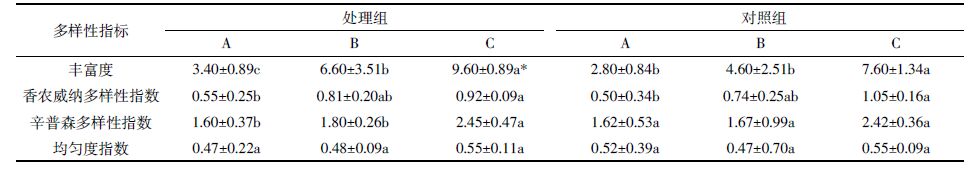
沟渠生境中土壤无脊椎动物多样性见表 9。处理组与对照组的多样性指标各层分别比较可知,处理组的香农威纳多样性指数、辛普森多样性指数略高于对照组,差异不显著;处理组表层腐殖土的丰富度显著高于对照组(P=0.024)。此结果表明,黄顶菊入侵沟渠生境后,凋落物未分解层、半分解层、表层腐殖土的土壤无脊椎动物多样性均有升高,且表层腐殖土差异显著。
处理组3层的多样性指标比较可知,表层腐殖土的丰富度(P=0.001)、香农威纳多样性指数(P=0.002)、辛普森多样性指数(P=0.004)显著高于未分解层,表层腐殖土的丰富度(P=0.048)、辛普森多样性指数显著高于半分解层(P=0.017),半分解层的丰富度显著高于未分解层(P=0.037)。此结果表明,土壤无脊椎动物在黄顶菊凋落物及表层腐殖土中自上往下多样性升高。
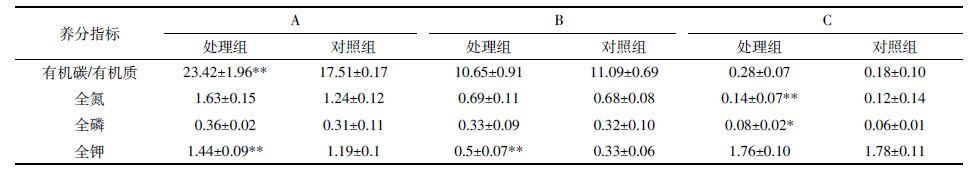
2.3.2 典范对应分析沟渠生境凋落物与表层腐殖土主要养分指标见表 10。未分解层处理组的有机碳、全磷显著高于对照组(P=0.000、P=0.001),对照组的全钾显著高于处理组(P=0.001);半分解层处理组的有机碳、全氮显著高于对照组(P=0.001、P=0.001),对照组的全钾显著高于处理组(P=0.002);表层腐殖土处理组的有机质、全氮、全磷、全钾显著高于对照组(P=0.013、P=0.002、P=0.021、P=0.007)。说明黄顶菊凋落物主要养分指标大部分高于对照植物,而未分解层、半分解层的全钾含量较低;黄顶菊入侵沟渠生境后,提高了表层腐殖土的主要养分含量。
如图 7所示,前两轴分别能解释数据变异的73.0%和6.8%,第一轴与全钾有较强的相关性(相关系数为-0.877),全钾对类群分布的影响较大(P=0.012)。蜘蛛目、虻科、管蓟马科、鼠妇虫属位于全钾箭头的负方向上,说明未分解层凋落物中全钾含量越低,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊未分解层凋落物全钾含量较低,上述土壤无脊椎动物多样性升高。
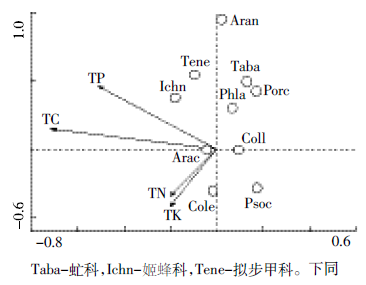
|
| .Taba-虻科,Ichn-姬蜂科,Tene-拟步甲科。下同 图 7 沟渠生境未分解层典范对应分析结果 Figure 7 Canonical correspondence analysis result of undecomposed litter layer in ditch habitat |
如图 8所示,前两轴分别能解释数据变异的72.7%和14.0%,第一轴与有机碳、全氮、全钾、全磷有较强的相关性(相关系数分别为-0.905、-0.842、-0.875、0.992),全钾对类群分布的影响较大(P=0.002)。蜘蛛目、拟步甲科、单向蚓科、双翅目幼虫位于全钾箭头的负方向上,说明半分解层中凋落物全钾含量越低,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊半分解层全钾含量较低,上述土壤无脊椎动物多样性升高。

|
| Hapl-单向蚓科,Lepi-鳞翅目幼虫。下同 图 8 沟渠生境半分解层典范对应分析结果 Figure 8 Canonical correspondence analysis result of semidecomposed layer in ditch habitat |
如图 9所示,前两轴分别能解释数据变异的48.9%和11.4%;第一轴与全氮、全磷有较强的相关性(相关系数分别为-0.850、0.847),全磷对类群分布的影响较大(P=0.01)。弹尾目、鼠妇虫属、鞘翅目幼虫位于全磷箭头的正方向上,说明表层腐殖土中全磷含量越高,此类无脊椎动物类群出现的概率越大。因此,较对照组而言,黄顶菊的入侵升高了表层腐殖土全磷含量,从而使上述土壤无脊椎动物多样性升高。
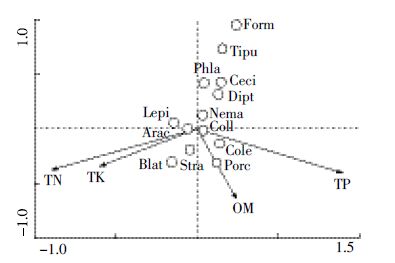
|
| 图 9 沟渠生境表层腐殖土典范对应分析结果 Figure 9 Canonical correspondence analysis result of humus in ditch habitat |
入侵植物对土壤动物的影响研究主要集中在群落多样性和生物量,这是由于植物入侵对土壤动物的影响机制可能是植物入侵导致进入碎屑食物网的资源产生质和量的不同,进而影响土壤动物的组成和多样性[20]。植物覆盖度、凋落物厚度的增加能为土壤动物提供栖息地和隐蔽所,同时可以通过影响土壤微生物、土壤酶和土壤养分等,改变土壤环境条件,进而影响土壤动物群落[21, 22]。黄顶菊枝叶稠密,植株高大,产生遮阴效应,植株能为土壤动物提供栖息地;黄顶菊入侵会改变入侵地的土壤状况,形成有利于其入侵的环境,并借此增强其竞争能力,进而影响土壤动物群落;土壤有机质、全氮、全磷、全钾的改变最终引起土壤动物多样性的改变[3, 4, 23]。
Magura等[24]研究表明,地表无脊椎动物对地面小气候、生物和非生物条件改变非常敏感。植物凋落物与土壤动物之间紧密联系、相互作用,凋落物的类型或组成、质量会影响土壤动物群落的食物和生境,进而影响土壤动物的数量、多样性与种群结构;而土壤动物又能够通过耕耘和分解作用影响凋落物与土壤养分含量,二者存在密切关系[25, 26, 27]。
本文具体研究了黄顶菊凋落物对土壤无脊椎动物的影响,该影响与黄顶菊植株的生长状况有关,在林地生境,处理组中蜱螨目相对多度小于对照组,而在荒地和沟渠生境中情况相反。出现此差异是由于林地生境处理组中黄顶菊长势弱,植被覆盖较差,凋落物较少,而对照组中杂草较多,植被覆盖高,凋落物多,能为蜱螨目提供更好的栖息地和隐蔽所,因此处理组蜱螨目的相对多度小于对照组;在荒地和沟渠生境的处理组中黄顶菊长势较强,植被覆盖较高,凋落物多,在对照组中本地杂草生长稀疏,植被覆盖较差,凋落物较少,因此处理组中蜱螨目的相对多度大于对照组。黄顶菊入侵3种生境后并未引起土壤无脊椎动物多样性的降低,相反,黄顶菊的植株及其凋落物能为优势类群提供栖息地和隐蔽所,引起土壤无脊椎动物多样性的升高,且3种生境中土壤无脊椎动物在凋落物中多样性呈自上而下的升高趋势。本文对土壤无脊椎动物类群与凋落物未分解层、半分解层、表层腐殖土的主要养分指标进行了典范对应分析,结果表明,黄顶菊凋落物与对照植物凋落物主要营养成分差异显著,黄顶菊凋落物通过改变土壤有机质、全氮、全磷和全钾等养分含量,进而影响土壤无脊椎动物优势类群与常见类群的分布,最终引起土壤无脊椎动物多样性的升高。
4 结论黄顶菊入侵3种生境后,植株的凋落物能为优势类群提供栖息地和隐蔽所,并通过改变凋落物以及土壤的主要养分含量,引起土壤无脊椎动物多样性的升高,且土壤无脊椎动物在凋落物层中多样性呈自上而下的升高趋势。这为进一步研究黄顶菊凋落物分解速率对土壤无脊椎动物群落的影响打下基础。
| [1] | 高贤明, 唐廷贵, 梁宇, 等. 外来植物黄顶菊的入侵警报及防控对策[J]. 生物多样性, 2004, 12(2):274-279. GAO Xian-ming, TANG Ting-gui, LIANG Yu, et al. An alert regarding biological invasion by a new exotic plant, Flaveria bidentis. and strategies for its control[J]. Biodiversity Science, 2004, 12(2):274-279.(in Chinese) |
| [2] | 刘全儒. 中国菊科植物一新归化属——黄菊属[J]. 植物分类学报, 2005, 43(2):178-180. LIU Quan-ru. Flaveria Juss(Compositae), a newly naturalized genus in China[J]. Acta Phytotaxonomica Sinica, 2005, 43(2):178-180.(in Chinese) |
| [3] | 张天瑞, 皇甫超河, 白小明, 等. 黄顶菊入侵对土壤养分和酶活性的影响[J]. 生态学杂志, 2010, 29(7):1353-1358. ZHANG Tian-rui, HUANGFU Chao-he, BAI Xiao-ming, et al. Effects of Flaveria bidentis invasion on nutrient contents and enzyme activities[J]. Chinese Journal of Ecology, 2010, 29(7):1353-1358.(in Chinese) |
| [4] | 张国良, 付卫东, 郑浩. 黄顶菊入侵机制及综合治理[M]. 北京:科学出版社, 2014. ZHANG Guo-liang, FU Wei-dong, ZHENG Hao. Invasion mechanisms and integrated management of Flaveria bidentis[M]. Beijing:Science Press, 2014.(in Chinese) |
| [5] | Lavelle P, Decaëns T, Aubert M, et al. Soil invertebrates and ecosystem services[J]. European Journal of Soil Biology, 2006, 42:S3-S15. |
| [6] | 尹文英. 中国土壤动物[M]. 北京:科学出版社, 2000. YIN Wen-ying. Soil animals in China[M]. Beijing:Science Press, 2000.(in Chinese) |
| [7] | Hättenschwiler S, Gasser P. Soil animals alter plant litter diversity effects on decomposition[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(5):1519-1524. |
| [8] | Berg B, McClaugherty C. Plant litter decomposition, humus formation, carbon sequestration(2nd Ed)[M]. Springer, 2008. |
| [9] | 殷秀琴, 张桂荣. 森林凋落物与大型土壤动物相关关系的研究[J]. 应用生态学报, 1993, 4(2):167-173. YIN Xiu-qin, ZHANG Gui-rong. Correlation between forest litter and soil macroanimals[J]. Chinese Journal of Applied Ecology, 1993, 4(2):167-173.(in Chinese) |
| [10] | 余广彬, 杨效东. 不同演替阶段热带森林地表凋落物和土壤节肢动物群落特征[J]. 生物多样性, 2007, 15(2):188-198. YU Guang-bin, YANG Xiao-dong. Characteristics of litter and soil arthropod communities at different successional stages of tropical forests[J]. Biodiversity Science, 2007, 15(2):188-198.(in Chinese) |
| [11] | 刘宁, 付卫东, 张国良, 等. 黄顶菊入侵对不同生境地表土壤动物群落的影响[J]. 生态学杂志, 2014, 33(1):176-183. LIU Ning, FU Wei-dong, ZHANG Guo-liang, et al. Impacts of Flaveria bidentis invasion on ground-dwelling soil animal community in different habitats[J]. Chinese Journal of Ecology, 2014, 33(1):176-183.(in Chinese) |
| [12] | 忻介六. 土壤动物知识[M]. 北京:科学出版社, 1986. XIN Jie-liu. Knowledge of soil animals[M]. Beijing:Science Press, 1986.(in Chinese) |
| [13] | 殷秀琴, 宋博, 邱丽丽. 红松阔叶混交林凋落物-土壤动物-土壤系统中N、P、K的动态特征[J]. 生态学报, 2007, 27(1):128-134. YIN Xiu-qin, SONG Bo, QIU Li-li. Dynamic characteristics of N, P, K in the litter-soil fauna-soil system of mixed Pinus Koraiensis and broad-leaved forest[J]. Acta Ecologica Sinica, 2007, 27(1):128-134.(in Chinese) |
| [14] | 崔振东. 土壤动物的作用[J]. 动物学杂志, 1985(2):48-52. CUI Zhen-dong. Function of soil animals[J]. Chinese Journal of Zoology, 1985(2):48-52.(in Chinese) |
| [15] | 尹文英. 中国土壤动物检索图鉴[M]. 北京:科学出版社, 1998. YIN Wen-ying. Pictorical keys to soil animals of China[M]. Beijing:Science Press, 1998.(in Chinese) |
| [16] | 李鸿兴, 隋敬之, 周士秀. 昆虫分类检索[M]. 北京:农业出版社, 1987. LI Hong-xing, SUI Jing-zhi, ZHOU Shi-xiu. Index of insect classification[M]. Beijing:China Agriculture Press, 1987.(in Chinese) |
| [17] | 鲍士旦. 土壤农化分析(第3版)[M]. 北京:中国农业出版社, 2002. BAO Shi-dan. Analysis of agro-chemistry in soil(3rd edition)[M]. Beijing:China Agriculture Press, 2002.(in Chinese) |
| [18] | 谭波, 吴福忠, 杨万勤, 等. 川西亚高山/高山森林大型土壤动物群落多样性及其对季节性冻融的响应[J]. 生物多样性, 2012, 20(2):215-223. TAN Bo, WU Fu-zhong, YANG Wan-qin, et al. Soil macro-fauna community diversity and its response to seasonal freeze-thaw in the subalpine/alpine forests of western Sichuan[J]. Biodiversity Science, 2012, 20(2):215-223.(in Chinese) |
| [19] | TerBraak C J F. Canoco-a fortran program for canonical community ordination by[partial] [etrended] [canonical] correspondence analysis, principal components analysis and redundancy analysis(version 2.1)[R]. New York:Cornell University, 1988. |
| [20] | 陈慧丽. 互花米草入侵对长江口盐沼湿地线虫群落的影响及其机制[D]. 上海:复旦大学, 2008. CHEN Hui-li. Effect of Spartinaalterniflora invasions on nematode communities in salt marshes of the Yangtze River estuary and its mechanisms[D]. Shanghai:Fudan University, 2008.(in Chinese) |
| [21] | 林英华, 宋百敏, 韩茜, 等. 北京门头沟废弃采石矿区地表土壤动物群落多样性[J]. 生态学报, 2007, 27(11):4832-4839. LIN Ying-hua, SONG Bai-min, HAN Qian, et al. The community diversity of ground-dwelling soil animals in abandoned quarry in Mentougou, Beijing[J]. Acta Ecologica Sinica, 2007, 27(11):4832-4839.(in Chinese) |
| [22] | 张桂花, 彭少麟, 李光义, 等. 外来入侵植物与地下生态系统相互影响的研究进展[J]. 中国农学通报, 2009, 25(14):246-251. ZHANG Gui-hua, PENG Shao-lin, LI Guang-yi, et al. Recent advances in the interaction between invasive plants and belowground ecosystem[J]. Chinese Agricultural Science Bulletin, 2009, 25(14):246-251.(in Chinese) |
| [23] | 刘宁. 黄顶菊入侵对不同生境土壤动物群落的影响[D]. 泰安:山东农业大学, 2013. LIU Ning. Impacts of Flaveria bidentis invasion on soil animal communities in different habitats[D]. Tai'an:Shandong Agricultural University, 2013.(in Chinese) |
| [24] | Magura T, Tóthmérész B, Elek Z. Diversity and composition of carabids during a forestry cycle[J]. Biodiversity and Conservation, 2003, 12:73-85. |
| [25] | Mikola J, Yeates G W, Wardle D A, et al. Response of soil food-web structure to defoliation of different plant species combinations in an experimental grassland community[J]. Soil Biology and Biochemistry, 2001, 33:205-214. |
| [26] | Waidle D A, Bonner K I, Barker G M. Linkages between plant litter decomposition, litter quality, and vegetation responses to herbivores[J]. Functional Ecology, 2002, 16:585-595. |
| [27] | 汪思龙, 陈楚. 森林残落物生态学[M]. 北京:科学出版社, 2010. WANG Si-long, CHEN Chu. Forest debris ecology[M]. Beijing:Science Press, 2010.(in Chinese) |
 2016, Vol. 33
2016, Vol. 33