文章信息
- 徐秋桐, 顾国平, 章明奎
- XU Qiu-tong, GU Guo-ping, ZHANG Ming-kui
- 土壤中兽用抗生素污染对水稻生长的影响
- Effects of Soil Veterinary Antibiotics Pollution on Rice Growth
- 农业资源与环境学报, 2016, 33(1): 60-65
- Journal of Agricultural Resources and Environment, 2016, 33(1): 60-65
- http://dx.doi.org/10.13254/j.jare.2015.0133
-
文章历史
- 收稿日期: 2015-05-28
2. 绍兴市农业科学研究院, 浙江绍兴 312003
2. Shaoxing Academy of Agricultural Sciences, Shaoxing 312003, China
自20世纪20—40年代发现抗生素并证明其具有临床疗效以来,人们对抗生素新产品的开发与应用研究一 直没有间断,迄今世界上已发现达4 000多种抗生素。抗生素主要通过干扰细菌细胞壁的合成、损害细胞 膜的机能、抑制核酸的合成(包括抑制DNA的复制和RNA的合成)及抑制蛋白质的合成等方式控制微生物 的活动,达到控制疾病的目的,并被广泛用于动植物病虫防治及农田除草与调节植物的生长、发育。根 据应用对象的不同,抗生素可分为医用抗生素、兽用抗生素和农用抗生素等类别。各类抗生素由于应用 目标不同,其化学物质种类、作用机理均有较大的差异。考虑到长期使用抗生素可导致细菌产生抗药性, 为了在利用抗生素的同时又尽可能减少它的负面影响,在抗生素的应用和开发过程中要求避免抗生素在 医用、兽用和农用之间混用[1]。
抗生素在农业上的应用始于20世纪50年代,主要用于农作物的抗虫、抗病、除草及调节作物的生长。开 始曾经从医用抗生素中筛选出农用抗生素用于农作物病害的防治,但应用后发现许多抗生素对农作物有 药害[1]。目前,使用于农作物的抗生素为植物专用抗生素(如井岗霉素、内疗素、多效霉素、杀蚜素等 ),它们具备高度选择性的毒性并易为土壤微生物分解或光解,在粮食、蔬果中的残毒较小,对环境不 易污染,并在防治农作物病原菌和组培与育种研究中起到了重要的作用[2, 3, 4],因此它们具有较为广泛的 应用前景。传统上,进入农田的抗生素主要为农用抗生素。但近年来,随着抗生素在畜牧兽医方面的广 泛应用,已有一定数量的兽用抗生素进入农田生态系统。进入动物体内的兽用抗生素约60%~90%以原 形通过粪便和尿液排出体外,并保持较强的生物学活性,随有机肥的施用进入并较长时间滞留在农田中 [5, 6, 7, 8]。大量调查已从土壤、水体中检测出兽用抗生素,残留量可在μg·kg-1级至g·kg-1级之间变化 [5, 6, 7, 8, 9, 10, 11]。农用抗生素防治主要为真菌性病害(占90%以上),而兽用抗生素大多是用来防治细菌性病害, 因此,土壤环境中的兽用抗生素残留可能会对作物生长产生不同于农用抗生素的影响。研究表明,土壤 中的多数兽用抗生素可向植物体内迁移[5, 6, 7, 8, 9, 10, 11, 12, 13, 14],并可对植物生长产生一定的影响[15, 16, 17, 18, 19, 20]。但植物对兽用 抗生素的吸收、富集及抗生素对植物的影响因抗生素、植物和土壤类型不同而有很大差异[5, 18]。兽用 抗生素可能会影响植物的根系发育、地上部分的生长及抑制叶绿体合酶的活性[5, 8, 11, 12, 17, 20]。 目前的多数研究主要基于溶液培养试验,缺少在土壤环境下抗生素对作物生长影响的试验,特别是土壤 抗生素污染对我国南方地区主要粮食——水稻的生长是否有影响还知之甚少。为此,选择我国养殖业中 常用的抗生素之一土霉素作为目标化合物,试验研究了不同土霉素浓度水平对水稻苗期、生长期生长与 产量的影响,探讨了水稻各器官中土霉素积累与土壤中土霉素浓度水平的关系,为评估农田土壤抗生素 污染对农作物的潜在影响提供依据。
1 材料与方法 1.1 供试材料试验在浙江省绍兴市柯桥区进行,试验地位于水网平原,供试土壤为青粉泥田(属水稻土土类、脱潜水 稻土亚类),土壤基本性质见表 1。试验区年平均气温约16.5 ℃,年均降水量约1 400 mm。检测表明, 试验前土壤无土霉素检出。供试抗生素为土霉素,属于四环素类抗生素,该类抗生素在我国养殖业中应 用较为广泛。试验用土霉素为Fluka公司产品,纯度≥98%。
供试水稻品种为甬籼15。试验前对水稻种子进行浸种。事先将种子摊晒1~2 d,用3%的多菌灵药液浸泡12 h,清水淘洗,直到水变清时开始浸种。浸泡时间为3 d,每日用清水淘洗3~4次。3 d后将种子淘洗干净 ,再用55 ℃的水将种子预热,用湿麻袋把种子包好,再用稻草等保温,温度保持在30~35 ℃,24 h即可 催出稻芽,稻芽露出后逐步降温至20 ℃左右,摊开种子,在自然条件下炼芽1 d后播种。
1.3 试验方法试验于2013年4—8月在露天条件下进行,试验期间累计降水量约730 mm。试验由苗期试验和生长期试验2 个部分组成。
苗期试验共设7个土霉素浓度等级。为了较为全面了解土霉素对水稻幼苗生长的影响,试验中高浓度级别 的土霉素高于常规农田土壤的污染水平,对应的0~15 cm表层土壤土霉素污染浓度分别为0、2、5、10、 30、60 mg·kg-1和100 mg·kg-1,小区面积为1 m2,重复3次;处理随机排列。小区间用塑料板隔离, 其中,插入土壤部分为20 cm,出露地表高度25 cm。以小区为单元,根据耕作土层厚度(15 cm)、容重 (1.18 g·cm-3)及设定的抗生素浓度计算各小区土霉素用量,并均匀施入相应小区。苗床事先按每 666.7 m2施入农家肥1 500 kg、普钙50 kg、钾肥6 kg作底肥。施入的抗生素与土壤充分混合后平整墒面 进行播种。每一小区的种子用量为30 g。播种后搭棚盖膜,保温保湿,防止由低温引发的烂芽、烂秧。 播种后,当苗床出现杂草时采用人工轻轻拔除杂草;播种到2叶期保持苗床土湿润,2叶期后要控水降湿 防病。在2叶期施少量尿素促进生长健壮;在4叶期施少量尿素、钾肥促进分蘖;在4.5~5叶期进行炼苗。 至秧龄30 d时观察水稻秧苗生长情况,测定根系活力、叶片中叶绿素含量及过氧化氢酶活性,并进行移 栽试验。叶绿素含量取第2叶测定,用95%乙醇提取,比色法测定[21];根系活力参照文献[22]方法测定 ,表示为对TTC的还原强度;过氧化氢酶活性参照文献[23]方法测定,底物为H2O2。
生长期试验为土霉素3个污染梯度和2种来源秧苗双因素试验。土霉素3个污染梯度对应的0~15 cm表层土 壤土霉素污染浓度分别为0、60 mg·kg-1和100 mg·kg-1(分别用符号T0、T1、T2表示);2种来源秧苗 指苗期试验中土霉素用量为0 mg·kg-1和60 mg·kg-1的2个处理的秧苗(分别用符号R0和R1表示)。共6 个处理(分别为T0R0、T1R0、T2R0、T0R1、T1R1、T2R1)。每一小区各施用0.15 kg的复合肥(N-P-K构 成为15-15-15)作为基肥。每一小区移栽上述秧苗25苗。水稻生长期间采用常规方法进行水肥管理。至 分蘖期观察分蘖数;至水稻成熟后,对水稻进行考种,观察水稻生长状况;并在每一小区内随机采集3株 水稻植株样,分为根、叶、茎、籽粒4个部分,分析土霉素含量。采集的水稻器官样品先后经过自来水、 蒸馏水洗净后用吸水纸吸干用于分析土霉素。
1.4 土霉素分析方法水稻器官样品中抗生素含量采用超声提取-固相萃取预处理和高效液相色谱-串联质谱(HPLC-MS/MS)分 析法测定。采用乙腈-硫酸钠-乙酸钠-Na2EDTA溶液/超声波提取,用正已烷液-液萃取去脂,然后用强阴 离子交换柱(SAX)-亲水亲脂萃取柱(HLB)串联进行纯化和富集。Oasis HLB固相萃取柱(3 mL·60 mg-1);强阴离子交换柱(SAX)(3 mL·500 mg-1);以串联SAX-HLB柱对5 mL滤液进行净化,分别以2 mL甲醇、2 mL水活化小柱,滤液以5 mL·min-1的速度过柱,待其完全流出后,去除SAX柱,HLB柱依次用 5 mL水、5 mL甲醇-水(5∶95)淋洗,弃去全部流出液。减压抽干5 min,最后用5 mL 0.01 mol·L-1草 酸-甲醇溶液洗脱。将洗脱液在40 ℃下旋转蒸发至干,用1 mL乙腈-0.086 mol·L-1磷酸(15/85,V/V) 定容,过0.45 μm滤膜,高效液相色谱-串联质谱(HPLC-MS/MS)分析。土霉素的回收率为81.32%~96.3% ,平均为86.4%,最低检测限为0.13 μg·kg-1。
1.5 数据统计方法试验数据采用Microsoft Excel 2003软件进行处理,用SPSS 19.0软件进行统计分析。采用最小显著极差 法(LSD)进行差异显著性检验(P < 0.05)。
2 结果与分析 2.1 土霉素污染对水稻幼苗生长的影响由表 2可知,随着土壤中土霉素污染浓度的增加,水稻幼苗地上部分和地下部分生物量呈现下降趋势,但 发生明显下降时土壤中土霉素污染浓度已达到较高水平。其中,地下部分生物量发生显著下降时土壤土 霉素污染浓度约为30 mg·kg-1,地上部分生物量发生显著下降时土壤土霉素污染浓度约为100 mg·kg-1 ,这表明地下部比地上部对土壤土霉素污染更为敏感。与对照比较,当土壤中土霉素污染浓度为30、60 mg·kg-1和100 mg·kg-1时,地下部生物量分别下降了29.45%、53.42%和70.55%;地上部生物量分别下 降了3.85%、10.12%和15.59%。由于地下部生物量受土壤抗生素污染更为敏感,随着土壤中土霉素污染浓 度的增加,地下部分/地上部分生物量比值也呈现下降的趋势。
 |
由表 3可知,当土壤中土霉素污染浓度高于30 mg·kg-1时根系活力显著下降;土霉素污染浓度高于100 mg·kg-1时叶绿素含量和过氧化氢酶活性显著下降。与对照比较,当土壤中土霉素污染浓度为30、60 mg ·kg-1和100 mg·kg-1时,根系活力分别下降了14.81%、20.63%和22.22%;当土壤中土霉素污染浓度为 60 mg·kg-1和100 mg·kg-1时,叶片中叶绿素含量分别下降了5.13%和11.82%,过氧化氢酶活性分别下 降了3.41%和12.29%。
 |
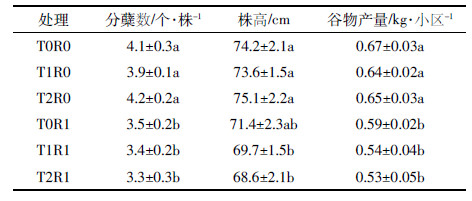
表 4为水稻生长期土壤土霉素污染水平对水稻分蘖数及收获时株高和谷物产量的影响。结果表明,秧苗来 源相同的小区之间,土壤土霉素污染水平的高低(0、60 mg·kg-1和100 mg·kg-1)对收获时水稻分蘖 数、株高和产量均无显著的影响;但二种不同来源秧苗的小区之间收获时水稻分蘖数、株高和产量均存 在显著的差异。苗期受到过高土霉素污染水平(60 mg·kg-1)处理的小区(T0R1、T1R1、T2R1)水稻分 蘖数、株高和谷物产量分别比未受土霉素污染(0 mg·kg-1)影响的处理(T0R0、T1R0、T2R0)的平均 低12.8%~21.4%、3.8%~8.9%和11.9%~18.5%。这一结果表明,在土壤土霉素污染浓度低于60 mg·kg-1时 ,土壤土霉素污染不会对移栽后水稻生长产生明显的影响,但苗期受到过土霉素污染影响的水稻其生长 后期株高和产量比未受过土霉素影响的要低,也就是苗期受抗生素污染的影响可持续贯穿于整个生长期 。
表 5可知,水稻收获时各器官中土霉素残留量主要受后期土壤中土霉素污染水平的影响,随后期土壤中土 霉素污染水平的提高而增加;幼苗期受土霉素不同污染程度的影响没有在收获期的土霉素残留量中体现 。不同器官中土霉素残留量却有很大的差异,根部土霉素残留量明显高于其他器官;其次为叶片,茎中 土霉素的残留量低于叶片,谷物中土霉素的残留量最低。总体上,谷物中土霉素的残留量在2 μg·kg-1 以下,但其也随土壤中土霉素污染水平的增加而增加。
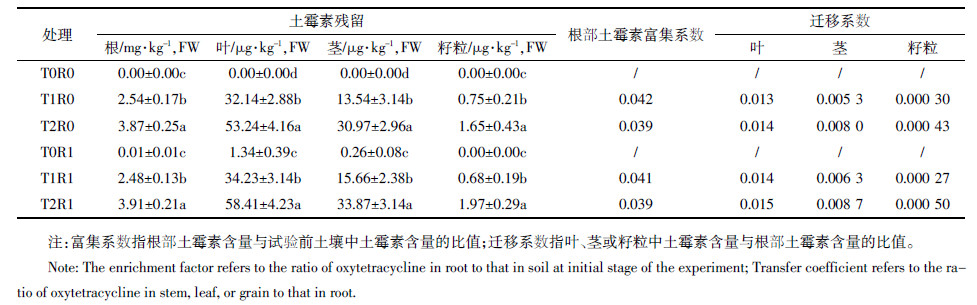 |
与试验前土壤中土霉素浓度相比,水稻根部对土霉素的富集并不明显,处理T1R0、T2R0、T1R1和T2R1的 水稻根部对土霉素的富集系数(根部土霉素含量与试验前土壤中土霉素含量的比例)在0.039~0.042之间 (表 5),较低的富集系数值可能与水稻对土霉素吸收能力较低、土壤对土霉素的固定及在水稻生长过程 中土壤中土霉素发生了明显的降解有关,具体原因还有待进一步研究。
叶、茎、籽粒中土霉素的含量与根部中土霉素含量的相对比例可反映土霉素在植物体中的迁移能力。计 算结果表明,在处理T1R0、T2R0、T1R1和T2R1中,叶片与根部中土霉素的平均比值在0.013~0.015之间, 茎部与根部中土霉素的平均比值在0.005 3~0.008 7之间,籽粒与根部中土霉素的平均比值在0.000 27~0.000 50之间(表 5)。这一结果表明,土霉素在水稻体内的迁移能力较弱,尤其向籽粒迁移的能力 特别小。
3 讨论以上结果表明,水稻不同生长期对土霉素污染的敏感性有所差异,苗期易受土霉素污染的影响,这可能 与苗期水稻各器官对外部环境的抵抗能力较弱有关。在苗期,水稻地下部分更易受土霉素污染的影响, 这可能与根部是植株与土壤的接触部分,抗生素更易在根部积累有关。有关兽用抗生素对植物生长的影 响机理较为复杂,至今还没有开展系统的研究,但有一些初步的研究发现,抗生素可降低作物生长所需 的叶酸合成、原生质的形成,影响过氧化物酶、谷胱甘肽转移酶等酶的表达及降低叶绿素含量而影响植 物的光合作用[19, 24],本研究的结果也表明土壤高浓度的土霉素可降低水稻苗期根系活力、叶片叶绿 素含量和氧化酶活性。虽然生长期土壤中抗生素污染对水稻后期生长影响不大,但水稻苗期受抗生素污 染的伤害也最终会影响到水稻的收成。
对于绝大多数的农业土壤,土霉素的残留量一般都在10 mg·kg-1以下[25, 26, 27, 28, 29]。由于土壤矿物对抗生素 的吸附与固定作用,实际农田土壤环境中生长的农作物受抗生素污染的影响小于相同污染浓度的水环境 生长的植物[20]。本研究的结果也表明,无论是苗期还是生长期,当土壤中土霉素污染水平低于10 mg· kg-1时,不会对水稻生长产量明显的影响,因此可以认为,在一般土霉素污染水平下,土壤中的土霉素 不会对水稻生长构成影响。土壤中的抗生素也可以通过植物的吸收、富集[7, 8],在植物的不同部位传输 ,最终通过作物的可食部分进入人体,对人类的健康产生潜在的风险[25, 26],特别是产生抗药性[30]。 但从本研究的结果来看,因土霉素由土壤向水稻根部及由根部向地上部分的迁移能力较弱,水稻谷物中 积累的土霉素含量相对很低,这种影响对水稻来说相对不明显。
4 结论试验结果表明,高浓度的土壤土霉素污染(30 mg·kg-1以上)可影响水稻苗期的生长,对地下部分的影 响明显大于地上部分;对水稻苗期地下部生物量、根系活力、叶片叶绿素含量和氧化酶活性有显著的抑 制作用。苗期受到土霉素污染影响的水稻其影响一直可延续至整个生育期,降低分蘖数,减少谷物产量 。土霉素在水稻各器官中的积累:根系>叶片>茎秆>籽粒。总体上,水稻对土壤中的土霉素富集能力较小 ,土霉素由根部向地上部分叶、茎、籽粒的迁移作用也较弱。由于当前农田土壤中土霉素污染水平一般 较低(多在10 mg·kg-1以下),且在谷物中土霉素积累水平较低,因此,对于一般污染水平的土霉素污 染农地,对水稻生长不会产生明显的影响。
| [1] | 王获, 方金瑞. 抗生素[M]. 北京:科学出版社, 1985:1-50. WANG Huo, FANG Jin-rui. Antibiotics[M]. Beijiang:Science Press,1985:1-50.(in Chinese) |
| [2] | 王梅, 汤浩茹, 刘淑芳, 等. 抗生素对草莓内生菌的抑制[J]. 安徽农业科学, 2005, 33(4):606-607. WANG Mei, TANG Hao-ru, LIU Shu-fang, et al. Inhibition of antibiotics on endophytic bacteria in strawberry[J]. Anhui Agricultural Sciences, 2005, 33(4):606-607.(in Chinese) |
| [3] | 冯东昕, 李宝栋, 张克诚, 等. 抗生菌(素)对茄子黄萎病的防效测定初报[J]. 植保技术与推广, 1999(2):40-42. FENG Dong-xin, LI Bao-dong, ZHANG Ke-cheng, et al. Preliminary study on antibiotics effect on verticillium wilt prevention of eggplant[J]. Technology and Extension of Plant Protection, 1999(2):40-42.(in Chinese) |
| [4] | 杨广东, 朱祯, 李燕娥, 等. 几种抗生素对大白菜种子发芽及离体子叶再生的影响[J]. 华北农学报, 2002, 17(1):55-59. YANG Guang-dong, ZHU Zhen, LI Yan-e, et al. Effects of several antibiotics on the germination of seed and regeneration of the cotyledon isolated from the body of Chinese cabbage[J]. Acta Agriculturae Boreali-Sinica, 2002, 17(1):55-59.(in Chinese) |
| [5] | Batchelder A R. Chlortetracyline and oxytetracycline effects on plant growth and development in soil systems[J]. Journal of Environmental Quality, 1982, 11(4):675-678. |
| [6] | Ziolkowska A, Piotrowicz-Cieslak A I, Margas M, et al. Accumulation of tetracycline, oxytetracycline and chlortetracycline in pea (Pisum sativum L.)[J]. Tresenius Environmental Bulletin, 2015, 24(4A):1386-1391. |
| [7] | Boxall A B A, Johnson P, Smith E J, et al. Uptake of veterinary medicines from soils into plants[J]. Journal of Agricultural Food Chemistry, 2006, 54(6):2288-2297. |
| [8] | Leston Sara, Nunes M, Viegas I, et al. The influence of sulfathiazole on the macroalgae ulva lactuca[J]. Chemosphere, 2014, 100:105-110. |
| [9] | Kumar K, Gupta S C, Baidoo S K, et al. Antibiotic uptake by plants from soil fertilized with animal manure[J]. Journal of Environmental Quality, 2005, 34:2082-2085. |
| [10] | Zhang Y J, Boyd S A, Teppen B J, et al. Role of tetracycline speciation in the bioavailability to Escherichia coli for uptake and expression of antibiotic resistance[J]. Environmental Science & Technology, 2014, 48(9):4893-4900. |
| [11] | Migliore L, Cozzolino S, Fiori M. Phytotoxicity to and uptake of enrofloxacin in crop plants[J]. Chemosphere, 2003, 52:1233-1244. |
| [12] | 徐秋桐, 鲍陈燕, 顾国平, 等. 土霉素对不同生长期青菜生长的影响及其在青菜地上部分的积累[J]. 中国农学通报, 2014, 30(28):189-193. XU Qiu-tong, BAO Chen-yan, GU Guo-ping, et al. Phytotoxicity and accumulation of oxytetracycline from soil in Chinese cabbage (Brassica chinensis var. chinensis) with different growing stages[J]. Chinese Agricultural Science Bulletin, 2014, 30(28):189-193.(in Chinese) |
| [13] | Migliore L, Cozzolino S, Fiori M. Phytotoxicity to and uptake of flumequine used in intensive aquaculture on the aquatic weed, Lythrum salicaria L[J]. Chemosphere, 2000, 40:741-750. |
| [14] | 贺德春, 吴根义, 许振成, 等. 小白菜和白萝卜对四环素类抗生素的吸收累积特征[J]. 农业环境科学学报, 2014, 33(6):1095-1099. HE De-chun, WU Gen-yi, XU Zhen-cheng, et al. Uptake of selected tetracycline antibiotics by pakchoi and radish from manure-amended soils[J]. Journal of Agro-Environment Science, 2014, 33(6):1095-1099.(in Chinese) |
| [15] | Migliore L, Civitareale C, Cozzolino S, et al. Laboratory models to evaluate phytotoxicity of sulphadimethoxine on terrestrial plants[J]. Chemosphere, 1997, 37:2957-2961. |
| [16] | Kang D H, Gupta Satish, Rosen C, et al. Antibiotic uptake by vegetable crops from manure-applied soils[J]. Journal of Agricultural and Food Chemistry, 2013, 61(42):9992-10001. |
| [17] | Kong W D, Zhu Y G, Liang Y C, et al. Uptake of oxytetracycline and its phytotoxicity to alfafa (Medicago sativa L.)[J]. Environmental Pollution, 2007, 147:187-193. |
| [18] | 魏子艳, 王金花, 夏晓明, 等. 三种抗生素对蔬菜种子芽与根伸长的生态毒理效应[J]. 农业环境科学学报, 2014, 33(2):237-242. WEI Zi-yan, WANG Jin-hua, XIA Xiao-ming, et al. Ecotoxicity of three antibiotics to shoots and root elongation of cucumber, rape and Chinese cabbage[J]. Journal of Agricultural Environmental Science, 2014, 33(2):237-242.(in Chinese) |
| [19] | 金彩霞, 陈秋颖, 刘军军, 等. 两种常用兽药对蔬菜发芽的生态毒性效应[J]. 环境科学学报, 2009, 29(3):619-625. JIN Cai-xia, CHEN Qiu-ying, LIU Jun-jun, et al. The ecological toxic effect of two common veterinary drugs on the germination of vegetables[J]. Journal of Environmental Sciences, 2009, 29(3):619-625.(in Chinese) |
| [20] | Li Z J, Xie X Y, Zhang S Q, et al. Wheat growth and photosysnthesis as affected by oxytetracycline as a soil contaminant[J]. Pedosphere, 2011, 21(2):244-250. |
| [21] | 郝再彬, 苍晶, 徐仲. 植物生理学实验[M]. 哈尔滨:哈尔滨工业大学出版社, 2004:46-49. HAO Zai-bin, CANG Jing, XU Zhong. Experiment of plant physiology[M]. Harbin:Harbin Institute of Technology Press, 2004:46-49.(in Chinese) |
| [22] | 张志良, 瞿伟菁, 李小芳. 植物生理学实验指导(第4版)[M]. 北京:高等教育出版社, 2009:32-33. ZHANG Zhi-liang, QU Wei-jing, LI Xiao-fang. Experimental guidance of plant physiology (Fourth Edition)[M]. Beijing:Higher Education Press, 2009:32-33.(in Chinese) |
| [23] | 余迪求, 岑川, 杨明兰, 等. 玉米不同组织过氧化氢酶水杨酸敏感性的差异和外源水杨酸处理提高玉米抗病性的研究[J]. 植物学报, 1999, 41(12):1293-1298. YU Di-qiu, CEN Chuan, YANG Ming-lan, et al. Differences in the sensitivity of catalase and salicylic acid in different tissues of maize and the improvement of maize'resistance by exogenous salicylic acid[J]. Chinese Bulletin of Botany, 1999, 41(12):1293-1298.(in Chinese) |
| [24] | Bradel B G, Preil W, Jeske H. Remission of the free-branching pattern of Euphorbia pulcherrima by tetracycline treatment[J]. Journal of Phytopathology, 2000, 148(1-2):587-590. |
| [25] | Halling-Sorensen B, Nielsen S N, Lansky P F, et al. Occurrence, fate, and effects of pharmaceuticals in the environment:A review[J]. Chemosphere, 1998, 36:357-365. |
| [26] | Thiele-Bruhn S. Pharmaceutical antibiotic compounds in soils:A review[J]. Journal of Plant Nutrition and Soil Science, 2003, 166:145-167. |
| [27] | Li C, Chen J Y, Wang J H, et al. Occurrence of antibiotics in soils and manures from greenhouse vegetable production bases of Beijing, China and an associated risk assessment[J]. Science of the Total Environment, 2015, 521:101-107. |
| [28] | Ma Y P, Li M, Wu M M, et al. Occurrences and regional distributions of 20 antibiotics in water bodies during groundwater recharge[J]. Science of the Total Environment, 2015, 518:498-506. |
| [29] | Xie Y F, Li X W, Wang J F, et al. Spatial estimation of antibiotic residues in surface soils in a typical intensive vegetable cultivation area in China[J]. Science of the Total Environment, 2012, 430:126-131. |
| [30] | Kummer K, Henninger A. Promoting resistance by the emission of antibiotics from hospitals and households into effluent[J]. Clinical Microbiology and Infection, 2003, 9(12):1203-1214. |
 2016, Vol. 33
2016, Vol. 33