文章信息
- 焦子伟, 张相锋, 努尔买买提, 任艳利, 吾尔恩, 郭岩彬
- JIAO Zi-wei, ZHANG Xiang-feng, NUER Maimaiti, REN Yan-li, WU Er-en, GUO Yan-bin
- pqq基因簇在Escherichia coli DH5α中表达及对其溶磷促生的影响
- Expression pqq Gene Cluster and Its Effects on Mineral Phosphate Solubilization and Plant Promotion in Escherichia coli DH5α
- 农业资源与环境学报, 2016, 33(1): 43-48
- Journal of Agricultural Resources and Environment, 2016, 33(1): 43-48
- http://dx.doi.org/10.13254/j.jare.2015.0176
-
文章历史
- 收稿日期: 2015-07-16
2. 中国农业大学资源与环境学院, 北京 100193
2. College of Resources and Environmental Science, China Agricultural University, Beijing 100193, China
近年来,越来越多的研究表明植物促生菌在磷缺乏的土壤中使难溶性磷变为有效的磷促进植物生长,降低化学肥料的应用,减少对环境的影响,并逐步得到广泛应用[1, 2, 3]。截至目前,已报道的植物溶磷促生细菌主要有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、拉恩氏菌属(Rahnella)、埃希氏菌属(Escherichia)、克雷白氏杆菌属(Klebsiella)、土壤杆菌属(Agrobacterium)等菌属[4, 5, 6],产有机酸是细菌溶解矿质磷主要机制之一[1]。已有报道的克隆获得吡咯喹啉醌(pyrroloquinoline quinone,PQQ)合成基因簇的革兰氏阴性菌如中间肠杆菌(Enterobacter intermedium 60-2G)[7]、葡萄杆菌属(Gluconobacter oxydans)[8]和拉恩氏菌属(Rahnella aquatilis HX2)[9]等。有些细菌如鼠伤寒沙门氏菌(Salmonella typhimurium)、大肠杆菌(E. coli)等只合成脱辅基蛋白(apo-enzyme)而不合成PQQ[10, 11]。但PQQ对大肠杆菌来说具有趋化的吸引力[12]。PQQ生物合成中涉及4~7个相关基因(pqqABCDEFG)基因簇,在一些细菌中如Enterobacter intermedium 60-2G、Klebsiela pneumoniaeNCTC418、Rahnella aquatilis HX2中PQQ合成基因通常由6个基因构成的基因簇(pqqA、pqqB、pqqC、pqqD、pqqE和pqqF)[9, 13]。水生拉恩氏菌HX2是一株优良的植物溶磷促生菌株,Guo 等[13]成功地通过Tn5插入突变pqq基因簇获得了不能合成PQQ的突变菌株,以及构建了含有pqq基因簇的pCH15质粒。本文通过采用平板溶磷、钼锑抗比色法、HPLC法、温室接种盆栽等试验,分析研究导入R. aquatilis HX2菌株中的pqq基因簇的DH5α(pqq)菌株溶磷促生结果分析,明确DH5α(pqq)菌产酸溶解矿质磷促生机理,为进一步明确采用pqq基因簇改造E. coli DH5α及其他细菌可能成为植物促生菌株提供技术理论依据。
1 材料与方法 1.1 供试菌株及培养基 1.1.1 供试菌株、质粒E. coli DH5α[14],及含有R. aquatilis HX2菌株中的pqq基因簇的质粒pCH15[13]。各供试菌株和质粒特征见表 1。
国际植物研究所磷酸盐生长培养基(NBRIP)[15, 16]:葡萄糖10 g,磷酸三钙(Ca3(PO4)2)5 g,六水氯化镁(MgCl2 · 6H2O)5 g,七水硫酸镁(MgSO4·7H2O)0.25 g,氯化钾(KCl)0.2 g,硫酸铵((NH4)2SO4)0.1 g,蒸馏水1 000 mL,pH 7.0。
NBRIP固体培养基:在NBRIP液体培养基中加入琼脂16~18 g·L-1,其他成分不变。
Luria-Bertani(LB)液体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠(NaCl)10 g,蒸馏水1 000 mL,pH 7.0。
LB固体培养基:在LB液体培养基中加入琼脂16~18 g·L-1,其他成分不变。
无磷元素的Hoagland营养液[17]:硝酸钙(Ca(NO3)2)945 mg·L-1,硝酸钾(KNO3)607 mg·L-1,七水硫酸镁(MgSO4·7H2O)493 mg·L-1,铁盐溶液2.5 mL·L-1(七水硫酸亚铁(FeSO4·7H2O)2.78 g,乙二胺四乙酸二钠(EDTA)3.73 g,蒸馏水500 mL,pH 5.5)。
1.2 实验方法 1.2.1 DH5α(pqq)菌株的获取将含有HX2菌株中pqq基因簇的质粒pCH15,采用热击和转化的方法[18],导入感受态E. coli DH5α细胞,将其加入含有四环素(Tc)20 μg·mL-1的LB固体培养基上,37 ℃培养,筛选并获得DH5α(pqq)菌株,放入冰箱保存。
1.2.2 溶磷平板定性检测将E. coli DH5α、DH5α(pqq)接种活化后,以0.1%接种量分别接种于含有5 mL LB液体培养基的试管中,37 ℃、170 r·min-1摇培,制备成108 CFU·mL-1的菌悬液。无菌操作下将灭菌的滤纸片(直径=5 mm)放于NBRIP固体培养基平板中央,分别吸取10 μL各菌株处理的菌悬液点接于滤纸片上,吹干。将E. coli DH5α、DH5α(pqq)处理的所有平板在37 ℃生化培养箱中培养7 d,然后观测每个处理的溶磷圈,并测量其直径。每个处理重复3次。
1.2.3 有效磷定量、pH检测将E. coli DH5α、DH5α(pqq)活化后,分别制成108 CFU·mL-1菌悬液,以0.1%接种量接种到100 mL NBRIP培养基的锥形瓶中,37 ℃、170 r·min-1摇培,无菌操作下将所有处理样品于第1、3、5、7 d分别抽取1 mL菌液,将菌液以12 000 r·min-1、4 ℃离心5 min,留上清液放入-20 ℃冰箱中保存待测。溶磷定量测定方法参照钼锑抗比色法[19, 20],每个样品重复3次。此外无菌操作下将所有处理样品于第1、3、5、7 d分别取2 mL菌悬液,将培养液以12 000 r·min-1、4 ℃离心5 min,取上清液,并将上清液放在10 mL塑料管中,完成取样后,立即用pH计检测pH值,并记录数值,进行数据分析。每个样品重复3次。
1.2.4 有机酸检测试验方法在参照文献[16]HPLC法检测细菌产有机酸的基础上做了修改。E. coli DH5α、DH5α(pqq)接种于NBRIP培养基中,在37 ℃、170 r·min-1中进行摇培,摇培5 d。从每个样品中抽取1 mL菌悬液,12 000 r·min-1、4 ℃离心5 min,留上清液,通过0.22 μm 微孔滤膜过滤后,保存-20 ℃冰箱中备用。采用葡萄糖酸、柠檬酸、乳酸、琥珀酸、丙酸5种有机酸(色谱纯)作为标样,将样品进行液相色谱分析(高效液相色谱仪waters 2998,色谱柱:Agilent Zorbax SB-C18 250 mm×4.6 mm,5 μm),流动相为0.5%磷酸氢二铵(pH 2.81),进样量20 μL,流速0.4 mL·min-1,室温下214 nm处测量UV的吸收值,绘制标准曲线,计算样品中的各种有机酸的含量。每个样品重复3次。
1.2.5 溶磷效果温室实验将E. coli DH5α、DH5α(pqq)分别以0.1%的接种量接种于LB液体培养基的三角瓶中,37 ℃、170 r·min-1摇培48 h,得到浸种拌土的菌悬液;CK对照为LB液体培养基;配制无磷元素的Hoagland营养液。将采集的砂和土过2 mm的筛分装高温灭菌,准备180 mm × 160 mm规格的塑料花盆,每盆盛放混合好的砂土基质1.5 kg(砂∶土=1∶1,W/W),盛放前每个花盆基质分别均匀拌入7.5 g磷酸钙、各处理菌液100 mL及20 mL 配好的无磷的Hoagland营养液。选择玉米种子,放入75%的酒精消毒30 s,并用无菌水冲3次,放入灭菌的培养皿中进行催芽2~3 d,挑选一致的催芽种子浸种3 h,每盆埋入3粒种子,埋好后浇10 mL无菌水;采用完全随机设计摆放,重复9次,定期定量浇无菌水。出苗后间苗,每盆留1株,玉米苗生长42 d后收获,测定玉米株高,称取鲜重、干重(地上部分和根),采用钒钼黄吸光光度法测定植株磷含量、NaHCO3浸提钼锑抗吸光光度法测定土壤有效磷含量[21]。
1.2.6 数据处理分析本实验数据以平均值为依据,数据分析采用EXCEL软件、SPSS软件(Version 11.5,USA)进行数据处理及方差分析。
2 结果与分析 2.1 溶磷及pH值的影响分析导入pqq基因簇的DH5α(pqq)菌株产生的溶磷圈直径为19.8 mm,而E. coli DH5α的为12.3 mm,溶磷圈直径相比增加了7.5 mm。两者之间存在显著性差异(P<0.05)(表 2)。此外,DH5α、DH5α(pqq)菌株在NBRIP培养基上培养前3 d,有效磷的浓度逐渐增加,pH值逐渐降低;培养3 d后,有效磷的浓度及pH值趋于稳定(图 1)。溶磷定量分析表明(表 2),DH5α(pqq)菌株产生较高的有效磷浓度,为416.96 mg·L-1,是E. coli DH5α产生的有效磷浓度(106.46 mg·L-1)的4倍左右,DH5α(pqq)菌株的pH 值从最初的6.15降到3.62,低于DH5α菌株所产生的pH值(4.74)。两菌株产生有效磷浓度、pH值之间均表现出显著性差异显著。导入pqq基因簇的DH5α(pqq)溶解矿质磷的能力显著增强。
 |
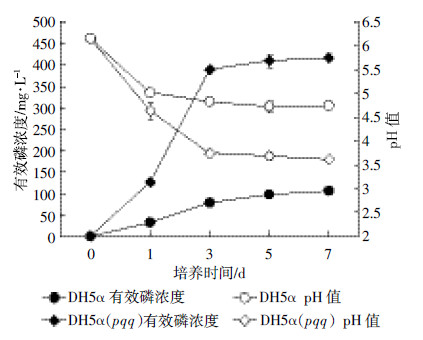
|
| 图 1 不同处理下培养基pH 值及有效磷的变化 Figure 1 Changes on pH and soluble-P of NBRIP in different treatments |
DH5α(pqq)、E. coli DH5α在NBRIP中培养,溶磷代谢产2种酸,即葡萄糖酸和琥珀酸(图 2)。DH5α(pqq)、E. coli DH5α处理分别产生总有机酸为8.67、0.69 g·L-1,处理之间呈显著性差异(图 3)。DH5α(pqq)、E. coli DH5α处理分泌的葡萄糖酸浓度分别占有机酸的浓度的99.3%、88.4%。结果表明导入pqq基因簇后,DH5α(pqq)有机酸代谢明显增加,以产葡萄糖酸为主。
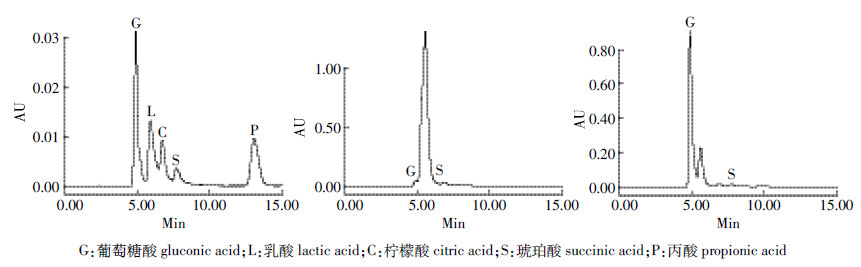
|
| 图 2 DH5α(pqq)、大肠杆菌DH5α产有机酸色谱图 Figure 2 Chromatogram of organic acids produced by DH5α(pqq)and DH5αstrains in NBRIP |
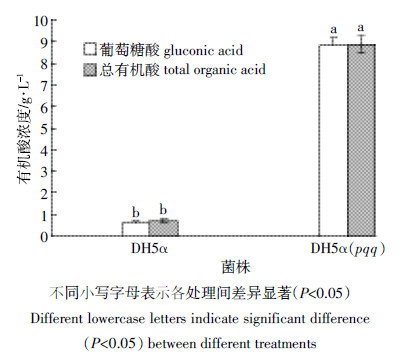
|
| 图 3 不同处理下培养基葡萄糖酸和总有机酸浓度 Figure 3 Concentration of gluconic acid and total organic acid for NBRIP in different teatments |
DH5α(pqq)处理对玉米株高、茎鲜重、植株鲜重、茎干重、植株干重、全磷、土壤有效磷比LB(对照)培养基分别提高了5.2%、30.0%、32.5%、18.5%、7.7%、30.8%和24.0%(表 3);该处理在茎干重、植株干重、全磷、土壤有效磷方面与LB培养基相比有显著性差异。然而,经过E. coli DH5α接种处理过的玉米株高、茎鲜重、植株鲜重、茎干重、植株干重、全磷、土壤有效磷比对照培养基分别降低了33.2%、 62.8%、64.0%、48.1%、58.9%、23.1% 和24.8%,并有显著性差异。DH5α(pqq)处理与LB培养基相比促进了植物的生长,在玉米株高、茎鲜重、植株鲜重、茎干重、植株干重、全磷、土壤有效磷均有了增加。然而,E. coli DH5α处理与对照培养基相比,反而抑制了玉米的生长。导入pqq基因簇的DH5α(pqq)处理增加土壤有效磷含量,增强了植物对磷的吸收,促进了玉米的生长。
 |
溶磷菌溶解矿质磷的主要机制是经在细胞质膜外部发生直接氧化反应产生有机酸,并且伴随pH值的下降,导致磷的溶解[22, 23]。细菌溶解矿质磷在细菌的溶磷机理中与碳源相关,溶磷微生物能分泌有机酸如葡萄糖酸、酮戊二酸、柠檬酸、草酸、苹果酸、琥珀酸等[7, 16, 24]。Goldstein[25]提出,把葡萄糖直接氧化成葡萄糖酸是革兰氏阴性菌的矿质磷酸盐溶解的一个主要作用机制。除此之外,目前已有研究特定的革兰氏阴性菌由于缺少pqq基因簇,没有能力溶解难溶性磷[26]。本试验中,把HX2菌株中的pqq基因簇导入E. coli DH5α,获取DH5α(pqq)菌株,能分泌更多的有机酸,特别是以产葡萄糖酸为主,与E. coli DH5α相比,从溶磷的定性、定量结果表明均有更强的溶解矿质磷能力。进一步验证了在DH5α(pqq)中有pqq的基因表达,且具有活性,可能是导致PQQ的产生,激活了细菌体内的葡萄糖脱氢酶(glucose dehydrogenase,GDH),两者的共同作用促进了葡萄糖酸的外泌,加速了对矿质磷的溶解[7, 27, 28]。当然,PQQ和GDH对DH5α(pqq)菌株溶磷作用机理有待于做进一步深入研究。
已有相关报道溶磷菌如Serratia marcescens、Pseudomonas fluorescens和Bacillus spp.均有对植物促生作用[29, 30, 31]。本试验中DH5α(pqq)菌株处理的玉米与DH5α、对照处理相比,提高植株全磷和土壤有效磷的含量,增强了植物对磷的吸收,促进了玉米的生长。其主要的原因就是DH5α(pqq)菌株能分泌葡萄糖酸,使更多的难溶磷变成可溶性的磷,促进植株的摄入提高玉米植株的生长,更进一步阐述了其溶解矿质磷机理及促进农作物玉米的促生效果。
Rodríguez等[32] 研究报道了导入pqq基因的Burk-holderia cepacia IS-16 和假单胞菌属(Pseudomonas sp)两个菌株能增强矿质磷酸盐溶解表型,促进对磷的溶解。本文采取转化的方法把R. aquatilis HX2菌株中的pqq基因簇导入E. coli DH5α,改造E. coli DH5α并高效表达,获得DH5α(pqq)菌株,使其具有植物促生菌的相关功能特性,丰富了植物促生菌的构建模式,本文采用的方法为后续改造其他植物促生菌获得溶磷性状提供了新的路径和方法。
4 结论通过导入pqq基因簇的DH5α(pqq)菌株溶磷促生分析表明,说明来自R. aqautilis的pqq基因簇通过异源表达具有生物活性,实现了E. coli DH5α的植物促生菌的遗传改造。DH5α(pqq)菌株溶解矿质磷的机制取决于转化R. aqautilis的pqq基因簇后,实现了葡萄糖高效代谢为葡萄糖酸,并溶解土壤难溶磷,增加土壤有效磷含量,提高植株玉米对磷的吸收,促进了玉米的生长。
| [1] | Zaidi A, Khan M S, Ahemad M, et al. Recent advances in plant growth promotion by phosphate-solubilizing microbes[M]. Microbial Strategies for Crop Improvement, Berlin:Springer, 2009:23-50. |
| [2] | Nadeem S M, Naveed M, Zahir A Z, et al. Plant-microbe interactions for sustainable agriculture:Fundamentals and recent advances[M]. Plant Microbe Symbiosis:Fundamentals and Advances, Berlin:Springer, 2013:51-84. |
| [3] | 焦子伟, 吴文良, 郭岩彬. 不同碳源条件下GDH对植物促生菌HX2溶解矿质磷影响的研究[J]. 新疆农业科学, 2015, 52(2):268-274. JIAO Zi-wei, WU Wen-liang, GUO Yan-bin. Effect of glucose dehydrogenase on mineral phosphate solubilization with different carbon sources in Rahnella aquatilis HX2[J]. Xinjiang Agricultural Sciences, 2015, 52(2):268-274. (in Chinese) |
| [4] | 陈凡. 水生拉恩氏菌HX2菌株防治葡萄根癌病的初步研究[D]. 北京:中国农业大学, 2007. CHEN Fan. Primary studies on biological control of grapevine crown gall by Rahnella aquatilis HX2[D]. Beijing:China Agriuclture University, 2007. (in Chinese) |
| [5] | Ogut M, Er F, Kandemir N. Phosphate solubilization potentials of soil Acinetobacter strains[J]. Biology and Fertility of Soils, 2010, 46:707-715. |
| [6] | Chaiharn M, Lumyong S. Screening and optimization of indole-3-acetic acid production and phosphate solubilization from rhizobacteria aimed at improving plant growth[J]. Current Microbiology, 2011, 62:173-181. |
| [7] | Kim C H, Han S H, Kim K Y, et al. Cloning and expression of pyrroloquinoline quinone(PQQ) genes from a phosphate-solubilizing bacterium Enterobacter intermedium[J]. Current Microbiology, 2003, 47:457-461. |
| [8] | Holscher T, Gorisch H. Knockout and overexpression of pyrroloquinoline quinone biosynthetic genes in Gluconobacter oxydans 621H[J]. Journal of Bacteriology, 2006, 188:7668. |
| [9] | Li Lei, Jiao Ziwei, Lauren hale, et al. Disruption of gene pqqA or pqqB reduces plant growth promotion activity and biocontrol of grown gall disease by Rahnella aquatilis HX2[J]. PLOS ONE, 2014, 9(12):1-16. |
| [10] | Neijssel O M. PQQ-linked enzymes in enteric bacteria[J]. Microbiology Science, 1987(4):87-90. |
| [11] | Duine J A, Jongejan J A. Enzyme with pyrroloquinoline quinine as cofactor[J]. Annual Review of Biochemistry, 1989, 187:213-219. |
| [12] | De Jonge R, De Mattos M J T, Stock J B, et al. Pyrroloquinoline quinone, a chemotactic attractant for Escherichia coli[J]. Journal Bacteriology, 1996, 178:1224-1226. |
| [13] | Guo Y B, Li J, Li L, et al. Mutations that disrupt either the pqq or the GDH gene of Rahnella aquatilis abolish the production of an antibacterial substance and result in reduced biological control of grapevine crown gall[J]. Applied and Environmental Microbiology, 2009, 75, 6792. |
| [14] | Hanahan D. Studies on transformation of Escherichi coli with plasmid[J]. Journal of Molecular Biology, 1983, 166:557-580. |
| [15] | 黄鹏飞, 刘君昂, 靳爱仙, 等. 马尾松根际土壤溶磷菌分离筛选、鉴定及其溶磷效果研究[J]. 中国农学通报, 2012, 28(19):12-16. HUANG Peng-fei, LIU Jun-ang, JIN Ai-xian, et al. Isolation and screening, identification of phosphorus-solubilizing bacteria in rhizosphere soil of Pinus massonuana and its phosphate-degradation capacity[J]. Chinese Agricultural Science Bulletin, 2012, 28(19):12-16. (in Chinese) |
| [16] | Yi Y, Huang W, Ge Y. Exopolysaccharide:A novel important factor in the microbial dissolution of tricalcium phosphate[J]. World Journal Microbiology and Biotechnology, 2008, 24:1059-1065. |
| [17] | Hoagland D R, Arnon D I. The water culture method for growing plants without soil[J]. California Agricultural Experiment Station Circular, 1950, 347:1-39. |
| [18] | 李磊. 水生拉恩氏菌HX2菌株pqqA-F基因簇生物学功能的初步研究[D]. 北京:中国农业大学, 2009. LI Lei. Preliminary study on functions of the pqqA-F gene cluster in Rahnella aquatilis strain HX2[D]. Beijing:China Agriuclture University, 2009.(in Chinese) |
| [19] | Murphy J, Riley J P. A modified single solution method for the determination of phosphate in natural waters[J]. Analytica Chimica Acta, 1962, 27:31-36. |
| [20] | Behbahani M. Investigation of biological behavior and colonization ability of Iranian indigenous phosphate solubilizing bacteria[J]. Scientia Horticulturae, 2010, 124:393-399. |
| [21] | 崔建宇, 陈范骏, 朱洪群. 土壤、植物与环境分析实验[M]. 北京:中国农业大学自编教材, 2007. CUI Jian-yu, CHEN Fan-jun, ZHU Hong-qun. Soil, plants and environmental analysis experiment[M]. Beijing:China Agriuclture University, 2007.(in Chinese) |
| [22] | Rashid M, Khalil S, Ayub N, et al. Organic acids production and phosphate solubilization by phosphate solubilizing microorganisms(PSM)under in vitro conditions[J]. Pakistan Journal of Biological Sciences, 2004(7):187-196. |
| [23] | Pradhan N, Sukla L. Solubilization of inorganic phosphates by fungi isolated from agriculture soil[J]. Africal Journal of Biotechnology, 2009(5):850-854. |
| [24] | Patel D K, Archana G, Kumar G N. Variation in the nature of organic acid secretion and mineral phosphate solubilization by Citrobacter sp. DHRSS in the presence of different sugars[J]. Current Microbiology, 2008, 56:168-174. |
| [25] | Goldstein A H. Involvement of the quinoprotein glucose dehydrogenase in the solubilization of exogenous phosphates by gram-negative bacteria[M]//Torriani-Gorini A, Yagil E, Silver S. Phosphate in microorganisms:cellular and molecular biology. Washington, DC:ASM Press, 1994, 197-203. |
| [26] | Vikram A, Alagawadi A R, Krishnaraj P, et al. Transconjugation studies in Azospirillum sp. negative to mineral phosphate solubilization[J]. World Journal of Microbiology Biotechnology, 2007, 23:1333-1337. |
| [27] | Goldstein A H. Recent progress in understanding the molecular genetics and biochemistry of calcium phosphate solubilization by gram negative bacteria[J]. Biology Agriculture Horticulture, 1995, 12:185-193. |
| [28] | 陈哲, 吴敏娜, 秦红灵, 等. 土壤微生物溶磷分子研究进展[J]. 土壤学报, 2009, 46(5):925-931. CHEN Zhe, WU Min-na, QIN Hong-ling, et al. Advances in research on molecular mechanisms of phosphate solubilizing microorganisms in soil[J]. Acta Pedologica Sinica, 2009, 46(5):925-931. (in Chinese) |
| [29] | Dey R, Pal K, Bhatt D, et al. Growth promotion and yield enhancement of peanut(Arachis hypogaea L.) by application of plant growth-promoting rhizobacteria[J]. Microbiological Research, 2004, 159:371-394. |
| [30] | Sahin F, Cakmakci R, Kantar F. Sugar beet and barley yields in relation to inoculation with N2-fixing and phosphate solubilizing bacteria[J]. Plant Soil, 2004, 265:123-129. |
| [31] | Hameeda B, Harini G, Rupela O, et al. Growth promotion of maize by phosphate-solubilizing bacteria isolated from composts and macrofauna[J]. Microbiological Research, 2008, 163:234-242. |
| [32] | Rodríguez H, Gonzalez T, Selman G. Expression of a mineral phosphate solubilizing gene from Erwinia herbicola in two rhizobacterial strains[J]. Journal of Biotechnology, 2000, 84:155-161. |
 2016, Vol. 33
2016, Vol. 33





