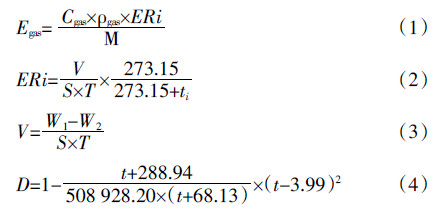文章信息
- 胡茂俊, 刘新红, 高岩, 易能, 张振华, 张力, 王栋, 严少华
- HU Mao-jun, LIU Xin-hong, GAO Yan, YI Neng, ZHANG Zhen-hua, ZHANG Li, WANG Dong, YAN Shao-hua
- 城市污水的微生物-植物联合修复对水体N2O、N2和O2释放的影响
- Effect of Microorganism-plant Joint Remediation on N2O, N2 and O2 Release Flux from Polluted Waters in Urban River
- 农业资源与环境学报, 2016, 33(1): 35-42
- Journal of Agricultural Resources and Environment, 2016, 33(1): 35-42
- http://dx.doi.org/10.13254/j.jare.2015.0190
-
文章历史
- 收稿日期: 2015-08-11
2. 江苏省农业科学院农业资源与环境研究所, 江苏南京 210014;
3. 国家重点实验室培育基地江苏省食品质量安全重点实验室, 江苏南京 210014;
4. 无锡中科活力生物技术有限公司, 江苏无锡 214000
2. Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
3. Key Lab of Food Quality and Safety of Jiangsu Province, State Key Laboratory Breeding Base, Nanjing 210014, China;
4. Wuxi Zhongke Huoli Bio-technology Co Ltd, Wuxi 214000, China
城市河道不仅是重要的人文景观,更对城市小气候起着重要的调节作用。然而近年来,城市河道污染问题随着城市的发展变得日益严峻。据统计,我国141个国控城市河段中有63.8%的河段水质属于Ⅳ类或者劣Ⅴ类水质[1],城市河道污染往往伴随着生态系统混乱,水体黑臭严重影响城市景观和社会环境[2, 3]。城市河道受城市人居生活的影响,经常引起氮素过量输入,而氮素过量是造成水体污染的重要因素,极易引发藻类大量繁殖造成水华,影响水体水质[4]。
为了净化水体,采用微生物菌剂及植物修复的方式成为研究热点。研究表明微生物菌剂和水生植物均能够通过本身同化水体富余氮素来实现水体净化[5]。微生物制剂如光合细菌[6, 7]、芽孢杆菌[7]、硝化反硝化细菌[8, 9]等在富营养化水体修复以及养殖水体中对水体中富营养物质具有很强的净化作用,而且具有安全可靠、廉价和易操作等特点[10, 11]。水生植物如凤眼莲的种植能够脱除水体富余氮素,据研究,在N负荷较高的水体(Ⅲ、Ⅳ类水质)中,凤眼莲种植最高可以实现42%的水体氮去除率[12, 13]。单独使用微生物菌剂或者水生植物对严重富营养化的城市河道的净化均有一定的局限性,因此,将微生物菌剂净化和水生植物净化联合起来实现污染水体净化具有重要意义。
经作者长期监测发现自然水体中释放的气体主要有N2、O2、N2O等。其中N2是反硝化作用的主要产物,是实现富营养化水体绿色脱氮的重要途径,也是水体脱氮效果的重要指标[14],O2释放对环境有重要的调节作用[15],N2O是引起大气温室效应的重要成分[16]。研究N2、O2、N2O释放特征对水体富营养化与大气环境等研究有重要影响[17, 18]。
在微生物菌剂或者水生植物净化富营养化水体的过程中,微生物菌剂在同化水体富余氮素的同时,可能参与硝化反硝化过程并促进N2、N2O气体的释放;大型水生植物根系存在可能与水体硝化反硝化细菌的共生关系,促进水体N2、N2O气体的产生[16, 19]。另一方面,微生物菌剂和水生植物本身生长需要同化水体氮素,从而阻止水体氮素进入硝化反硝化途径,并抑制N2、N2O气体的产生;而微生物及水生植物在水体的生长可能与水体藻类产生竞争关系[20],从而抑制水华产生并影响水体光合作用释放O2。然而微生物菌剂及水生植物净化方式在净化污染河道水体过程中,水体N2、O2、N2O释放特征是什么?由于研究手段的限制,这个问题还没有开展深入研究。
水体释放气体的研究方法有漂浮箱法、乙炔抑制法以及膜质谱仪法等等[21]。漂浮箱法是将中空且无底的箱体罩于水面上,箱内留存一定量的顶空。然后分时间段采集箱内的气体,对气体的成分进行分析并计算气体释放的通量[22],目前仅用于温室气体如甲烷及N2O气体的研究,由于无法避免空气中高含量氮气的污染,还不能应用于N2和O2的研究;此外,漂浮箱法获取水体气体释放通量往往是即时的数据,而用即时数据来代表一段时间内(如1 d)的平均释放通量往往存在一定的偏差。乙炔抑制法以及膜质谱仪法是研究水体反硝化速率的常见方法,但研究表明乙炔抑制法抑制反硝化产生N2的过程;膜质谱仪法仅测定水体溶解性气体而忽略冒泡气体,因此这两种方法均可能低估水体氮气的释放速率[23]。本研究室自主研发了水体气体释放原位采集装置,该装置是将集气装置直接放置在水面上收集水体释放的气体,然后用气相色谱仪对气体的成分进行分析,并根据气体体积和气体来计算各气体成分的释放通量。该方法已经验证是可靠的,氮气回收率达到99.8%[24, 25]。
本研究采用自主研发的水体气体释放原位自动监测设施[26],对典型城市污染河道水体释放的气体N2O、N2及O2释放进行原位收集研究,旨在研究微生物菌剂和水生植物联合净化过程中两种净化措施对水体气体释放的影响,为生物途径净化城市污染水体的技术提供理论基础和数据支持。
1 材料方法 1.1 试验污水池塘实验池塘为江苏省农科院内类似的1#和2#蓄水塘,其中1#塘作为处理池塘,2#塘作为对照池塘。2个池塘位于南京市东郊,水深均在1.5~2.5 m之间。水源地位于紫金山,流经居民生活区并汇聚为蓄水塘,是附近农田灌溉的主要水体,水体主要来源为降雨、紫金山体径流水和流域内生活污水。受灌溉和气候影响,水体主要理化指标变化较大,监测水体氨氮浓度为1.8~9.5 mg·L-1,总氮(TN)为5.5~18.6 mg·L-1、总磷(TP)为0.42~1.57 mg·L-1,pH值为6.9~8.2,溶氧(DO)为7.4~13.7 mg·L-1。实验前期两水塘水体主要参数没有显著性差异(r=0.99,P<0.01)。
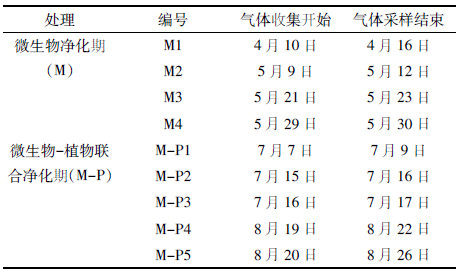
1.2 试验设计试验期间,微生物净化试验以及微生物-水生生物联合净化试验均设在1#塘内进行,2#塘水体为河道原状水不做任何处理。2个水体各类样品采集点均设在2个池塘的中间位置,并错开水道中心,设4个重复。试验分2个时期:微生物菌剂处理期及微生物-水生植物联合净化期,各个时期水体气体释放的采样周期如表 1所示。水体样品的理化指标在气体样品采集结束后立即采集。水样、气样样品在1#塘和2#塘均同时采集。
水体净化所用微生物菌剂为球状红细菌(Rhodo-bactersphaeroides)和芽孢杆菌混合菌剂,有效活菌含量≥5亿·cm-2。微生物菌剂施用方式为笼状挂膜固化技术。菌剂产品及施用技术均由无锡中科活力生物技术有限公司提供。试验于2014年4月8日正式开始,将浸泡有菌剂的笼状膜挂于水体表层0~50 cm位置。监测时间段为2014年4月10日—5月30日。
1.3.2 微生物-水生植物联合净化水体实验方法在原微生物净化水体中,增加水生植物净化设计。水生植物采用凤眼莲为植物材料,在1#塘内设正方形的3个围栏,边长25 m,均匀分布在水面上游、中游和下游,总覆盖面积达1 875 m2,水面覆盖率约为22%。在围栏内种植凤眼莲,种植方式为围栏控制性种养和定期采收,保持总生物量在20 kg·m-2左右。实验监测期为水葫芦移苗后正常生长的2014年7月7日—8月26日。
1.3.3 气体释放原位采集方法水体原位释放气体采用自主研发的水体气体释放原位采集装置进行采集。装置的详细情况参考文献[26]。本实验中,水体气体样品采集位置为水体表层(0~50 cm),因此,将该水体气体释放装置放置于水面上收集水体表层释放气体。
1.4 样品分析方法收集到的水体释放的气体样品的成分及各自的浓度采用岛津 GC2010 气相色谱仪进行测定,测定方法及参数参照文献[24]。气体释放通量计算方法参照文献[25]。每种组分气体的释放通量计算方法为:
Egas为单一气体的释放通量(mol·m-2·h-1);Cgas为气相色谱测定气体体积百分数;ρ为标准温度标准压力下特定气体的密度:ρ(N2)为1.25 g·L-1,ρ(N2O)为1.96 g·L-1,ρ(O2)为1.429 g·L-1;ERi为标准温度标准压力下水体释放气体的速率(mL·m-2·h-1);M为气体摩尔质量(g·moL-1);V为收集得到总的气体体积(mL);S为集气罩所覆盖水体的面积(m2);T是收集气体所用时间(h);ti为收集气体过程中的平均温度(℃);W1为试验开始前装满水的集气瓶重量(g);W2为收集气体结束后集气瓶的重量(g);D为室温(0≤t≤50 ℃)下水的密度(g·mL-1)。
NH4+-N浓度采用纳氏试剂光度法测定;NO2--N浓度采用N-(1-萘基)-乙二胺光度法测定;NO3--N浓度使用紫外分光光度法测定;总氮(TN)浓度使用过硫酸钾氧化-紫外分光光度法测定[27];水温及溶解性氧(DO)使用多功能水质测定仪(YSI Pro Plus,USA)测定。
1.5 统计分析采用Excel 软件和Sigmaplot 12.0 软件对数据进行整理作图。采用SPSS18.0软件对数据进行方差分析和相关性分析。
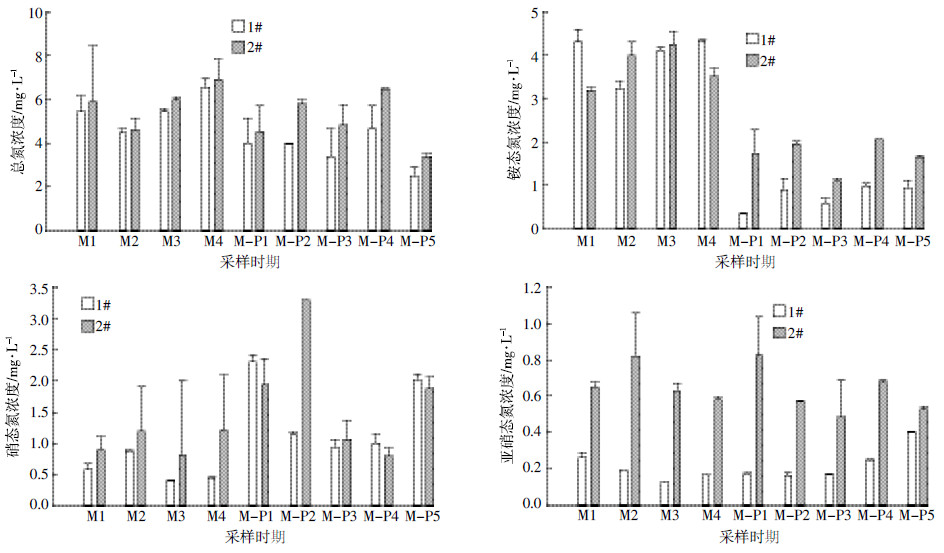
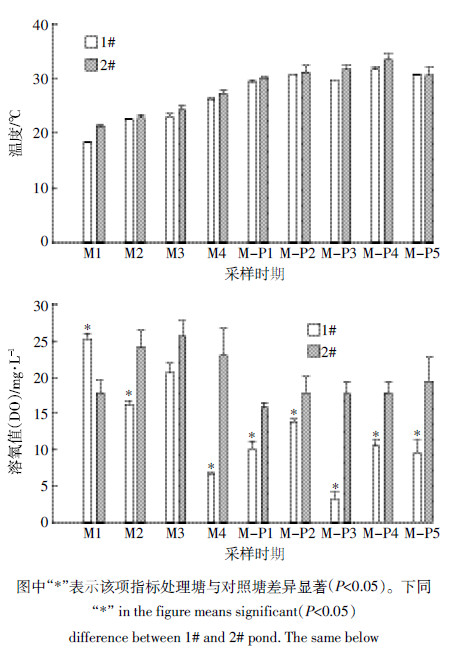
2 结果与分析 2.1 净化试验中水体主要理化指标变化趋势不同净化方式净化水体期间2个池塘水体的氮相关营养盐变化趋势如图 1所示。微生物菌剂净化水体期间,处理塘水体铵态氮含量平均为4.00 mg·L-1,与对照塘相比差异不显著;处理塘硝态氮含量平均为0.58 mg·L-1,相对于对照塘降幅为43.69%,差异显著;处理塘亚硝态氮含量平均为0.19 mg·L-1,相对于对照塘降幅为71.64%,显著低于对照塘;处理塘总氮含量平均为5.49 mg·L-1,相对于对照塘降幅为5.94%,差异显著。微生物-植物联合净化水体期间,处理塘水体铵态氮平均含量为0.75 mg·L-1,相对于对照塘降幅为55.62%,显著低于对照塘;处理塘硝态氮含量平均为1.58 mg·L-1,与对照塘相比差异不显著;处理塘亚硝态氮含量平均为0.23 mg·L-1,相对于对照塘降幅为62.90%,显著低于对照塘;处理塘总氮含量平均为3.68 mg·L-1,相对于对照塘降幅为22.55%,显著低于对照塘。微生物净化期间水体温度平均为22.56 ℃,微生物-植物联合净化期间水体温度平均为30.48 ℃,两个时期1#塘温度与2#塘均无显著性差异(表 2)。微生物净化期处理塘水体溶氧平均为17.17 mg·L-1,与对照塘差异不显著;微生物-植物联合净化期处理塘水体溶氧平均为9.49 mg·L-1,显著低于对照塘(表 2)。
|
| 图 1 水体净化期间2 个实验池塘水体营养盐浓度变化趋势 Figure 1 Main nutrients characteristics in two ponds during two different remediation periods |
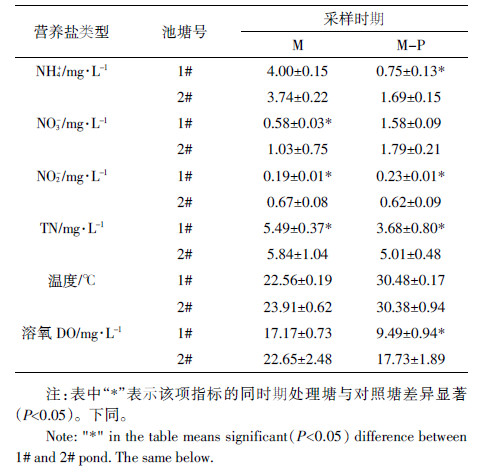 |
此外,从两种净化方式对比来看,处理塘(1#塘)铵态氮微生物-植物联合净化期时期(M-P)相对于微生物净化期时期(M)降幅为81.25%,对照塘M-P期铵态氮相比于M期降幅为54.81%,处理塘降幅显著高于对照塘降幅(P<0.01)。处理塘硝氮含量M-P期相对M期增幅为172.41%,对照塘硝氮含量M-P期相对M期增幅为73.79%,处理塘增幅显著高于对照塘(P<0.01)。处理塘总氮含量M-P期与M期相比,下降了32.97%,对照塘总氮含量在整个监测期没有显著差异,处理塘总氮降幅优于对照塘。水体溶氧含量处理塘M-P期显著低于M期(图 2),降幅为44.73%,对照塘两个时期的降幅为21.72%,处理塘降幅显著高于对照塘降幅(P<0.05)。但是M期和M-P期两个时期亚硝态氮含量的降幅,两个池塘差异不显著。总的来看,M-P净化方式明显优于M净化方式。
|
| 图 2 水体净化期间2 个试验池塘水体温度及溶氧变化趋势 Figure 2 Temperature and dissolved oxygen(DO)characteristics in two ponds during two different remediation periods |
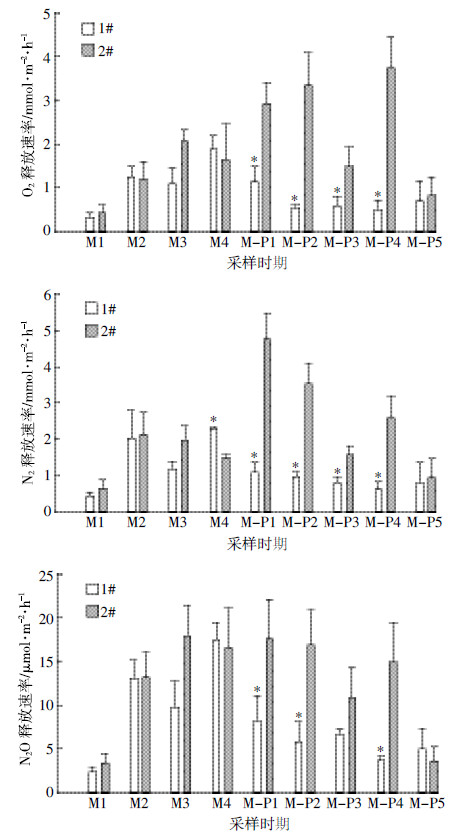
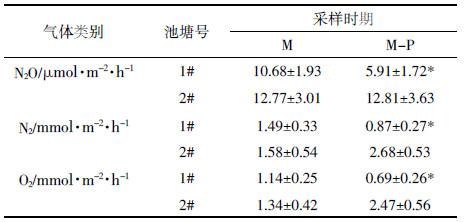
水体净化过程中,水体气体释放速率如图 3所示。氧化亚氮释放速率在微生物菌剂净化期间均值为10.68 μmol·m-2·h-1,与对照塘相比降低16.37%,但差异不显著;微生物-植物联合净化期均值为5.91 μmol·m-2·h-1,与对照池塘相比降低53.86%,差异显著。氮气释放速率在微生物菌剂净化期间均值为1.49 mmol·m-2·h-1,与对照塘相比降低5.70%,差异不显著;微生物-植物联合净化期间均值为0.87 mmol·m-2·h-1,与对照池塘相比降低67.54%,差异显著。氧气释放速率在微生物菌剂净化期间均值为1.14 mmol·m-2·h-1,与对照塘相比降低14.93%,差异不显著;微生物-植物联合净化期均值为0.69 mmol·m-2·h-1,与对照池塘相比显著降低,降幅为72.06%(表 3)。
|
| 图 3 微生物-植物联合净化期间2 个试验池塘水体气体释放速率变化趋势 Figure 3 Gas releasing characteristics in two ponds during two different remediation periods |
 |
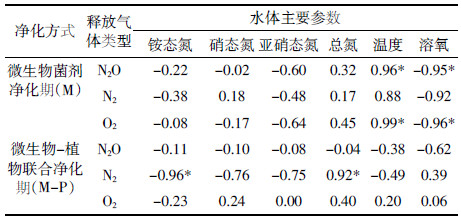
对各种气体释放速率与水体主要参数进行相关性分析,结果如表 4所示。微生物菌剂净化期间,水体营养盐(NH4+、NO3-、NO2-及TN)浓度与N2O、N2及O2气体释放速率均不存在显著的相关关系(n=4,P>0.05);N2O和O2释放速率与水体温度均呈极显著正相关关系(n=4,P<0.01),与溶氧呈极显著负相关关系(n=4,P<0.01),N2释放速率与水体温度及溶氧的相关系数分别为0.88(n=4,P=0.12)及-0.92(n=4,P=0.08),相关性接近显著性水平。微生物-植物联合净化期间,温度、溶氧与N2O、N2及O2气体释放速率均不存在显著的相关关系(n=5,P>0.05)。3种气体释放速率与营养盐浓度的相关关系各不相同:N2的释放速率与铵态氮浓度呈极显著负相关关系(r=-0.96,P<0.01),与总氮浓度呈极显著正相关关系(r=0.92,P<0.01),与硝态氮和亚硝态氮的含量的相关系数分别为-0.76(P=0.13)和-0.75(P=0.15),相关性均没有达到显著水平;O2和N2O的释放速率与各营养盐浓度的相关性均不显著。
 |
罗勇胜等[7]研究发现,光合细菌与芽孢杆菌的协同净化对水体氨氮和硝氮的平均降解率达到35.38%和81.05%。高岩等[28]研究发现微生物菌剂能够用于城市污染水体的净化,水体氮含量及叶绿素浓度降低,效果良好。本文研究结果基本与前人相同,使用微生物菌剂后,目测水体透明度明显提高,藻类浓度降低;水体NO3-、NO2-及TN的含量降低,但与对照塘相比,TN的降低幅度仅有5.94%,而且水体NH4+的含量没有显著性降低,这与前人研究结论略有不同。这可能是因为本研究中城市重污染河道水体污染较重,以较高浓度的铵态氮为主,微生物对水体污染物去除的贡献有限,也可能是微生物部分菌体死亡分解释放大量的NH4+[29]。
微生物菌剂的使用降低水体富余氮素,从而抑制微生物反硝化作用产生N2及N2O[30],也抑制了藻类生长及光合作用产生O2[20],这可能是本文研究中使用微生物菌剂降低水体3种气体(N2O、N2及O2)释放速率的原因。而3种气体释放速率仅与温度呈正相关关系(表 4),这符合微生物菌剂活性特征,即温度升高促进微生物菌剂对氮素的去除,进而加速抑制水体3种气体(N2O、N2及O2)的产生[31, 32, 33]。但本文研究发现仅使用微生物菌剂对3种气体释放速率的抑制作用并没有达到显著水平,这可能是该城市河道污染较重,营养盐浓度相对于微生物净化速率处于较高的水平造成的。由此推论微生物菌剂对水体气体释放的影响可能是发生同化作用,在短期内能固定一定量的水体氮素,从而降低了水体通过硝化反硝化作用及藻类光合作用释放N2O、N2及O2的速率。
3.2 微生物菌剂-水生植物联合净化水体对气体释放的影响水生植物对水体净化的影响具有双面性,一方面可以通过同化作用降低水体富余营养盐[12],本文研究同样发现水生植物加入后的微生物-植物联合净化期水体营养盐的NH4+、NO2-及TN大幅度显著降低;另一方面水生植物可以通过自身根系附着微生物来促进水体反硝化,如高岩等[14]在实验室小水箱模拟条件下研究发现水葫芦根系附着微生物能够促进水体硝化反硝化,通过N2O的释放脱去的氮素占整个水体N消减量的1.36%,为相应未种植凤眼莲水体的4.31倍;然而本研究在野外自然富营养化水体的研究数据显示水生植物加入后水体N2O及N2气体的释放速率显著降低,即水生植物加入抑制而非增加了水体微生物反硝化作用释放N2O及N2气体;另外,水生植物加入后,目测水体透明度优良的同时,水体溶氧由超饱和状态(17.17 mg·L-1)降至正常水体溶氧水平(9.49 mg·L-1)降幅接近50%,这可能是由于水生植物对水体营养盐的同化作用抑制了水体藻类的生长及光合作用产生O2。因此,微生物-水生植物联合净化显著降低水体N2O、N2及O2的速率的机制可能是水生植物的同化作用对微生物及藻类的生长产生的营养竞争作用。根据以往研究结果,水体气体释放速率与温度是呈正相关关系,随温度升高而增加[30, 31, 34]。本研究中,微生物-植物联合净化期气体释放速率与温度没有表现出显著相关关系,这可能是由于该时期温度变异不大(图 2)。
微生物菌剂及微生物-植物联合净化方式可能对水体气体释放的影响程度不同。对处理塘的不同处理方式下水体气体释放速率进行分析结果显示:N2O、N2及O2的释放速率在温度较高的微生物-植物联合净化期均低于温度较低的微生物菌剂净化期,降幅分别为44.66%、41.61%和39.47%,扣除微生物菌剂的驯化期(即M1期)外,降幅具有显著性;相反,同期对照塘水体气体释放速率表现为在高温期明显高于低温期,但由于变异幅度较大,这种气体释放速率差异没有达到显著水平(P>0.05)。这说明与单纯微生物菌剂净化方式相比,微生物-植物联合净方式对水体净化效果更显著,对3种气体(N2O、N2及O2)释放的抑制程度更低。
4 结论微生物菌剂及微生物-植物联合净化2种净化方式在净化水体的同时均能够降低水体气体的释放速率,但微生物菌剂对水体气体释放的降幅有限或不明显。2种净化方式降低水体气体释放速率的机制可能是由于微生物菌剂或水生植物对水体富余养分具有同化作用,这种同化作用可能对微生物及藻类生长产生营养竞争作用,从而抑制了反硝化作用释放N2、N2O,降低水体溶氧及O2的释放。而且微生物-植物联合净化由于具有较强的同化作用,对气体释放的抑制作用可能高于单纯微生物菌剂净化方式。
| [1] | 国家环保总局. 1999年中国环境状况公报[R]. 2000:3-9. State Environmental Protection Administration. China environmental bulletin in 1999[R]. 2000:3-9. (in Chinese) |
| [2] | 谢红斌, 虞孝感, 张运林, 等. 太湖流域水环境演变与人类活动耦合关系[J]. 长江流域资源与环境, 2001, 10(5):393-399. XIE Hong-bin, YU Xiao-gan, ZHANG Yun-lin, et al. Preliminary study on the coincident relationship between water environment and human activity in Taihu Lake basin[J]. Resources and Environment in the Yangtze Basin, 2001, 10(5):393-399. (in Chinese) |
| [3] | 荆治严. 城市重污染河流污染特征与生态修复技术的研究[J]. 环境保护科学, 2012, 38(2):16-19. JING Zhi-yan. Study on pollution characteristics and eco-remediation technology of serious polluted watercourse in cities[J]. Environmental Protection Science, 2012, 38(2):16-19. (in Chinese) |
| [4] | 王熹, 王湛, 杨文涛, 等. 中国水资源现状及其未来发展方向展望[J]. 水污染防治, 2004(7):1-5. WANG Xi, WANG Zhan, YANG Wen-tao, et al. Shortage of water resources in China and countermeasures[J]. Water Pollution Control, 2004(7):1-5. (in Chinese) |
| [5] | 吴文卫, 杨逢乐, 李转寿, 等. 利用微生物菌剂净化城市河道水质试验研究[J]. 环境科学导刊, 2013, 32(2):63-65. WU Wen-wei, YANG Feng-le, LI Zhuan-shou, et al. A research on purifying urban river water by microbial agents[J]. Environmental Sciences Survey, 2013, 32(2):63-65. (in Chinese) |
| [6] | 王绍迁, 张恩栋, 多平平, 等. 光合细菌处理啤酒废水的研究[J]. 广东化工, 2015, 42(1):84-85. WANG Shao-qian, ZHANG En-dong, DUO Ping-ping, et al. Brewery wastewater treatment by photosynthetic bacteria[J]. Guangdong Chemical Industry, 2015, 42(1):84-85. (in Chinese) |
| [7] | 罗勇胜. 李卓佳, 杨莺莺, 等. 光合细菌与芽孢杆菌协同净化养殖水体的研究[J]. 农业环境科学学报, 2006, 25:206-210. LUO Yong-sheng, LI Zhuo-jia, YANG Ying-ying, et al. Synergism of photo-synthetic bacteria(PSB) and Bacillussp. in purification of water from aquatic farm[J]. Journal of Agro-Enviroment Science, 2006, 25:206-210. (in Chinese) |
| [8] | 尹丽, 肖小雨, 梁亮亮, 等. 一株异养硝化细菌的分离鉴定及其脱氮效果[J]. 环境科学与技术, 2014, 37(12):25-30. YIN Li, XIAO Xiao-yu, LIANG Liang-liang, et al. Isolation and denitrification characteristics of a heterotrophic nitrification bacterium[J]. Environmental Sciences and Technology, 2014, 37(12):25-30. (in Chinese) |
| [9] | 邢国伟, 李彦芹, 李凤超, 等. 一株反硝化细菌与光合细菌对养殖海水的净化效果[J]. 生物技术通报, 2014(3):151-154. XING Guo-wei, LI Yan-qin, LI Feng-chao, et al. Purification effect of a strain of denitrifying bacteria and photosynthetic bacteria in aquaculture water[J]. Biotechnology Bulletin, 2014(3):151-154. (in Chinese) |
| [10] | 李敏, 段登选, 许国晶, 等. 大薸-微生态制剂协同净化养殖池塘富营养化水体的效果[J]. 生态与农村环境学报, 2015(1):94-99. LI Min, DUAN Deng-xuan, XU Guo-jing, et al. Effects of Pista stratiotes-probiotics purifying eutrophied pond water[J]. Journal of Ecology and Rural Environment, 2015(1):94-99. (in Chinese) |
| [11] | Fox L J, Struik P C, Appleton B L. et al. Nitrogen phytoremediation by water hyacinth(Eichhorniacrassipes(Mart.)solms)[J]. Water, Air, and Soil Pollution, 2008, 194:199-207. |
| [12] | 张志勇, 郑建初, 刘海琴, 等. 凤眼莲对不同程度富营养化水体氮磷的去除贡献研究[J]. 中国生态农业学报, 2010, 18(1):152-157. ZHANG Zhi-yong, ZHENG Jian-chu, LIU Hai-qin, et al. Role of Eichhorniacrassipes uptake in the removal of nitrogen and phosphorus from eutrophic waters[J]. Chinese Journal of Eco-agriculture, 2010, 18(1):152-157. (in Chinese) |
| [13] | 崔丽娟, 李伟, 赵欣胜, 等. 表流湿地不同植物配置对富营养化水体的净化效果[J]. 生态与农村环境学报, 2011, 27(2):81-86. CUI Li-juan, LI Wei, ZHAO Xin-sheng, et al. Effect of plant disposition on purification of eutrophicated circulating water in surface flow wetlands[J]. Journal of Ecology and Rural Environment, 2011, 27(2):81-86. (in Chinese) |
| [14] | 高岩, 易能, 张志勇, 等. 凤眼莲对富营养化水体硝化、反硝化脱氮释放N2O的影响[J]. 环境科学学报, 2012, 32(2):349-359. GAO Yan, YI Neng, ZHANG Zhi-yong, et al. Effect of water hyacinth on N2O emission through nitrification and denitrification reactions in eutrophic water[J]. Acta Scientiae Circumstantiae, 2012, 32(2):349-359. (in Chinese) |
| [15] | 李海防, 夏汉平, 熊燕梅, 等. 土壤温室气体产生与排放影响因素研究进展[J]. 生态环境. 2007, 16(6):1781-1788. LI Hai-fang, XIA Han-ping, XIONG Yan-mei, et al. Greenhouse gas emission and soil factors:A review[J]. Ecological Environment, 2007, 16(6):1781-1788. (in Chinese) |
| [16] | Ramanthan V. The greenhouse theory of climate change:A test by an inadvertent global experiment[J]. Science, 1988, 24D(485D):293-299. |
| [17] | 徐春堂. "温室效应"与"氧气枯竭"[J]. 枣庄学院学报, 2007, 24(2):87-88. XU Chun-tang. "Greenhouse effect" and "Oxygen depletion"[J]. Journal of Zaozhuang University, 2007, 24(2):87-88. (in Chinese) |
| [18] | 马涛, 张振华, 易能, 等. 凤眼莲及底泥对富营养化水体反硝化脱氮特征的影响研究[J]. 农业环境科学学报, 2013, 32(12):2451-2459. MA Tao, ZHANG Zhen-hua, YI Neng, et al. Nitrogen removal via denitrification from eutrophic water as influenced by Eichhonia crassipes and sediment[J]. Journal of Agro-Environment Science, 2013, 32(12):2451-2459. (in Chinese) |
| [19] | Gao Yan, Yi Neng, Zhang Zhi-yong, et al. Effect of Eichhornia crassipes on production of N2O by denitrification in eutrophic water[J]. Ecological Engineering, 2014, 68:14-24. (in Chinese) |
| [20] | 陈建, 丛君, 陈高云, 等. 用有效微生物菌群控制蓝藻水华研究[J]. 环境工程学报, 2010, 4(1):101-104. CHEN Jian, CONG Jun, CHEN Gao-yun, et al. Control of cyanobacterial bloom with effective microorganisms[J]. Chinese Journal of Environmental Engineering, 2010, 4(1):101-104. (in Chinese) |
| [21] | Groffman P M, Altabet M A, Bohlke J K, et al. Methods for measuring denitrification:Diverse approaches to a difficult problem[J]. Ecological Applications, 2006, 16(6):2091-2122. |
| [22] | Duchemin E, Lucotte M, Canuel R, et al. Production of the greenhouse gases CH4 and CO2 by hydroelectric reservoirs of the boreal region[J]. Global Biogeochemical Cycles, 1995, 9(4):529-540. |
| [23] | Kana T M, Darkangelo C, Hunt M D, et al. Membrane inlet mass spectrometer for rapid high-precision determination of N2, O2, and Ar in environmental water samples[J]. Anal Chem, 1994, 66:4166-4170. |
| [24] | Liu Xin-hong, Gao Yan, Wang Hong-Lian, et al. Applying a new method for direct collection, volume quantification and determination of N2 emission from water[J]. Journal of Environmental Sciences, 2015, 27:217-224. |
| [25] | Gao Yan, Liu Xin-hong, Yi Neng, et al. Estimation of N2 and N2O ebullition from eutrophic water using an improved bubble trap device[J]. Ecological Engineering, 2013, 57:403-412. |
| [26] | 刘新红, 高岩, 郭俊尧, 等. 一种分层收集自然水体释放气体装置的应用效果[J]. 江苏农业科学, 2013, 41(5):365-367. LIU Xin-hong, GAO Yan, GUO Jun-yao, et al. Introduction of a stratified collecting device for ebullition gas from water ecosystems[J]. Jiangsu Agricultural Sciences, 2013, 41(5):365-367. (in Chinese) |
| [27] | 魏复盛. 水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2002:266-277. WEI Fu-sheng. Monitoring method of water and wastewater[M]. Beijing:China Environmental Science Press, 2002:266-277.(in Chinese) |
| [28] | 高岩, 张力, 王岩, 等. 春季微生物固定化技术原位净化污染河塘的效果[J]. 江苏农业学报, 2015, 31(2):334-341. GAO Yan, ZHANG Li, WANG Yan, et al. Purification of polluted pond in situ by microorganism immobilization technology in spring[J]. Jiangsu Journal of Agricultural Sciences, 2015, 31(2):334-341. (in Chinese) |
| [29] | 夏小雪, 朱维耀, 李娟, 等. 油藏内源微生物生长代谢及驱油特性研究[J]. 石油天然气学报, 2014, 36(1):122-126. XIA Xiao-xue, ZHU Wei-yao, LI Juan, et al. Reservoir endogenous microbe growth metabolism and displacement characteristics research[J]. Journal of Oil and Gas Technology, 2014, 36(1):122-126. (in Chinese) |
| [30] | Li Xiao-bo, Xia Yong-qiu, Li Yue-fei, et al. Sediment denitrification in waterways in a rice-paddy-dominated watershed in eastern China[J]. Journal of Soil and Sediments, 2013, 13:783-792. |
| [31] | Adouani Nouceiba, Limousy Lionel, Lendormi Thomas, et al. N2O and NO emissions during wastewater denitrification step:Influence of temperature on the biological process[J]. Comptes Rendus Chimie, 2015, 18(1):15-22. |
| [32] | Guo Jin-bo, Zhang Lan-he, Chen Wei, et al. The regulation and control strategies of a sequencing batch reactor for simultaneous nitrification and denitrification at different temperatures[J]. Bioresource Technology, 2013, 133:59-67. |
| [33] | Zou Shi-qiang, Yao Shuo, Ni Jin-ren, et al. High-efficient nitrogen removal by coupling enriched autotrophic-nitrification and aerobic-denitrification consortiums at cold temperature[J]. Bioresource Technology, 2014, 161:288-296. |
| [34] | 万晓红, 周怀东, 王雨春, 等. 白洋淀湖泊湿地氧化亚氮的排放通量初探[J]. 生态环境, 2008, 17(5):1732-1738.(in Chinese) WAN Xiao-hong, ZHOU Huai-dong, WANG Yu-chun, et al. N2O emission flux from Baiyangdian wetland[J]. Ecology and Envirionment, 2008, 17(5):1732-1738. (in Chinese) |
 2016, Vol. 33
2016, Vol. 33