文章信息
- 吴秀文, 郝艳淑, 雷晶, 姜存仓
- WU Xiu-wen, HAO Yan-shu, LEI Jing, JIANG Cun-cang
- 不同钾和硼水平对棉花叶片逆境生理及其细胞壁硼的影响
- Effect of Different Levels of Potassium and Boron on Stress Physiology and Cell Wall Boron Content of Cotton Leaf
- 农业资源与环境学报, 2016, 33(1): 29-34
- Journal of Agricultural Resources and Environment, 2016, 33(1): 29-34
- http://dx.doi.org/10.13254/j.jare.2015.0154
-
文章历史
- 收稿日期: 2015-06-20
2. 农业部长江中下游耕地保育重点实验室, 湖北武汉 430070
2. Key Laboratory of Arable Land Conservation, Ministry of Agriculture, Wuhan 430070, China
目前我国对大量元素肥料投入过大,但对微肥的重视程度不足。硼是植物正常生长必不可少的一种微量元素,棉花对硼的需求量较大且较敏感,我国棉花普遍存在缺硼现象,这严重制约了棉花产量和品质的提高[1]。硼在细胞膜结构中起着重要作用,Parr等[2]指出硼与细胞膜相互作用可能是它行使一切生理功能的基础,而细胞膜相对透性、丙二醛(MDA)和脯氨酸(Pro)的变化可以反映细胞膜功能和结构的变化。硼是细胞壁的结构物质,新细胞的形成需要硼来参与构建细胞壁[3]。硼在植物体内以多种形态存在[4],Du等[5]把植物体内的硼分为自由态硼、半束缚态硼和束缚态硼,硼充足时,自由态硼和半束缚态硼分别贮存在共质体与细胞质中,供细胞壁生长之需。自由态和半束缚态硼可以再转移利用,而束缚态硼则不能,由此可以将自由态硼和半束缚态硼定义为植物库容硼[6, 7]。植物体内90%以上的硼分布于细胞壁[8],Goldbach等[9]认为这部分硼在细胞壁中与RG-Ⅱ紧密结合为B-RG-Ⅱ复合物非常稳定[10],不能再被利用。很多研究表明缺硼对植物体内不同形态硼有很大影响。盛鸥等[11]通过测定不同形态硼在一定程度上解释了“纽荷尔”脐橙果实膨大期出现缺硼症状的原因;刘桂东等[12]根据不同形态硼含量及其相互关系,在细胞水平上初步探讨了2种不同砧木“纽荷尔”脐橙硼反应差异的原因。棉花对于钾的需求量较多,且对钾更敏感和更易缺钾[13]。钾在生理功能上与硼有相互依存的作用,两者均可以增强细胞膜持水能力,使细胞膜保持稳定的透性,钾与植物叶片光合作用的进行、光合产物的产生和运输有很大关系,而这又与植物体内硼的存在形态及其运输密切相关。以往的研究多集中在钾胁迫和硼胁迫对于植物逆境生理的影响,而不同钾、硼处理对植物逆境生理、钾与植物体内硼存在形态及关系的研究则很少。本试验以棉花为供试材料,研究不同钾、硼水平下棉花叶片逆境生理指标及不同形态硼的差异,以期揭示不同钾、硼处理对植物抗逆性、细胞壁硼分布的影响及硼利用效率的差异机理。
1 材料与方法 1.1 试验材料和设计试验于2014年7月在华中农业大学盆栽场温室内进行,试验材料为华中农业大学棉花遗传育种研究室提供的鄂抗8号。选用Hoagland营养液供应大、中量元素,以Arnon营养液补充微量元素,盐类及用量如下:0.240 g·L-1 NH4NO3、0.100 g·L-1 Na2HPO4·12H2O、0.100 g·L-1 NaH2PO4·H2O、0.360 g·L-1 CaCl2·2H2O、0.500 g·L-1 MgSO4·7H2O、1.81 mg·L-1 MnCl2·4H2O、0.22 mg·L-1 ZnSO4·7H2O、0.08 mg·L-1 CuSO4·5H2O、0.09 mg·L-1 Na2MoO4、48.5 mg·L-1 EDTA-Fe。
试验设2个K水平:K1(缺钾,2 mgK·L-1),K2(适钾,20 mgK·L-1);2个B水平:B1(缺硼,0 mgB·L-1),B2(适硼,0.2 mgB·L-1)。选取均匀饱满的种子,于50~60 ℃水中浸泡24 h,露白后在湿润的纱布上催芽后转入3 L黑塑料袋避光的塑料桶,每桶2株,脱脂棉固定,共4个处理,重复8次。1/4全量营养液预培养1周后,根据棉花长势进行间苗,每桶定值1株,并开始进行不同试验处理:先用1/4浓度不同钾、硼处理的营养液(钾、硼为相应处理浓度,其他元素为1/4全量营养液浓度)培养1周,再用1/2浓度不同钾、硼处理的营养液(钾、硼为相应处理浓度,其他元素为1/2全量营养液浓度)培养1周,继而用全量浓度不同钾、硼处理的营养液(钾、硼为相应处理浓度,其他元素为全量营养液浓度)进行培养,总共培养1个月后收获。上午、下午各通气20 min,营养液每周更换1次。
1.2 测定项目与方法 1.2.1 生长指标、干物重测定棉花处理30 d收获时分别测定并记录其株高、主根长、叶片数。将幼苗分根、茎、叶取样,用去离子水冲洗干净后在70 ℃烘箱中烘干,并记录干重。
1.2.2 逆境生理指标的测定收获时,每个处理取4株棉花幼苗,取相同部位功能叶(倒三叶),立即用液氮冻存备用。采用电导法[14]测定细胞膜相对透性,采用硫代巴比妥酸法[15]测定丙二醛(MDA)含量,采用磺基水杨酸法[15]测定脯氨酸(Pro)含量。
1.2.3 叶片不同形态硼及细胞壁硼含量测定不同形态硼参照Du等[5]的方法提取。具体步骤为:称取每个处理4株棉花3 g左右新鲜叶片置于干燥塑料瓶中,剪成1 mm2左右的碎片,加入15 mL重蒸馏水,25 ℃水浴保温振荡24 h后,用0.15 mm的细纱网过滤,再用定量滤纸过滤,所得滤液为待测液A(代表水溶态硼);残渣用10 mL 1 mol·L-1 NaCl溶液洗入塑料瓶中,25 ℃水浴保温振荡24 h,用0.15 mm细纱网过滤,再用定量滤纸过滤,所得滤液为待测B(代表半束缚态硼);剩余残渣用10 mL 1 mol·L-1 HCl洗入塑料瓶中,25 ℃水浴保温振荡24 h,用滤纸过滤,所得滤液为待测液C(代表束缚态硼);上述A、B、C待测液分别用姜黄素比色法测定硼含量。
自由态硼相对含量%=自由态硼/(自由态硼+半束缚态硼+束缚态硼)×100;
半束缚态硼相对含量%=半束缚态硼/(自由态硼+半束缚态硼+束缚态硼)×100;
束缚态硼相对含量%=束缚态硼/(自由态硼+半束缚态硼+束缚态硼)×100,代表细胞壁中与果胶多糖结合的硼的比例;
R值=半束缚态硼/自由态硼,其大小代表了跨膜进入细胞质硼的多少[16]。
粗细胞壁的提取参照文献[17],取3 g叶片剪碎后放入研钵中,加入适量液氮,把样品磨成粉末状,转入50 mL离心管中,加入30 mL冰水匀浆,然后3 000 r·min-1离心10 min,倒出上清液,残渣用10体积的冰水冲洗,再离心;残渣用10体积的80%乙醇冲洗3次,然后用10体积的甲醇-氯仿(体积比1∶1)混合物冲洗1次,最后用10体积丙酮冲洗,最后剩下的不溶性残渣即为粗细胞壁,将其烘干并称重,计算每个处理细胞壁的提取率,用姜黄素比色法测定叶片细胞壁硼含量。
1.3 数据分析用Microsoft Excel 工具作图表分析,用SAS 9.1.3数据处理系统进行统计分析。
2 结果与分析 2.1 不同钾和硼水平对棉花生长和生物量的影响如表 1所示,适钾水平下,与正常硼处理相比,缺硼棉花幼苗的主根长、株高和叶片数降低,地上部干物质积累量和植株总干物质积累量分别减少了10.62%和10.04%,地下部干物质积累量差异不明显;缺钾水平下,缺硼处理棉花生长情况和干物质积累量较正常硼处理没有显著差异。
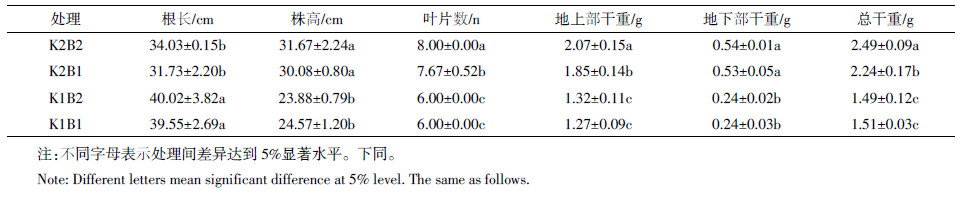 |
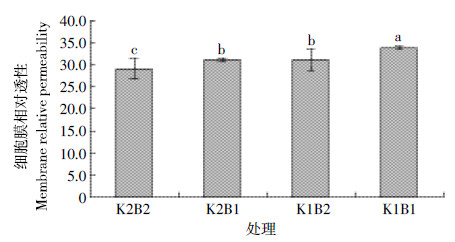
植物在逆境胁迫或衰老的过程中,植物细胞原生质膜中的不饱和脂肪酸发生过氧化作用,使质膜系统受到伤害,主要表现为半透性的破坏,电解质和非电解质外渗,膜伤害或变性程度通常用细胞膜相对透性表示,不同钾、硼水平对棉花叶片细胞膜相对透性有明显的影响。图 1所示,不同钾水平下,与正常硼处理相比,缺硼后棉花叶片细胞膜透性均显著升高,棉花叶片细胞膜功能受到不同程度的伤害。
|
| 图 1 不同钾和硼水平下棉花叶片细胞膜相对透性 Figure 1 Membrane relative permeability of cotton leaf under different levels of potassium and boron |
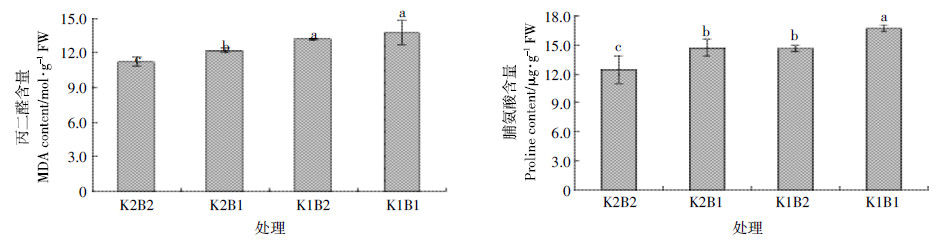
丙二醛是细胞膜脂过氧化作用的产物之一,它的产生还能加剧膜的损伤。植物体内产生脯氨酸含量的高低也可以反应细胞膜损伤程度,产生越多的脯氨酸,表明植物细胞膜受到的伤害越大。如图 2所示,K2和K1水平下,缺硼棉花叶片丙二醛和脯氨酸均高于正常硼处理。说明适钾和缺钾水平下,缺硼均导致细胞膜功能受损,这与细胞膜相对透性反映的结果是一致的。
|
| 图 2 不同钾和硼水平下棉花叶片丙二醛和脯安酸含量 Figure 2 Content of MDA and Pro in cotton leaf under different levels of potassium and boron |
由表 2可知,K2条件下,缺硼处理棉花叶片中自由态硼含量、半束缚态硼含量和束缚态含量较适硼处理均显著降低,自由态硼相对含量也大幅度降低,但束缚态硼相对含量和R值分别增加了10.32%和21.28%;而K1条件下,与适硼处理相比,缺硼棉花叶片中自由态硼含量、相对含量及半束缚态硼含量、相对含量均显著升高,束缚态硼含量、相对含量显著降低,R值增加。由表 2还可以看出,4个处理棉花叶片中束缚态硼相对含量均大于自由态硼和半束缚态硼的相对含量。
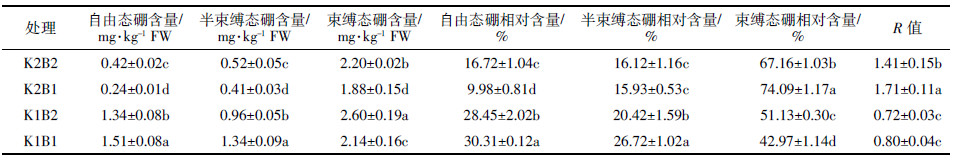 |
不同钾、硼水平下棉花叶片细胞提取率有较大差异。如图 3所示,K2B2、K2B1、K1B2和K1B1的细胞壁提取率分别是32.03%、42.07%、24.24%和25.51%。正常供钾条件下,棉花缺硼时叶片细胞壁提取率显著升高,与正常硼处理相比升高了31.35%;缺钾条件下,缺硼棉花叶片细胞壁提取率较正常硼处理也有所升高,但是差异没有达到显著水平。
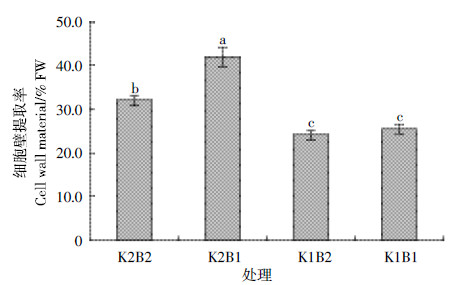
|
| 图 3 不同钾和硼水平下棉花叶片细胞壁提取率 Figure 3 Cotton leaf cell wall material under different levels of potassium and boron |
表 3中,适钾条件下,缺硼处理棉花叶片总细胞壁硼含量较正常硼处理显著降低,而叶片总细胞壁硼占叶片总硼的比例升高了25.43%;缺钾条件下,缺硼处理棉花叶片总细胞壁硼含量较正常硼处理也有所降低,但没有达到显著水平,而叶片总细胞壁硼占叶片总硼的比例显著降低,且降低了17.95%。即适钾时,缺硼使得结合到细胞壁的硼比例增大,缺钾时,缺硼反而使结合到细胞壁上的硼的比例减小。
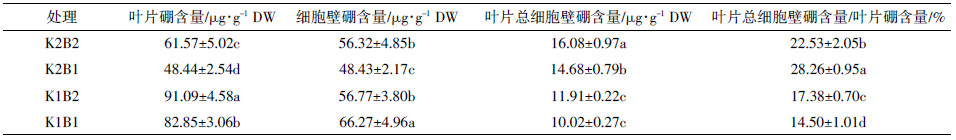 |
植物具有感知硼水平的变化并调节其在植物体内重新分配的能力。这种调节作用对于低硼胁迫条件下保证植物生存具有重要的意义[18]。本试验中,适钾水平下,缺硼抑制棉花生长,地上部干物质积累量显著减少。缺钾水平下,缺硼对棉花生长和干物质积累影响较小。
植物细胞膜对维持细胞的微环境和正常的代谢起着重要的作用,在正常情况下,细胞膜对物质具有选择透性,但当植物遭受逆境胁迫时最先受损伤的是细胞膜系统,主要表现为膜透性增加,相对电导率上升[14]。缺硼对细胞膜功能的影响主要表现为膜透性增加[19],耿明建等[20]对棉花的研究表明缺硼时叶片膜脂过氧化,细胞膜透性增大,细胞内电解质外渗,膜功能受伤害,吴素英[21]通过不同缺硼胁迫水平及短期缺硼后恢复供硼研究了硼与细胞膜透性的关系,结果表明施硼能降低油菜各品种的细胞膜相对渗透率,Aline Voxeur等[22]认为这可能与缺硼导致细胞膜上微结构域-脂质筏受到破坏有关。本试验也得到了一致的结果:供钾充足和不足情况下,缺硼棉花叶片细胞膜相对透性均显著增加。丙二醛和脯氨酸含量的变化也可定量反映生物膜、细胞膜等的膜脂过氧化伤害程度,丙二醛积累过多会影响生物膜中结构蛋白和酶的聚合并使它们的结构功能和催化功能发生改变,还可以降低膜中不饱和脂肪酸的含量,从而降低膜流动性[23]。很多研究都证实,当丙二醛含量积累到一定程度时,相对电导率会显著上升[24, 25]。本试验研究表明,K2和K1水平时,缺硼时棉花叶片丙二醛和脯氨酸含量均较正常硼处理有所升高,细胞膜结构和功能受到了不同程度的伤害。
3种不同形态硼分布在植物细胞的不同区域,都有其各自的作用[5]。相对高的自由态硼含量表示硼的利用能力低[16]。进入细胞质中与单糖或多糖等结合的硼称为半束缚态硼,当细胞壁需要硼时,半束缚态硼就会转化为束缚态硼,然后参与细胞壁的合成,这种转化对于低硼胁迫条件下保证植物生存具有重要的意义[18]。束缚态硼是与细胞壁结合的硼,主要位于细胞壁的果胶多糖中,不可与其他形态硼相互转化[26]。本试验得知,K2水平下,棉花缺硼叶片中自由态硼相对含量显著降低,R值显著升高,束缚态硼相对含量和叶片总细胞壁硼占叶片硼的比例升高,并且3种形态的硼中以束缚态硼相对含量最大;而K1水平下,棉花缺硼叶片中自由态硼和半束缚态相对含量显著升高,束缚态硼相对含量和叶片总细胞壁硼占叶片硼的比例降低,R值升高,3种形态的硼中仍以束缚态硼相对含量最大。说明适钾时,缺硼促进更多的自由态硼进入细胞质,和细胞壁中果胶多糖结合转化为束缚态硼的比例也增多,并且细胞壁中硼的比例最大;而低钾时,缺硼使游离态硼和跨膜进入细胞质的硼的比例均增大,与细胞壁结合的硼的比例减少,但细胞内绝大部分硼仍然结合在细胞壁上。这与Brown等[27]对南瓜叶片和烟草悬浮培养细胞的研究也表明,缺硼时,结合在细胞壁中的硼比例显著上升,Pan等[28]也证明许多植物中细胞壁硼的相对比例在缺硼条件下显著增加。但缺钾时,缺硼使棉花叶片中与细胞壁结合的硼的比例减少的原因,还需要进一步研究。
4 结论(1)供钾正常和不足时,缺硼均会对棉花叶片细胞膜结构和功能造成伤害;
(2)正常供钾水平,棉花缺硼时叶片中自由态硼比例降低,细胞壁提取率和结合在细胞壁上的硼的比例升高;
(3)低钾条件下,棉花缺硼时叶片自由态硼和束缚态硼比例升高,结合在细胞壁上的硼的比例降低。
| [1] | 耿明建, 朱建华, 吴礼树, 等. 不同硼效率棉花品种根系参数和伤流液组分的差异[J]. 土壤通报, 2006, 37(4):744-747. GENG Ming-jian, ZHU Jian-hua, WU Li-shu, et al. Differences in root characters and composition of root bleeding sap between several cotton cultivars with different boron efficiency[J]. Chinese Journal of Soil Science, 2006, 37(4):744-747. (in Chinese) |
| [2] | Parr A J, Loughman B C. Boron and membrane function in plants[M]//D A Robb, W S Pierpoint. et al. Metals and micronutrients, uptake and utilization by Plants. New York:Academic Press, 1983:87-107. |
| [3] | O'Neill M A, Eberhard S, Albersheim P, et al. Requirement of borate cross-linking of cell wall rhamnogalacturonan II for Arabidopsis growth[J]. Science, 2001, 294:846-849. |
| [4] | Wang R D, Liu G D, Liu L C, et al. Relationship between leaf chlorosis and different boron forms in trifoliate orange seedlings under excessive boron supply[J]. Soil Science and Plant Nutrition, 2014, 60:325-332. |
| [5] | Du C W, Wang Y H, Xu F S. Study on the physiological mechanism of boron utilization efficiency in rape cultivars[J]. Journal of Plant Nutrition, 2002, 25(2):231-244. |
| [6] | 年夫照, 石磊, 徐芳森, 等. 硼镁营养对不同硼效率甘蓝型油菜品种苗期硼形态的影响植物[J]. 植物营养与肥料学报, 2004, 10(6):633-637. NIAN Fu-zhao, SHI Lei, XU Fang-sen, et al. Effects of boron-magnesium on boron forms of rape cultivars with different boron efficiency at seedling stage[J]. Plant Nutrition and Fertilizer Science, 2004, 10(6):633-637. (in Chinese) |
| [7] | Dannel F, Pfeffer H, R mheld V. Compartmentation of boron in roots and leaves of sunflower as affected by boron supply[J]. Journal of Plant Physiology, 1998, 153:615-622. |
| [8] | Matoh T. Boron in plant cell walls[J]. Plant and Soil, 1997, 193:59-70. |
| [9] | Goldbach H E, Wimmer M A, Findeklee P. Discussion paper:Boron-how can the critical level be defined?[J]. Journal of Plant Nutrition and Soil Science, 2000, 163:115-121. |
| [10] | O'Neill M A, Warrenfeltz D, Kates K, et al. Rhamnogalacturonan II, a pectic polysaccharide in the walls of growing plant cells, forms a dimer that is covalently cross-linked by a borate ester[J]. Journal of Biology Chemistry, 1996, 271(37):22923-22930. |
| [11] | 盛鸥, 严翔, 彭抒昂, 等. 纽荷尔脐橙果实发育期叶片不同形态硼含量与缺硼的关系[J]. 园艺学报, 2007, 34(5):1103-1110. SHENG Ou, YAN Xiang, PENG Shu-ang, et al. Relationship between boron deficiency occurrence and changes in contents of different boron forms in leaves of Newhall navel orange during fruit development[J]. Acta Horticulturae Sinica, 2007, 34(5):1103-1110. (in Chinese) |
| [12] | 刘桂东, 姜存仓, 王运华, 等. 硼对两种不同砧木'纽荷尔'脐橙叶片硼形态影响的差异[J]. 中国农业科学, 2011, 44(5):982-989. LIU Gui-dong, JIANG Cun-cang, WANG Yun-hua, et al. Effect of boron on leaf boron forms of newhall navel orange grafted on two rootstocks[J]. Scientia Agricultura Sinica, 2011, 44(5):982-989. (in Chinese) |
| [13] | 郝艳淑, 姜存仓, 王晓丽, 等. 不同棉花基因型钾效率特征及其根系形态的差异[J]. 作物学报, 2011, 37(11):2094-2098. HAO Yan-shu, JIANG Cun-cang, WANG Xiao-li, et al. Differences of potassium efficiency characteristics and root morphology between two cotton genotypes[J]. Acta Agronomica Sinica, 2011, 37(11):2094-2098. (in Chinese) |
| [14] | 陈少裕. 膜脂过氧化对植物细胞的伤害[J]. 植物生理学通讯, 1991, 27(2):84-90. CHEN Shao-yu. Injury of membrane lipid peroxidation to plant cell[J]. Plant Physiology Communications, 1991, 27(2):84-90. (in Chinese) |
| [15] | 熊庆娥. 植物生理学实验教程[M]. 成都:四川科学技术出版社, 2003. XIONG Qing-e. Plant physiology experiment[M]. Chengdu:Sichuan Science and Technology Press, 2003.(in Chinese) |
| [16] | 杜昌文, 王运华, 徐芳森, 等. 一个甘蓝型油菜硼素营养遗传指标的建立及其应用初探[J]. 植物营养与肥料学报, 2000, 6(3):349-352. DU Chang-wen, WANG Yun-hua, XU Fang-sen, et al. Preliminary study on establishment of one boron nutrition genetic index and its application in rape[J]. Plant Nutrition and Fertilizer Science, 2000, 6(3):349-352. (in Chinese) |
| [17] | Hu H, Brown P H. Localization of boron in cell walls of squash and tobacco and its association with pectin-evidence for a structural role of boron in the cell wall[J]. Plant Physiology, 1994, 105:681-689. |
| [18] | Tanaka M, Fujiwara T. Physiological roles and transport mechanisms of boron:perspectives from plants[J]. European Journal of Applied Physiology, 2008, 456:671-677. |
| [19] | 石磊, 杨玉华, 徐芳森, 等. 硼对作物细胞膜功能影响的研究进展[J]. 华中农业大学学报, 2002, 21(4):395-400. SHI Lei, YANG Yu-hua, XU Fang-sen, et al. Effects of boron on the function of plant membrane[J]. Journal of Huazhong Agricultural University, 2002, 21(4):395-400. (in Chinese) |
| [20] | 耿明建, 朱建华, 吴礼树, 等. 硼对不同硼效率棉花品种苗期叶片膜脂过氧化和多胺含量的影响[J]. 植物营养与肥料学报, 2003, 9(3):337-341. GENG Ming-jian, ZHU Jian-hua, WU Li-shu, et al. Effects of boron on membrane lipid peroxidation and polyamines content in leaves of two cotton cultivars with different boron efficiency at seedling stage[J]. Plant Nutrition and Fertilizer Science, 2003, 9(3):337-341. (in Chinese) |
| [21] | 吴素英. 不同硼效率油菜品种硼吸收运转及细胞膜透性差异的研究[D]. 武汉:华中农业大学, 2010. WU Su-ying. Study on different of cell membrane permeability and uptake and retranslocation in rape cultivars with different boron efficiency[D]. Wuhan:Huazhong Agricultural University, 2010. (in Chinese) |
| [22] | Aline Voxeur, Stephen C Fry. Glycosylinositol phosphorylceramides from Rosa cell cultures are boron-bridged in the plasma membrane and form complexes with rhamnogalacturonan II[J]. The Plant Journal, 2014, 79:139-149. |
| [23] | 王连敏, 王立志, 张国民, 等. 苗期低温对玉米体内脯氨酸电导率及光合作用的影响[J]. 中国农业气象, 1999, 20(2):28-30. WANG Lian-min, WANG Li-zhi, ZHANG Guo-min, et al. Effect of low temperature at seedling stage on proline[J]. Chinese Journal of Agrometeorology, 1999, 20(2):28-30. (in Chinese) |
| [24] | Dobretsov G E, Borschevskaya T A, Petrov V A, et al. The increase of phospholipid bilayer rigidity after lipid peroxidation[J]. FEBS Letters, 1977, 84:195. |
| [25] | 周龙, 廖康, 王磊, 等. 低温胁迫对新疆野生樱桃李电解质渗出率和丙二醛含量的影响[J]. 新疆农业大学学报, 2006, 29(1):47-50. ZHOU Long, LIAO Kang, WANG Lei, et al. Study on resistance to coldness of Prunus divaricate[J]. Journal of Xinjiang Agricultural University, 2006, 29(1):47-50. (in Chinese) |
| [26] | 王春燕, 魏绍冲, 姜远茂, 等. 施硼处理对苹果植株不同形态硼含量及果实品质的影响[J]. 山东农业科学, 2012, 44(3):68-71. WANG Chun-yan, WEI Shao-chong, JIANG Yuan-mao, et al. Effect of boron fertilizer on content of different boron forms in apple plants and fruit quality[J]. Shandong Agricultural Sciences, 2012, 44(3):68-71. (in Chinese) |
| [27] | Brown P H, Hu H. Boron uptake by sunflower, squash and cultured tobacco cells[J]. Plant Physiology, 1994, 91:435-441. |
| [28] | PAN Yuan, WANG Zhen-hua, YANG Lu, et al. Differences in cell wall components and allocation of boron to cell walls confer variations in sensitivities of Brassica napus cultivars to boron deficiency[J]. Plant Soil, 2012, 354:383-394. |
 2016, Vol. 33
2016, Vol. 33




