文章信息
- 王根林, 李玉梅, 刘峥宇, 宋柏权, 李艳
- WANG Gen-lin, LI Yu-mei, LIU Zheng-yu, SONG Bai-quan, LI Yan
- 除草剂残留下生物炭对土壤微生物的影响
- Effects of Bio-char on Soil Microbes in Herbicide Residual Soils
- 农业资源与环境学报, 2015, 32(5): 471-476
- Journal of Agricultural Resources and Environment, 2015, 32(5): 471-476
- http://dx.doi.org/10.13254/j.jare.2015.0039
-
文章历史
- 收稿日期: 2015-02-06
2. 黑龙江大学农学院, 黑龙江 哈尔滨 150010;
3. 黑龙江省农业科学院土壤肥料与环境资源研究所, 黑龙江 哈尔滨 150086;
4. 黑龙江省绥滨农场, 黑龙江 绥滨 154213
2. Agricultural College of Heilongjiang University, Harbin 150010, China;
3. Institute of Soil Fertilizer and Environment Resource, Heilongjiang Academy of Agriculture and Science, Harbin 150086, China;
4. Suibin Farm Heilongjiang, Suibin 154213, China
生物炭(Biochar)是指生物有机物料(生物质)在缺氧或低氧环境中热裂解后的固体产物[1],国内外学者在生物炭的性质和特征及其对土壤理化性质、土壤固碳等方面展开了广泛的研究,并取得了一定进展[2]。施用生物炭可增加土壤水稳定性团聚体数量[3],降低粘质土壤的容重和硬度,改善土壤质地及耕作性能[4, 5];生物炭的孔隙可以储存大量的水分和养分,为许多重要的微生物生长和繁殖提供了有利条件[6]。稻田施炭,可增加NH3-N的挥发,降低土壤中NH4-N的含量[7]等。
前期研究已证明[8, 9, 10],生物炭对大豆田除草剂异噁草松有明显的消减作用,通过消减除草剂残留,降低药害危害,促进作物的生长。而关于除草剂残留下,生物炭及其结构特性对土壤微域环境的影响还少有报道。因此,本研究通过对异噁草松残留下,生物炭对土壤微生物群落的影响研究,进一步从理论上为生物炭消减除草剂残留药害提供科学依据。 1 材料与方法 1.1 供试材料
供试土壤为典型黑土,其基本理化性质:全氮0.134%、全磷0.118%、全钾2.13%、碱解氮163.0 mg·kg-1、速效磷63.2 mg·kg-1、速效钾187.92 mg·kg-1、有机质34.8 g·kg-1、pH值6.74。生物炭(C)由沈阳应用生态研究所提供,基本理化性质:全氮0.785%、全磷0.133%、全钾2.41%、有机质583 g·kg-1,pH值8.56。异噁草松由大连松辽公司生产,标准含量480 g·L-1。供试甜菜品种为9048,单粒。底肥用量尿素0.15 g·kg-1、磷酸二铵0.2 g·kg-1、氯化钾0.086 g·kg-1,在甜菜叶丛生长期和块根生长期追施氮肥。 1.2 试验方法 1.2.1 试验设计
试验于2013—2014年在黑龙江省农业科学院盆栽试验场进行。根据大豆田异噁草松标准喷施量2 250 mL·hm-2,全部残留土壤(0~20 cm耕层,土壤容重1.2~1.3 g·cm-3)为0.48 mg·kg-1,设计土壤中异噁草松残留量与添加生物炭(C)共12个处理:处理1(异噁草松0.06 mg·kg-1)、处理2(异噁草松0.12 mg·kg-1)、处理3(异噁草松0.24 mg·kg-1)、处理4(异噁草松0.48 mg·kg-1)、处理5(异噁草松0.72 mg·kg-1)、处理6(异噁草松0.06 mg·kg-1+C 300 g)、处理7(异噁草松0.12 mg·kg-1+C 300 g)、处理8(异噁草松0.24 mg·kg-1+C 300 g)、处理9(异噁草松0.48 mg·kg-1+C 300 g)、处理10(异噁草松0.72 mg·kg-1+C 300 g)、处理11(异噁草松0 mg·kg-1)、处理12(异噁草松0 mg·kg-1+C 300 g)。每处理5次重复。 1.2.2 试验方法
盆栽用桶为直径30 cm×高30 cm,将无农药残留土壤统一过3.0 mm筛,每桶装土量20 kg。采用混土施药方法,先将异噁草松稀释成一定浓度后与土壤混拌均匀,再将生物炭与事先混合好的药土混拌、装桶、施肥、播种、覆土。每桶均匀播20粒种子,浇水量1 500 mL·桶-1。 1.2.3 测定项目与方法
在甜菜生长第15、30、40、50 d,采用“抖根法”取根际土样:收集紧附于根系0~0.5 cm范围内土壤(轻轻抖落黏附于根系上的土壤,然后把根系放入无菌袋内,用力抖下土壤),4 ℃保存,供土壤微生物分析。
土壤微生物测定:采用稀释平板培养法,分别用牛肉膏蛋白胨培养基、马丁氏培养基、高氏一号培养基对细菌、真菌、放线菌进行涂布培养,细菌30~37 ℃培养1~2 d,真菌28 ℃培养3~5 d,放线菌28~30 ℃培养5~7 d后进行菌落计数[11]。
生物炭形态结构:采用Quanta 200环境扫描电镜观察。将实验室制备的材料在鼓风恒温烘干箱中于(80±1) ℃恒温24 h,将烘干制备好的干样品放在载样台上用扫描电镜观察,记录并保存扫描电镜图。
生物炭元素分析:采用能谱仪EDS,探测面积为2 mm2,分辨率(MnKa)为~133 eV,探测元素范围为Be4~U92。 1.3 数据处理
采用Excel 2003计算试验数据,DPS 6.55进行统计分析。 2 结果与分析 2.1 生物炭对土壤细菌数量的影响
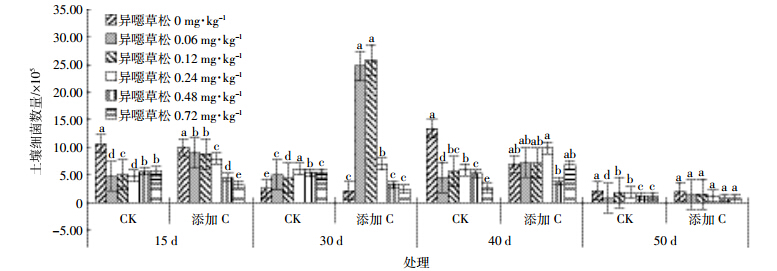
土壤中异噁草松残留对细菌群落数量有一定的影响。由图 1可见,异噁草松残留为0 mg·kg-1,土壤细菌数量随时间出现先降低后升高的波动性变化;当异噁草松残留低于0.48 mg·kg-1,随着异噁草松残留量的增加,细菌数量表现为平缓上升后下降趋势,可能与低浓度除草剂短期内会促进好氧细菌数量增加有关[12];当异噁草松残留达到0.72 mg·kg-1,细菌数量表现为降低趋势,说明异噁草松高残留对细菌具有较强的抑制作用。
|
| 图中不同字母表示差异显著 (P<0.05 ) 。下同 图 1 甜菜根际土壤细菌数量变化 Figure 1 The number of bacteria in rhizosphere soil |
土壤是微生物赖以生存的载体,生物炭多孔结构及其对土壤理化性质的改善会影响土壤微生态环境的改变,从而影响土壤微生物的活动[13]。由图 1可见,施炭后,细菌群落数量变化出现2个趋势:当土壤中异噁草松残留在0.06~0.12 mg·kg-1,细菌变化表现为先升高后降低的趋势,前期试验已发现,异噁草松残留在该浓度下,对玉米生长有明显的促进作用[8];当异噁草松残留高于0.12 mg·kg-1,加炭后细菌变化趋势与对照一致,均随生育进程表现为先降低后升高的趋势,但变幅减小,与生物炭降低了异噁草松的生物学毒性有关,至甜菜生长至第50 d,处理间差异不显著。 2.2 生物炭对土壤真菌数量的影响
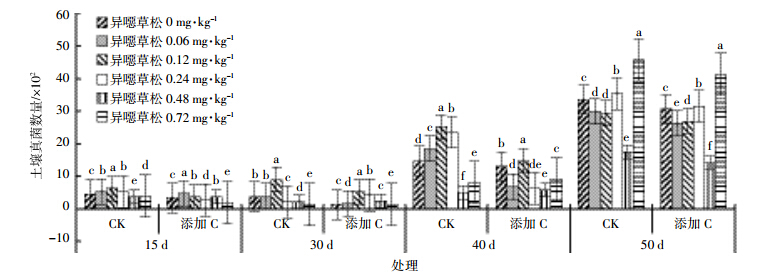
由图 2可见,土壤中异噁草松残留对土壤真菌群落数量有一定的影响。与对照无残留土壤比较,甜菜生长前40 d内,异噁草松低浓度(≤0.24 mg·kg-1)处理土壤真菌数量高于对照,而高浓度(≥0.48 mg·kg-1)处理真菌数量低于对照,差异显著,直至生长第50 d后高浓度处理真菌数量增加。前期观察也发现,甜菜生长40 d后,由于季节性降雨和异噁草松自然降解的影响,高浓度处理植株受药害症状开始缓解,甜菜幼苗逐渐恢复至旺盛生长期,说明低浓度异噁草松残留对真菌有促进作用,而高浓度有抑制作用。
|
| 图 2 甜菜根际土壤真菌数量变化 Figure 2 The number of fungi in rhizosphere soil |
加炭后土壤真菌群落变化与未加炭处理变化趋势基本一致(图 2),但加炭后,真菌数量明显低于未加炭对照处理。当异噁草松残留浓度达到0.72 mg·kg-1,甜菜生长至第50 d,加炭与未加炭处理,土壤真菌群落数量均达到最大,与其他处理差异显著。而异噁草松残留浓度为0.48 mg·kg-1,甜菜生长至40~50 d,加炭前后真菌数值均较低,这与该时期土壤含水量和甜菜地上部生长有关。 2.3 生物炭对土壤放线菌数量的影响
由图 3可见,异噁草松残留下,施炭前后土壤放线菌数量均随生育进程呈增加趋势。甜菜生长40 d内,异噁草松高浓度(≥0.48 mg·kg-1)加炭处理,土壤放线菌数量低于相同浓度未加炭处理,而低浓度(≤0.24 mg·kg-1)加炭处理高于对照,差异显著。甜菜生长40 d后,各处理土壤放线菌数量呈迅速增加趋势;当土壤中异噁草松达到0.48 mg·kg-1,甜菜生长第50 d,加炭前后放线菌数量均最低,与真菌变化趋势一致。异噁草松对土壤真菌和放线菌的影响相同,这与刘亚光等[12]研究一致。

|
| 图 3 甜菜根际土壤放线菌数量变化 Figure 3 The number of actinomycetes in rhizosphere soil |
土壤含水量变化对微生物群落数量有一定的影响。由图 4可见,在甜菜生长发育不同时期,土壤含水量发生一定的变化,总体趋势表现为先升高后降低的波动性变化。不同时期土壤水分变化较大,这与甜菜受药害后生长受影响有关。甜菜生长30 d左右,异噁草松低残留(≤0.24 mg·kg-1)处理,土壤含水量较低,而高残留(≥0.48 mg·kg-1)处理,土壤含水量较高,与该时期高残留处理甜菜受药害重,根系生长受抑制[13],需水量较少有关;施炭后,异噁草松不同残留量土壤含水量变化趋势一致,差异不显著,这说明施炭后,异噁草松残留药害得到降低,对甜菜生长的抑制作用减小。

|
| 图 4 甜菜根际土壤含水量变化 Figure 4 Water content in rhizosphere soil |
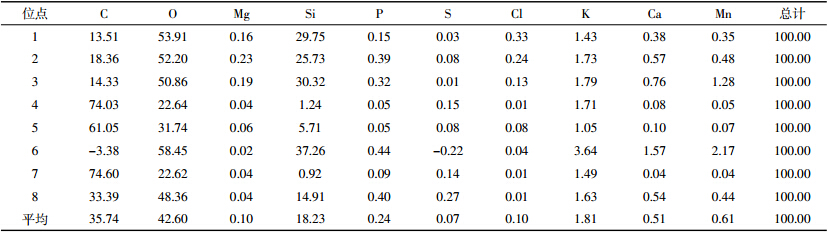
Laird等[14]提出,生物炭的高芳香烃结构容易成为土壤微生物的栖息地,给土壤微生物生长提供场所和养分。由图 5A、表 1可见,利用能谱仪对同一样本生物炭的8个不同位点元素含量分析表明,生物炭含有炭、氧、镁、硅、磷、硫等10种元素,其中,C、O含量最高,平均35.74%、42.60%,其次是Si、K,平均18.23%、1.81%,S含量最低。因此,生物炭多元素养分含量可为微生物生长提供充足的养分源。

|
| A:生物炭不同位点元素分析(400 μm);B:施炭土壤,放大13.3 mm×1.0 kSE; C:未施炭土壤,放大13.3 mm×1.0 kSE;D:土壤中生物炭,放大13.3 mm×2.0 Kse 图 5 生物炭结构特性 Figure 5 The micro morphology of bio-char |
前期研究已表明,生物炭为疏松多孔的“孔洞”结构,具有较高的比表面积。由图 5B、图 5C可见,施炭后土壤团粒结构明显改善,通气孔道增多;图 5D说明,进入土壤中的生物炭,其孔洞被土壤颗粒填充,在短时间内,被土壤颗粒吸附的农药分子,可由此进入孔洞内部,降低被种子或作物根系吸收利用的机率,减轻药害危害。另一方面,孔洞结构为微生物提供了生存和繁殖空间,加速了农药的生物降解,进一步降低药害残留危害。Ghosh(2000)使用质谱和分光镜技术也从微观水平探测到PAHs(多环芳烃)被封锁在沉积物颗粒中,导致毒性降低[15, 16]。 3 讨论
土壤中残留农药不仅对作物生长有一定的药害和抑制作用[8, 9, 10],对土壤微生物群落也有一定的影响[17, 18]。赵长山[19]通过室内培养试验认为,异噁草酮用量为2 250~2 750 mL·hm-2(相当于土壤残留浓度0.48~0.58 mg·kg-1)对大豆根圈土壤微生物群落结构有破坏作用,施药后两周内放线菌、真菌、细菌数量增加,随着培养时间的延长,放线菌和真菌数量基本恢复正常,但细菌数量直到施药后第49 d也未恢复正常。本试验表明,土壤异噁草松残留量在0~0.72 mg·kg-1(相当于土壤施用量0~3 375 mL·hm-2)对土壤真菌和放线菌影响具有相似规律,具有随作物生育进程延长而刺激增加的作用,尤其是高残留量处理,但初期对细菌具有较强的抑制作用,直至甜菜生长至第50 d恢复正常。
有研究表明,土壤微生物对生物炭施用的响应比其他有机质更快[20]。而异噁草松残留下,生物炭对土壤微域环境的影响还少有报道。本试验表明,异噁草松低残留下,添加生物炭后能够降低除草剂残留对土壤真菌和放线菌的刺激作用,而高残留处理变化相反;加入生物炭后,异噁草松对细菌的抑制作用有所缓解,细菌数量增加,与生物炭降低除草剂的生物学毒性有关。
生物炭的孔隙结构及对水肥吸附作用都能使其成为适合土壤微生物栖息的良好环境[21, 22]。对生物炭结构进行分析,可从微观上探究生物炭改善土壤微域环境,降低除草剂残留药害的特性。分析表明,其疏松多孔的孔洞结构和自身多元素养分含量都可能为微生物生存和繁殖提供充足的空间,加速除草剂的生物降解。土壤微生物是一个复杂的群体,不同的微生物种类对生物炭施用的响应具有多样性,还有待于进一步探讨。 4 结论
(1)异噁草松残留下,生物炭通过其深层孔洞结构的吸附作用,对除草剂残留药害有一定的消减作用。
(2)生物炭能够缓解高残留异噁草松对细菌的抑制作用。施炭前,土壤中一定量的异噁草松残留对真菌和放线菌群落影响趋势一致,具有刺激增加的作用,但初期对细菌具有较强的抑制作用;施炭后,土壤真菌数量降低,放线菌数量增加;异噁草松低残留下(≤0.12 mg·kg-1),细菌数量表现为先增加后降低。
除草剂残留下,生物炭通过改善土壤微域环境,影响土壤微生物群落变化,加速除草剂的生物降解,促进作物的生长。本试验研究可进一步为农业生产上利用生物炭消除除草剂残留药害提供科学依据。
| [1] | Johannes Lehmann, Matthias C Rillig, et al. Biochar effects on soil biota: A review[J]. Soil Biology & Biochemistry, 2011(43): 1812-1836. |
| [2] | Ogawa M, Okimori Y. Pioneering works in biochar research, Japan[J]. A ustralian Journal of Soil Research, 2010, 48: 489-500. |
| [3] | Downie A, Crosky A, Munroe P. Physical properties of biochar[C]//. Lehmann J, Joseph S, et al. Biochar for environmental management science and technology, London: Earthscan, 2010: 13-32. |
| [4] | Pssendal C R, Gouveia S M, Aravena R. Radiocarbon dating of total soil organic matter and humin fraction and its comparison with 14C ages of fossil charcoal[J]. Radiocarbon, 2001, 43: 595-601. |
| [5] | Gaskin J W, Speir R A, Harris K. Effect of peanut hull and pine chip bio-char on soil nutrients, corn nutrient status, and yield[J]. Agronomy Journal, 2011, 102: 623-633. |
| [6] | Wang H L, Lin K D, Hou Z N, et al. Sorption of the herbicide terbuthylazine in two New Zealand forest soils amended with biosolids and biochars[J]. Journal of Soils and Sediments, 2011, 10: 283-289. |
| [7] | 杨 帆, 李飞跃, 赵 玲, 等. 生物炭对土壤氨氮转化的影响研究[J].农业环境科学学报, 2013, 32(5): 1016-1020. YANG Fan, LI Fei-yue, ZHAO Ling, et al. Influence of biochar on the transformation of ammonia nitrogen in soils[J]. Journal of Agro-Environment Science, 2013, 32(5): 1016-1020.(in Chinese) |
| [8] | 李玉梅, 刘忠堂, 王根林, 等. 生物炭对土壤残留异噁草松的生物有害性影响研究[J]. 作物杂志, 2013, 154(3): 111-115. LI Yu-mei, LIU Zhong-tang, WANG Gen-lin, et al. Impact of biochar on the biological hazardous of clomazone residual in soil[J]. Crops, 2013, 154(3): 111-115.(in Chinese) |
| [9] | 李玉梅, 王根林, 李欣洁, 等. 生物炭对土壤物理性状及异噁草松消减的影响[J]. 生态学杂志, 2014, 33(3): 729-734. LI Yu-mei, WANG Gen-lin, LI Xin-jie, et al. Effects of bio-char on soil physical properties and clomazone degradation[J]. Chinese Journal of Ecology, 2014, 33(3): 729-734.(in Chinese) |
| [10] | 李玉梅, 王根林, 魏 丹, 等. 不同量生物炭消减土壤残留异噁草松对玉米有害性的影响[J]. 土壤通报, 2014, 45(1): 169-173. LI Yu-mei, WANG Gen-lin, WEI Dan, et al. Impact of biochar amount on reducing biological hazardous of clomazone residual to corn in soil [J]. Chinese Journal of Soil Science, 2014, 45(1): 169-173.(in Chinese) |
| [11] | 许光辉. 土壤微生物分析方法手册[M]. 北京: 中国农业出版社, 1986. XU Guang-hui. Soil microbial analysis handbook[M]. Beijing: Chinese Agriculture Press, 1986.(in Chinese) |
| [12] | 刘亚光, 李 洁, 唐广顺. 异噁草松对土壤微生物和土壤酶活性的影响[J]. 植物保护, 2010, 36(3): 85-88. LIU Ya-guang, LI Jie, TANG Guang-shun. Influences of clomazone on soil microorganisms and enzyme activity[J]. Plant Protection, 2010, 36(3): 85-88.(in Chinese) |
| [13] | 李玉梅, 宋柏权, 刘峥宇, 等. 除草剂残留下生物炭对甜菜生长的影响[J]. 农业资源与环境学报, 2015, 32(3): 269-274. LI Yu-mei, SONG Bai-quan, LIU Zheng-yu, et al. Effects of bio-char on sugar beet growth in clomazone residual soil[J]. Journal of Agricultural Resources and Environment, 2015, 32(3): 269-274.(in Chinese) |
| [14] | Laird D A, Fleming P, Davis D D, et al. Impact of biochar amendment on the quality of a typical midwestern agricultural soil[J]. Geoderma, 2010, 158: 443-449. |
| [15] | 占新华, 周立祥. 多环芳烃(PAHs)在土壤-植物系统中的环境行为[J]. 生态环境, 2003, 12(4): 487-492. ZHAN Xin-hua, ZHOU Li-xiang. Environmental behavior of PAHs in soil-plant system[J]. Ecology and Environment, 2003, 12(4): 487-492.(in Chinese) |
| [16] | 周丹丹. 生物质炭对有机污染物的吸附作用及机理调控[D]. 杭州: 浙江大学, 2008. ZHOU Dan-dan. The mechanism of biological carbon adsorption of organic pollutants and control[D]. Hangzhou: Zhejiang University, 2008. (in Chinese) |
| [17] | Xing B S, Pignatello J J. Dual-mode sorption of low-polarity com-pounds in glassy poly (vinyl chloride) and soil organic matter[J]. Environ Sci Technol, 1997, 31(3): 792-799. |
| [18] | 刘伟富. 敌草隆/菲在土壤和炭质吸附剂上的吸附行为及其生物可利用性研究[D]. 北京: 北京交通大学, 2011. LIU Wei-fu. Diuron/sorption behaviors of phenanthrene in soil and carbonaceous adsorbents and on the bioavailability of[D]. Beijing: Beijing Jiaotong University, 2011.(in Chinese) |
| [19] | 赵长山. 三种长残留性除草剂对大豆根圈环境的影响及原位生物修复研究[D]. 哈尔滨: 东北农业大学, 2007. ZHAO Chang-shan. Three kinds of long residual herbicide effects on soybean rhizosphere environment and in situ bioremediation research [D]. Harbin: Northeast Agricultural University, 2007.(in Chinese) |
| [20] | Hua L, Wu W X, Liu Y, et al. Reduction of nitrogen loss and Cu and Zn mobility during sludge composting with bamboo charcoal amendment[J]. Environmental Science and Pollution Research, 2009, 16: 1-9. |
| [21] | Cheng C H, Lehmann J, Thies J E, et al. Oxidation of black carbon by biotic and abiotic processes[J]. Organic Geochemistry, 2006, 37: 1477-1488. |
| [22] | Cheng C H, Lehmann J, Engelhard M H. Natural oxidation of black carbon in soils: Changes in molecular form and surface charge along a climosequence[J]. Geoehimicaet Cosmochimica Acta, 2008, 72: 1598-1610. |
 2015, Vol. 32
2015, Vol. 32