文章信息
- 王震, 许丽娟, 刘标, 杜东霞, 尹红梅, 贺月林
- WANG Zhen, XU Li-juan, LIU Biao, DU Dong-xia, YIN Hong-mei, HE Yue-lin
- 发酵床垫料中高效纤维素降解菌的分离与筛选
- Isolation and Identification of Cellulose-Decomposing Microorganisms in Deep-litter System
- 农业资源与环境学报, 2015, 32(4): 383-387
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2015.0007
-
文章历史
- 收稿日期:2015-01-06
随着养殖业规模化、集约化模式的发展,畜禽粪尿造成的环境污染问题越来越严重,成为当前急需解决的问题[1]。发酵床养猪技术是为了实现畜禽粪便原位降解的新型养殖技术,其技术原理是在锯末、稻壳等垫料中加入有益微生物菌群作为生物发酵床,猪只饲养在发酵床上,其排泄的粪尿与垫料在猪只的翻拱和人工辅助翻耙下充分混合,通过微生物的作用,使粪尿分解,达到零排放、无污染的目的[2, 3, 4]。
发酵床中的垫料有一定时间的使用寿命,如何对废弃的陈化垫料进行处理是发酵床养猪技术中一个急需解决的关键问题。目前对陈化垫料的处理方式有再生和堆肥2种,最主要的处理方式是堆肥[5]。发酵床陈化垫料主要由没有完全分解的猪粪与纤维素、木质素含量高的锯木屑、稻壳组成。腐殖质是在木质纤维素腐解过程中形成的,加强木质纤维素的降解便成为堆肥充分腐熟的关键。纤维素的降解主要有理化降解法和微生物降解法。理化降解法因使用成本高且对环境造成二次污染而较少使用,而利用微生物产生的纤维素酶分解和转化纤维素是纤维素利用的有效途径,可以加速陈化垫料堆肥有机物的腐解,对其实现资源化利用[6]。纤维素酶的来源很广泛,细菌、真菌、放线菌等在一定条件下均能产生纤维素酶[7]。但纤维素酶的比活力一般都很低[8],因而产酶成本高。据估计,纤维素水解成葡萄糖所需的酶蛋白要比淀粉相应水解所需的酶蛋白多100倍,这是影响纤维素酶广泛应用的重要原因之一[9]。因而,分离和筛选纤维素酶比活力高的菌株,是开发利用纤维素资源的关键,将为纤维素的降解和资源化利用提供优质的菌种资源。 1 材料与方法 1.1 材料 1.1.1 菌株
菌株M1、A1、A2、A3、B1均分离自湖南唐人神集团股份有限公司5年期发酵床垫料。 1.1.2 培养基
富集培养基(g·L-1):纤维素粉5.0,NaNO3 1.0,Na2HPO4·7H2O 0.5,KH2PO4 0.9,MgSO4·7H2O 0.5,KCl 0.5,酵母膏0.5,水解酪素0.5,自然pH值;
鉴别培养基(g·L-1):CMC-Na 20.0,MgSO4 0.5,K2HPO4 0.5,NaCl 0.5,琼脂20.0,pH值7.0~7.5;
产酶培养基(g·L-1):Na2HPO4 3.0,NH4NO3 0.8,MgSO4·7H2O 0.5,CaCl2 0.5,FeSO4·7H2O 0.01,MnSO4·H2O 0.01,ZnSO4 0.01,CMC-Na 10.0,蛋白胨1.0,酵母膏1.0,pH值7.0~7.2。
以上培养基均121℃灭菌20 min。 1.1.3 主要仪器试剂
Ezup柱式细菌基因组DNA抽提试剂盒(SK8256),购于上海生工生物工程有限公司;DNA Marker,购于宝生物工程有限公司;TaKaRa Taq聚合酶,购于宝生物工程有限公司;PCR仪(Mastercycler pro)、Centrifuge 5418高速离心机购于Eppendorf公司;Gel Doc XR凝胶成像仪,购于美国Bio-rad公司;微量移液器,购于Eppendorf公司。 1.2 试验方法 1.2.1 纤维素降解菌的筛选
取10 g发酵床陈化垫料样品加入到90 mL已灭菌的富集培养基中,30℃,200 r·min-1摇床震荡培养4 d。运用梯度稀释法制备10-5~10-7稀释液,分别取100 μL涂布在鉴别培养基中,于30℃恒温培养7 d,筛选能产生明显透明圈的菌株。将分离得到的单菌落用灭菌牙签点种于CMC-Na琼脂平板上,30℃恒温培养5 d,用刚果红溶液(1 mg·mL-1)染色1 h后,用NaCl溶液(1 mol·L-1)洗涤,分别测量菌落直径(d)和透明圈直径(D),以透明圈直径与菌落直径的比值(D/d)为指标进行筛选。 1.2.2 纤维素酶活测定
葡萄糖标准曲线的绘制:采用3,5-二硝基水杨酸比色定糖法(DNS)测定酶解液中还原糖含量[10]。选取生长较快、产圈较大的菌株M1、A1、A2、A3、B1进行酶活测定。将各菌株接种于产酶培养基中,30℃,180 r·min-1培养,分别于12、24、36、48、60、72 h取10 mL菌液,4 000 r·min-1离心15 min后取上清液,测定其中还原糖的含量,根据还原糖的产量确定纤维素酶的活力。酶活定义为:在上述条件下,每1 mL纤维素初酶液在1 min内水解CMC-Na,生成1 μg的葡萄糖,称为一个酶活力单位(U)。 1.2.3 温度对纤维素降解菌生长及产酶能力的影响
将5株菌株分别接种于CMC平板和产酶培养基中,分别在25、30、35、40、45、50℃下培养6 d,每日观察记录菌落的生长情况,并测定酶活性大小。 1.2.4 分离菌株的菌种鉴定
从形态学、生理生化特征和分子生物学方面对产酶能力最强的菌株A3进行菌种鉴定。分离菌株的生理生化特征检测参照文献[11]。用柱式细菌基因组DNA抽提试剂盒(上海生工)提取菌株的基因组DNA作为PCR反应模板,采用细菌16S rRNA基因通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)扩增细菌16S rDNA[12]。PCR反应体系(50 μL):dNTP (25 mmol·L-1)1 μL,正向和反向引物(1 mmol·L-1)各2 μL,10×buffer 5 μL,模板DNA 1 μL,Mg2++(25 mmol·L-1)3 μL,Taq酶(5 U·μL-1)1 μL,超纯水35 μL。PCR扩增程序为95℃预变性5 min;94℃变性30 s,56℃退火40 s,72℃延伸1 min,循环30次;72℃延伸10 min。PCR产物采用纯化试剂盒纯化,测序由上海生工生物股份有限公司完成。测序结果提交GenBank进行BLAST比对,用MEGA 5.0软件构建系统进化树。 1.2.5 数据处理
本研究所有试验均重复3次,对3次重复试验获得的数据计算平均值,试验数据采用SPSS 18.0软件进行统计分析,利用Duncan法对不同处理进行差异显著性比较。 2 结果与分析 2.1 产酶菌株筛选
本试验经过对样品富集培养和梯度稀释分离后,获得具有纤维素酶活的菌株5株,编号分别为M1、A1、A2、A3、B1,分别接入斜面培养基保存备用。如表 1所示,培养72 h后,各菌株的透明圈直径与菌株直径的比值均达到2.0以上。其中菌株A3的菌落直径最小,但透明圈直径最大,达18.2 mm (表 1和图 1),A值为4.2,初步说明该菌株产纤维素酶的能力较强。
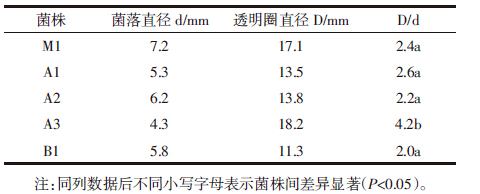 |

|
| 图 1 菌株A3刚果红染色结果 Figure 1 The clear zone of A3 on the cellulose-congo red medium |
从表 2结果可知,培养12 h后,各菌株培养液中均检测到纤维素酶活,随着培养时间的延长,各菌株酶活性均有一定增加。在试验时间范围内,菌株M1、A1的酶活性在接种后60 h达到最高,菌株A2、A3的酶活性在接种后72 h达到最高,B1菌株的酶活性在48 h达到最大值。
 |
表 3结果显示,各菌株在30~45℃温度范围内均生长良好,其中菌株A1在温度达到50℃时仍能较好地生长,说明其耐高温能力比较强。不同的培养温度对各菌株培养液的纤维素酶活性有较大影响,菌株M1、A1、A2、A3出现最高酶活性的温度分别是40、30、30、30℃,最大酶活力分别是72.62、85.60、69.08、121.40 U·mL-1。菌株B1在培养温度为35℃时,纤维素酶活达到最大,与30℃时无显著性差异(P>0.05),温度过高会导致其酶活下降。
 |
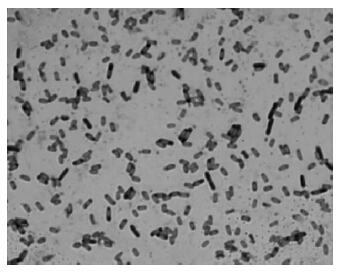
利用试剂盒提取菌株A3的基因组DNA,进行16S rDNA PCR扩增。PCR扩增产物经1%琼脂糖凝胶电泳,可见一大小约1.5 kb的条带。测序结果表明,该菌株16S rDNA序列为1 456 bp,序列比对结果表明,菌株A3与Bacillus licheniformis 16S rDNA序列同源性为99%,将获得的序列与已报道的16S rDNA序列用CLUSTALX和PHYLIP软件进行比对分析和构建系统发育树,结合菌株形态学观察(图 2)和生理生化特征,将该菌鉴定为地衣芽孢杆菌,系统发育树如图 3所示。
|
| 图 2 菌株A3菌体形态 Figure 2Cell morphology of strain A3m |

|
| 图 3菌株A3基于16S rDNA序列系统发育分析 Figure 3Phylogenetic tree for A3 based on the sequence comparability of 16S rDNA |
本研究选择湖南地区本土运行的5年期发酵床垫料作为菌种分离源,主要因为发酵床垫料中含有大量的谷壳、锯末等富含纤维素的物质[5],为纤维素降解菌生长提供了适宜的环境;另外,这些纤维素降解菌在发酵床垫料中经过多年自然驯化,其分解性能相对稳定、高效。
为了获得酶活较高的纤维素降解菌,国内外研究工作者对产纤维素酶微生物进行了大量的分离筛选工作,建立起了较为完善的分离筛选方法[13, 14]。目前,已发现能够产纤维素酶的微生物种类较多,但纤维素酶的比活力一般都很低[8],因而产酶成本高。因此,本研究希望筛选纤维素酶比活力高的菌株,有效地缩短堆肥周期,提高发酵床垫料的腐熟效果。本实验所获得的地衣芽孢杆菌生长速度快,分解纤维素能力强,在发酵床垫料堆肥腐熟中具有潜在的应用前景。另外,芽孢杆菌因芽孢的形成,在耐酸碱、耐高温、适应环境方面有明显的优势[15],方便了该菌剂的生产、储存,从而能更好地应用于实际操作和生产。
鉴于纤维素降解菌的产酶能力受培养基营养组成和培养时间、温度影响较大[16],所以进一步的研究可以放在对分离得到的各菌株产酶培养条件优化上,验证各菌株对自然界中天然纤维素材料,如谷壳、秸秆等的腐熟降解效果。 4 结论
本研究从发酵床垫料中分离出5株具有降解活性的纤维素降解菌,其中菌株A3透明圈直径与菌落直径的比值(D/d)最大,达到4.2,说明该菌株降解纤维素能力较强。对其16S rDNA序列进行分析,结合形态学观察和生理生化特征,将该菌鉴定为地衣芽孢杆菌(Bacillus licheniformis)。通过对不同时间和培养温度菌株M1、A1、A2、A3、B1纤维素酶活的测定可以看出,培养时间和温度对菌株的酶活力影响较大,各菌株的产酶最适温度为30~40℃。本研究筛选获得的野生菌株地衣芽孢杆菌A3分解纤维素能力强,对环境友好,在发酵床垫料堆肥腐熟方面有很好的潜在应用价值。
| [1] | 杨朝飞.加速畜禽粪便污染防治迫在眉睫[J].环境保护, 2001(2): 32-35. YANG Chao-fei. Pollution control of livestock breeding wastes is extremely urgent[J]. Ecology and Natural Conservation, 2001(2): 32-35. (in Chinese) |
| [2] | 栾经峰, 董德州, 卜华. 微生态发酵床养猪技术的应用[J].新农村 (黑龙江), 2010(8): 68-69. LUAN Jing-feng, DONG De-zhou, PU Hua. The application of the technology of pig fermentation bed[J]. New Countryside, 2010(8): 68-69.(in Chinese) |
| [3] | 王远孝, 李雁, 种翔, 等. 猪用发酵床的研究与应用[J]. 家畜生态学报, 2007, 28(6): 139-142. WANG Yuan-xiao, LI Yan, ZHONG Xiang, et al. Research and applicationofbiologybedforpigs[J].Acta Ecologiae Animalis Domastici, 2007, 28(6): 139-142.(in Chinese) |
| [4] | 黄振兴,陈谊.猪粪尿零排放无污染研究与可行性探导[J]. 上海畜 牧兽医通讯, 2001(6): 10-11. HUANG Zhen-xing, CHEN Yi. Research on emissions of pig wastes[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2001 (6): 10-11.(in Chinese) |
| [5] | 尹红梅, 陈文辉, 王震, 等.发酵床陈化垫料腐解复合微生物菌剂筛选[J].家畜生态学报, 2013, 34(12): 30-33. YIN Hong-mei, CHEN Wei-hui, WANG Zhen, et al. Screening of composite microbial agents for promoting the decomposition of aging dunnage[J]. Acta Ecologiae Animalis Domastici, 2013, 34(12): 30-33.(in Chinese) |
| [6] | 廖青, 江泽普, 邢颖, 等.发酵床中纤维素降解菌的分离与鉴定 [J]. 生物技术通报, 2014(3): 106-110. LIAO Qing, JIANG Ze-pu, XING Ying, et al. Isolation and identification of cellulose-decomposing microorganisms in deep-litter system[J]. Biotechnology Bulletin, 2014(3): 106-110.(in Chinese) |
| [7] | 文少白,李勤奋, 侯宪文,等.微生物降解纤维素的研究概况[J].中国 农学通报, 2010, 26(1): 231-236. WEN Shao-bai, LI Qin-fen, HOU Xian-wen, et al. Recent advances in microbial degradation of cellulose[J]. Chinese Agricultural Science Bulletin, 2010, 26(1): 231-236.(in Chinese) |
| [8] | 廖咏梅,王佳婧.纤维素分解菌的分离与筛选[J].西华师范大学学报, 2013, 34(3): 241-245. LIAO Yong-mei, WANG Jia-jin. Isolation and screening of cellulosedecomposing microorganisms[J]. Journal of China West Normal University, 2013, 34(3): 241-245.(in Chinese) |
| [9] | 房兴堂,陈宏, 赵雪锋,等.秸秆纤维素分解菌的酶活力测定[J].生物技术通讯, 2007, 18(4): 628-630. FANG Xing-tang, CHEN Hong, ZHAO Xue-feng, et al. Determination of enzyme activity of straw cellulose-decomposing microorganisms[J]. Letters in Biotechnology, 2007, 18(4): 628-630.(in Chinese) |
| [10] | 张丽青, 吴海龙,姜红霞,等.纤维素降解细菌的筛选及其产酶条件 优化[J].环境科学与管理, 2007, 32(10): 110-114. ZHANG Li-qing, WU Hai-long, JIANG Hong-xia, et al. Screening on bacteria capable of degrading cellulose and optimizing its conditions for cellulase production[J]. Environmental Science and Management, 2007, 32(10): 110-114.(in Chinese) |
| [11] | 钱柔存, 黄仪秀.微生物学实验教程(第2版)[M]. 北京: 北京大学 出版社, 2008: 113-125. QIAN Cun-rou, HUANG Yi-xiu. Laboratory experimets in microbiology[M]. Beijing: Peking University Press, 2008: 113-125.(in Chinese) |
| [12] | 楼秀玉,张晨,张小美,等.抗烟曲霉乳酸菌菌株的筛选、鉴定及特性初步研究[J].浙江农业学报, 2013, 25(1): 176-181. LOU Xiu-yu, ZHANG Chen, ZHANG Xiao-mei, et al. Isolation and identification of the strain of lactic acid bacteria inhibiting Aspergillus fumigatus and its properties[J]. Acta Agriculturae Zhejiangensis, 2013, 25(1): 176-181.(in Chinese) |
| [13] | 李平, 王焰新, 刘琨, 等. 高效纤维素降解菌系的构建[J]. 中国地质大学学报, 2009, 34(3): 533-538. LI Ping, WANG Yan-xin, LIU Kun, et al. Construction of a microbial systemfor efficient degradation of cellulose[J]. Journal of China University of Geosciences, 2009, 34(3): 533-538.(in Chinese) |
| [14] | 李路军, 游银伟, 任鹏飞, 等. 一株具有纤维素降解能力的链霉菌LLJ-03的鉴定及初步研究[J]. 西南农业学报, 2010, 23(4): 1253-1256. LI Lu-jun, YOU Yin-wei, REN Peng-fei, et al. Identification and preliminary study on cellulose-degrading Actinomycetes LLJ-03[J]. Southwest China Journal of Agricultural Sciences, 2010, 23(4): 1253-1256.(in Chinese) |
| [15] | 张立静,李术娜,朱宝成.高效纤维素降解菌短小芽孢杆菌T-7的筛选、鉴定及降解能力的研究[J].中国农学通报, 2011, 27(7): 112-118. ZHANG Li-jing, LI Shu-na, ZHU Bao-cheng, et al. Screening, identification and degradation conditions of cellulose decomposing bacteria Bacillus pumilus T-7[J]. Chinese Agricultural Science Bulletin, 2011, 27(7): 112-118.(in Chinese) |
| [16] | 吴翔,陈强,徐丽华,等.一株降解纤维素的高温放线菌的筛选及其产酶条件研究[J].农业环境科学学报, 2007,26(增刊):101-104. WU Xiang, CHEN Qiang, XU Li-hua, et al. Screening of a cellulose-decomposing thermoactinomyces strain and its enzyme produing conditions[J]. Journal of Agro-Environment Science, 2007, 26(supplement): 101-104.(in Chinese) |
 2015, Vol. 32
2015, Vol. 32




