文章信息
- 覃潇敏, 郑毅, 汤利, 龙光强
- QIN Xiao-min, ZHENG Yi, TANG Li, LONG Guang-qiang
- 施氮对间作条件下玉米、马铃薯根际微生物群落功能多样性的影响
- Effects of Nitrogen Application Rates on Rhizosphere Microbial Community Functional Diversity in Maize and Potato Intercropping
- 农业资源与环境学报, 2015, 32(4): 354-362
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0353
-
文章历史
- 收稿日期:2014-12-12
2. 西南林业大学, 云南 昆明 650224
2. Southwest Forestry University, Kunming 650224, China
微生物是土壤中最具活力的组成部分,不仅参与土壤有机质的分解过程和矿化作用,还促进养分的循环,是构成土壤肥力的重要因素。其中,微生物群落结构或微生物多样性与土壤可持续利用密切相关,可作为生物指标指示土壤质量、评价土壤肥力[1]。土壤微生物功能多样性,与土壤C、N、P等元素循环转化的生物化学过程之间的关系非常密切[2]。因此,土壤微生物群落功能多样性是描述土壤微生物群落特征的一个重要指标,反映了土壤中微生物的生态特征和土壤状况的重要信息。BIOLOG 微平板分析法是测定土壤微生物对不同碳源利用能力及其代谢差异,进而用以表征土壤微生物功能多样性的一种方法,目前已经广泛应用于土壤微生物群落功能多样性的研究[3, 4, 5]。
施肥是影响土壤质量和可持续发展的重要措施之一[6],合理施肥不仅为作物提供所需养分,促进作物的生长发育,而且能增加土壤微生物的数量,提高土壤微生物活性,从而改变土壤理化性状,提高土壤肥力。微生物群落功能多样性对土壤管理具有重要指示作用,施肥是土壤质量变化的灵敏指标。已有研究表明,施肥可以提高土壤微生物群落代谢功能多样性[7, 8]。
间套作作为我国传统农业的精髓,不但能显著提高植物的光合效率、抑制杂草滋生和病虫危害,而且能够改善土壤根际微环境,可获得比单作更高的产量和经济效益[9, 10, 11]。玉米是我国主要的粮食作物,马铃薯也是西南地区主要的粮食、经济作物,玉米与马铃薯间作是一种代表高、矮秆作物的典型配置,是重要的多熟种植和立体栽培方式之一,能够提高光能利用率,发挥不同作物的空间互补作用,在云南地区普遍实施种植。研究表明,玉米马铃薯间作可以增加土壤微生物的数量[12],但不同施氮量对间作条件下作物土壤微生物群落代谢多样性的影响缺乏系统的研究。为此,本研究通过田间试验,采用传统的培养法和BIOLOG技术对不同施氮水平下玉米-马铃薯间作根际土壤微生物群落及碳源代谢多样性的变化进行研究,旨在为玉米-马铃薯间作这一种植模式的经济施肥及优质高产提供科学理论依据。 1 材料与方法 1.1 供试材料
供试地点:试验地位于云南农业大学寻甸大河桥农场,地理坐标为23°32′N、103°13′E,海拔1 953.5 m,地处昆明市东北部,气候条件属北亚热带季风气候,年平均气温14.7℃,年降水量1 040 mm。其土壤基本理化性状为:有机质含量25.06 g·kg-1,碱解氮87.37 mg·kg-1,速效磷23.31 mg·kg-1,速效钾207.82 mg·kg-1,pH值为6.79。
供试作物:供试玉米(Zea mays L),品种为寻单7号;马铃薯(Solanum tuberosum L),品种为会-2。 1.2 研究方法 1.2.1 试验设计
小区试验采用裂区区组设计,以种植模式为主处理,施氮量为副处理,每个处理设3次重复,设4个施氮量水平,分别为不施氮肥N0 (0 kg·hm-2)、低氮处理N1 (125 kg·hm-2)、常规施氮处理N2 (250 kg·hm-2)、高氮处理N3 (375 kg·hm-2),种植方式为玉米//马铃薯间作(玉米和马铃薯各2行),共4个处理,12个小区,每个小区面积32.50 m2 (5 m×6.5 m)。试验于2013年4月15日种植马铃薯,2013年5月3日种植玉米。
供试肥料分别为尿素、普通过磷酸钙、硫酸钾。玉米氮肥施用分3次,分别为40%、25%和35%;马铃薯氮肥施入2次,分别为60%和40%;磷肥(P2O5)75 kg·hm-2,钾肥(K2O)125 kg·hm-2,均以基肥形式施入,各小区施肥量相同。马铃薯、玉米生育过程中中耕、培土、除草、病虫害防治等田间管理各处理保持一致。
玉米种植行距0.5 m,株距0.25 m;马铃薯种植行距0.5 m,株距0.35 m。间作小区中玉米、马铃薯的种植密度与单作的相同,生长期间管理措施按当地习惯进行。
于2013年8月21日玉米(马铃薯)成熟期进行采样,先将植株根系从土壤中整体挖出,采用抖土法抖掉与根系松散结合的土,然后将与根系紧密结合的土壤刷下来作为根际土样品。间作处理中,每个小区随机选2个间作带,每个间作带内2种作物分别取2株,然后将4株作物的根际土壤混合为1个样品,将土样于4℃冰箱保存,用于平板菌落计数和BIOLOG微平板分析。 1.2.2 测定方法
土壤微生物含量采用稀释平板菌落计数法[13],细菌、真菌和放线菌培养分别用牛肉膏蛋白胨培养基、马丁氏琼脂培养基和高氏1号培养基;土壤微生物代谢功能多样性测定采用BIOLOG ECO微平板方法[14]。 1.2.3 数据处理
(1)微平板孔中溶液吸光值平均颜色变化率AWCD用于描述土壤微生物代谢活性,计算公式如下:
AWCD=∑(Ci-Ri)/n
式中,Ci为每个有培养基孔的吸光值,Ri为对照孔的吸光值,n为培养基孔数,BIOLOG ECO板n值为31。
(2)Shannon-Wiener指数H用于评估物种的丰富度,计算公式如下:
H=-∑Pi(lnPi)
式中,Pi为第i孔的相对吸光值与所有整个微平板的相对吸光值总和的比值,计算公式:
Pi=(Ci-Ri)/∑(Ci-Ri)
(3)Shannon-Wiener均匀度指数E,计算公式如下:
E=H/lnS
式中,S为颜色变化孔数
(4)Simpson优势度指数D用于评估某些最常见种的优势度,计算公式如下:
D=1-∑Pi2
(5)碳源利用丰富度指数S:
S=被利用碳源的总数 1.2.4 数据统计分析
测定数据利用Microsoft Excel 2010进行数据初处理、制图和主成分分析,采用SPSS 19.0软件包进行统计方差分析及聚类分析。 2 结果与分析 2.1 施氮对间作玉米、间作马铃薯根际微生物数量的影响
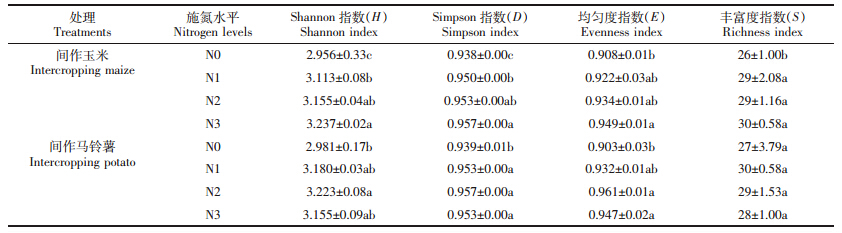
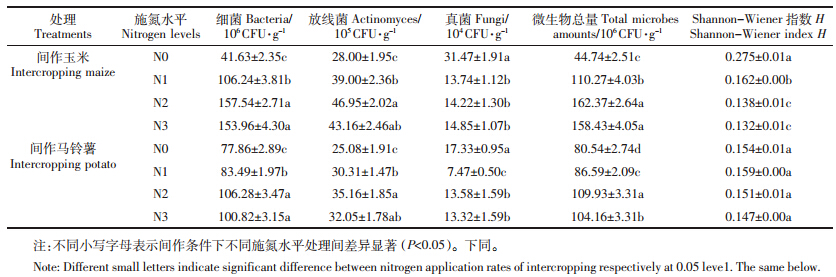
由表 1可知,间作条件下,施氮显著增加了玉米、马铃薯根际的细菌、放线菌数量及微生物总量,却显著降低了真菌的数量(P<0.05)。与N0相比,在N1、N2和N3水平下,间作玉米根际土壤细菌分别增加了155.20%、278.43%和269.83%,放线菌分别增加了39.27%、67.66%和54.12%,微生物总量增加了146.47%、262.92%和254.11%,真菌分别降低了56.34%、54.81%和52.81%;间作马铃薯根际土壤细菌分别增加了7.23%、36.50%和29.49%,放线菌分别增加了20.85%、40.19%和27.79%,微生物总量增加7.51%、36.49%和29.33%,真菌分别降低了56.90%、21.64%和23.14%。施氮也显著降低了间作玉米土壤微生物多样性指数,却对间作马铃薯土壤微生物多样性指数无显著影响。
 |
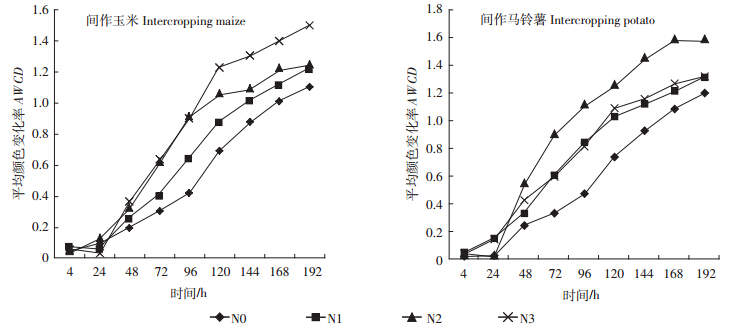
平均颜色变化率(AWCD)表征微生物群落碳源利用率,是土壤微生物群落利用单一碳源能力的一个重要指标,反映了土壤微生物活性、微生物群落生理功能多样性[15]。从AWCD值变化(图 1)发现,AWCD值随培养时间的延长而提高,各处理的AWCD值在 24 h之前很小,说明在24 h之内碳源基本未被利用;培养24 h后AWCD值快速升高,反映出此后碳源被快速利用,随后AWCD值缓慢增加直至趋于稳定。由图 1可知,在培养期间,N1、N2和N3处理的AWCD值基本上均高于N0处理,间作玉米以N3处理的增长斜率最大,间作马铃薯以N2处理的增长斜率最大。培养120 h时,间作条件下,N1、N2、N3施氮处理下玉米根际土壤微生物的AWCD值比N0处理分别增加25.50%、53.89%和76.66%;马铃薯分别增加39.43%、70.66%和47.64%,且差异显著(P<0.05)。由以上分析可知,施氮可以提高土壤微生物的碳源利用能力和整体代谢活性。
|
| 图 1 不同施氮水平的平均颜色变化率(AWCD) Figure 1 AWCD of different N application rates |
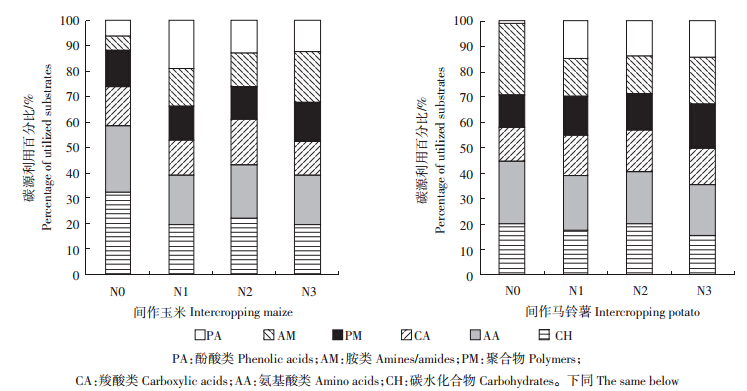
土壤微生物活性反映了群落总体的变化,但未能反映微生物群落代谢的详细信息,研究土壤微生物对不同碳源利用能力的差异,有助于更全面地了解微生物群落代谢功能特性[16]。由图 2可知,整体上,间作玉米根际微生物对糖类和氨基酸类利用较高,间作马铃薯以对糖类、氨基酸和胺类利用较高。
|
| 图 2 根际微生物对碳源利用百分比 Figure 2 Percentage of utilized substrates of microbe in rhizosphere |
施氮对BIOLOG ECO板中每一种碳源的利用均有影响(图 3),施氮增加了根际微生物对6类碳源的利用。整体而言,间作玉米的糖类碳源总体上表现为N3>N2>N0>N1,羧酸类碳源的总体上表现为N2>N3>N1>N0,酚酸类总体上表现为N1>N3>N2>N0,氨基酸、聚合物和胺类碳源的总体上均表现为N3>N2>N1>N0,只有胺类、酚酸类达到显著性水平(P<0.05);间作马铃薯的糖类、羧酸类碳源的利用总体上表现为N2>N1>N3>N0,氨基酸、酚酸类总体上均表现为N2>N3>N1>N0,聚合物类总体上表现为N3>N2>N1>N0,胺类总体上表现为N3>N0>N2>N1,而羧酸类、聚合物类和酚酸类均达到显著性水平(P<0.05)。
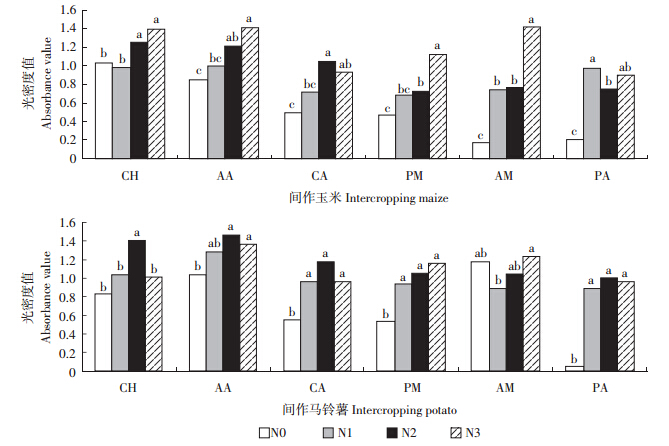
|
| 图 3 根际微生物对6类碳源的利用强度 Figure 3 Utilization intensity of rhizosphere microbe to six types of carbon source |
土壤微生物群落功能多样性是土壤微生物群落状态与功能的指标,反映土壤中微生物的生态特征。如表 2显示,BIOLOG微平板培养120 h时,间作玉米的Shannon-Wiener指数(H)、Simpson指数(D)、均匀度指数(E)、丰富度指数(S)均以N3处理最高,分别比N0处理高9.51%、2.03%、4.52%和15.38%,并且差异显著(P<0.05);间作马铃薯的Shannon-Wiener指数(H)、Simpson指数(D)、均匀度指数(E)均以N2处理最高,分别比N0处理高8.12%、1.92%和6.42%,并且差异显著(P<0.05),而丰富度指数(S)则以N1处理最高,比N0处理高11.11%。
聚类分析可以将抽象对象的集合分组成为由类似的对象组成的多个类别,可以更直观地显示各研究对象之间的远近关系,通过对不同处理31种碳源 120 h的平均碳源利用率(AWCD)进行聚类分析(图 4)可以看出,间作玉米各施氮处理的土壤微生物群落结构均在距离尺度10处聚为3类,这3类微生物群落利用碳源具有不同的碳源利用模式,其中N0、N1处理微生物群落利用碳源较为相似;间作马铃薯各施氮处理的土壤微生物群落结构均在距离尺度10处聚为2类,这2类微生物群落利用碳源具有不同的碳源利用模式,其中N1、N2、N3处理微生物群落利用碳源较为相似。
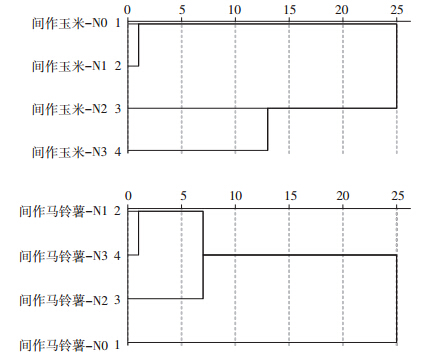
|
| 图 4 不同施氮处理根际微生物群落聚类分析图 Figure 4 Cluster analysis for rhizosphere microbial communities of different N treatments |
主成分分析是处理数学降维的一种方法,将多个变量通过线性变换以选出较少个数重要变量。主成分个数的提取原则是相对应特征值大于1的前m个主成分。根据此原则,间作玉米共提取出了8个主成分,累计贡献率达到96.1%,其中第1主成分(PC1)贡献率是30.3%,第2主成分(PC2)贡献率是18.5%;间作马铃薯共提取出9个主成分,累计贡献率达到96.8%,其中第1主成分(PC1)贡献率是30.6%,第2主成分(PC2)贡献率是17.2%。因第3~8主成分贡献率较小,所以本文取前2个主成分(PC1和PC2)的得分作图来表征微生物群落碳源代谢特征。
间作玉米根际微生物群落的PCA分析表明(图 5-A1),不同施氮水平在主成分坐标体系中差异十分明显,即土壤微生物功能多样性差异明显。在PC1,不施氮对照(N0)、低氮(N1)处理与中氮(N2)处理、高氮(N3)处理间有很好的分离,N2和N3处理分布在PC1的正方向,N0和N1处理分布在PC1负方向上。PC2 将N2处理与N0、N1、N3处理较好区分,N3处理分布在 PC2的负端,N2处理分布在PC2的正端,N0、N1处理在PC2正负方向上均有分布。同时,由图 5-A2还可以得出,间作玉米根际土壤微生物利用较强的10种碳源分别是2(聚山梨醇酯40)、3(聚山梨醇酯80)、8(β-甲基-D-葡萄糖苷)、14(1-磷酸葡萄糖)、15(L-α-甘油磷酸)、16(D-半乳糖酸-γ-内酯)、17(D-半乳糖醛酸)、23(D-苹果酸)、26(L-丝氨酸)和30(苯乙胺)。
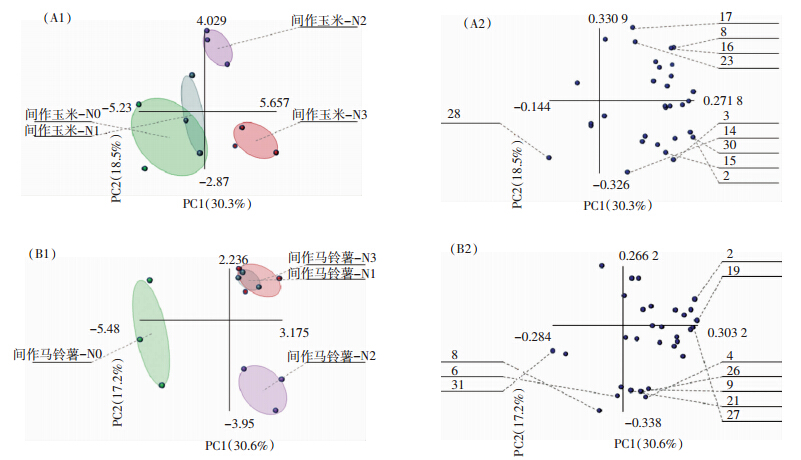
|
| 图 5 不同施氮处理根际微生物群落功能主成分分析图 Figure 5 Principal component analysis for rhizosphere microbial communities of different N treatments |
间作马铃薯根际微生物群落的PCA分析表明(图 5-B1),在PC1,不施氮(N0)与低氮(N1)处理、中氮(N2)处理、高氮(N3)处理间有很好的分离,N1、N2和N3处理分布在PC1的正方向,N0处理在PC1正负方向上均有分布。PC2将N0、N2处理与N1、N3处理较好区分,N2处理分布在PC2的负端,N1、N3处理主要出于PC2的正端,N0处理在PC2正负方向上均有分布,说明施氮改变了马铃薯根际微生物的群落功能多样性。同时,由图 5-B2也可得出,间作马铃薯根际土壤微生物利用较强的10种碳源分别为2(聚山梨醇酯40)、4(环糊精、6.D-纤维二糖)、8(β-甲基-D-葡萄糖苷)、9(D-木糖)、19(4-羟基苯甲酸)、21(衣康酸)、26(L-苯基丙氨酸)、27(L-丝氨酸)和31(腐胺)。
进一步对主成分进行方差分析可知,不同处理在PC1和PC2上得分系数出现显著差异(P<0.05),在PC1轴上间作玉米和间作马铃薯的不施氮处理(N0)与施氮处理(N1、N2、N3)差异均显著,即不同施氮处理对土壤微生物的碳源利用类型有显著影响,显示出微生物群落碳源代谢的多样性;在PC2轴上不施氮处理与各施氮处理间差异均不显著。 3 讨论 3.1 施氮对间作玉米、间作马铃薯根际微生物数量的影响
土壤微生物是土壤生态系统的重要组分,主导土壤生态系统养分循环和能量流动,对于维持系统的稳定性和可持续性具有重要的作用[17]。有研究指出,土壤微生物群体变化与化肥用量有关,无机肥料深刻影响着土壤微生物的生存环境及土壤微生物群落多样性[18, 19]。张向前等[20]研究发现,不同施氮条件下间作可明显增加土壤中细菌、真菌、放线菌和固氮菌的数量。董艳等[21]研究表明,施氮可以增加间作条件下小麦根际细菌、真菌和放线菌数量。本研究平板稀释法结果表明,随着施氮量的增加,间作玉米及间作马铃薯根际土壤细菌、放线菌的数量及微生物总量呈先增后减,以N2处理有利于保持较高的土壤微生物数量,这可能是作物根系分泌大量高C/N的碳源,造成根际形成缺氮的微域环境[22],所以在一定施氮范围内,随施氮量的增加,微生物数量相应增加,当施氮水平过高时则会导致碳源不足,使根际微生物数量相应降低,同时间作系统中作物根系的互作可以使根系土壤中含有更多的维生素、碳水化合物、氨基酸和有机酸等,从而提高了微生物数量[23, 24]。本试验条件下,施氮却对玉米及马铃薯根际土壤真菌表现出一定的抑制作用,随着施氮量的增加呈降低的趋势,这说明玉米马铃薯间作这一种植体系与现有的豆科禾本科这一研究较多的间作体系存在一定的区别,造成差异的原因可能是由于间作作物搭配、土壤类型、土壤养分含量存在差异以及肥料用量不同所导致。 3.2 施氮对间作玉米、间作马铃薯根际微生物功能多样性的影响
一定条件下,肥料合理配施可以提高微生物对碳源的利用效率,显著增加微生物功能多样性,这主要是合理施肥能够增加根系的分泌物,提供给土壤微生物更多的能源物质,从而提高土壤微生物量[25]。同时,间作种植模式下由于存在2种作物的根系分泌物,这些分泌物可以为根际微生物提供生长繁殖所需的能源,影响根际微生物的数量和群落结构的变化,进而表现出土壤微生物整体活性的提高[26]。董艳等[21]研究表明,N1、N2和N3处理的蚕豆根际微生物群落碳源利用率(AWCD)高于N0处理,其中N3处理最高。章家恩等[27]在研究玉米-花生间作对土壤微生物和土壤养分状况的影响时发现,间作作物根区微生物群落功能多样性和代谢活性比单作有所改善。本试验条件下,间作种植下施氮可显著提高玉米、马铃薯根际土壤微生物群落碳源利用率(AWCD),玉米表现为N3>N2>N1>N0,马铃薯表现为N2>N3>N1>N0,与上述研究一致。
物种丰富度(H)、均匀度指数(E)、优势度指数(D)和碳源利用丰富度指数(S)是表征群落多样性的常用指数,可以揭示土壤微生物种类和功能的差异[28]。夏雪等[7]研究发现,氮肥可以提高微生物群落的丰富度和功能多样性,中量氮肥的土壤微生物群落丰富度指数(S)和Shannon-Wiener指数(H)最高。谢文军等[29]研究不同施肥模式土壤微生物功能多样性时同样发现,施用无机化肥(NPK)可以提高土壤微生物的Shannon-Wiener指数,而施腐熟豆饼和秸秆使Shannon-Wiener指数降低。本试验条件下,随着施氮量的增加,间作玉米根际土壤微生物群落Shannon-Wiener指数(H)、Simpson指数(D)、均匀度指数(E)、丰富度指数(S)均呈升高趋势,均在N3处理时最高;而N2处理的间作马铃薯根际土壤微生物群落的Shannon-Wiener指数(H)、Simpson指数(D)、均匀度指数(E)最高,丰富度指数(S)在N1处理时最大。原因可能是一定的范围内,合理施氮肥增加了土壤中的氮素,可以为微生物提供适宜的氮源,改善了土壤养分及调节微生物的营养代谢平衡,而同时间作系统中不同作物会产生不同的特异根系分泌物,并形成与之相适应的根际微生物群落,从而提高土壤微生物的整体代谢活性,促进土壤微生物群落结构多样化的形成。
本试验中,施氮可提高间作种植下根际土壤微生物对糖类、氨基酸类、羧酸类、酚酸类、聚合物类和胺类碳源的利用。对间作玉米来说,氨基酸类、聚合物类和胺类利用表现为N3>N2>N1>N0,与其AWCD值的变化趋势一致,而对糖类、羧酸类和酚酸类的利用各施氮处理间无一致性规律;对间作马铃薯而言,氨基酸类、酚酸类利用表现为N2>N3>N1>N0,糖类、羧酸类利用总体上表现为N2>N1>N3>N0,与AWCD值的变化趋势基本一致,而聚合物类和胺类的利用均在N3施氮处理最大。本研究中,施氮的影响对不同碳源存在一定的差异。
聚类分析显示,间作玉米各施氮处理的根际微生物群落均归为3类,间作马铃薯的土壤微生物群落均归为2类,说明施氮处理使间作作物根际微生物群落在碳源的利用上发生较大的改变。
主成分分析表明,施氮使间作作物根际微生物在碳源的利用上发生了改变,使土壤微生物群落代谢特征发生改变。第1主成分解释了大部分的变异,间作玉米、间作马铃薯各施氮(N0、N1、N2、N3)处理均在主成分1轴上出现明显的分异。其中间作玉米的N2和N3处理分布在PC1的正方向,N0和N1处理在PC1正负方向上均有分布;间作马铃薯的N1、N2和N3处理分布在PC1的正方向,N0处理在PC1正负方向上均有分布。 4 结论
从施氮水平对土壤微生物群落的影响来看,间作条件下玉米、马铃薯根际土壤细菌、放线菌数量及微生物总量在N2处理时最高,而施氮显著降低了真菌的数量;也提高了根际微生物群落碳源利用率、丰富度和功能多样性,N3处理的玉米根际微生物群落的碳源利用率(AWCD)、Shannon-Wiener指数(H)、Simpson指数(D)、均匀度指数(E)及丰富度指数(S)最高,而马铃薯在N2处理时最高;同时也提高了玉米、马铃薯根际微生物对6类碳源的利用,但对6类碳源的利用存在一定的差异。
主成分分析和聚类分析表明,施氮处理使间作条件下作物根际微生物在碳源利用出现较大差异,使土壤微生物群落多样性发生改变。这说明合理施氮和间作种植方式是维持土壤微生物群落功能多样性和土壤生态系统稳定性的重要措施,二者的调控可能存在一定程度的叠加效应。
| [1] | 曹均,吴姬,赵小蓉,等.北京9个典型板栗园土壤碳代谢微生物多样性特征[J].生态学报,2010,30(2):527-532.CAO Jun,WU Ji,ZHAO Xiao-rong,et al.Carbon catabolic diversity characters of 9 chestnut soils in Beijing[J].Acta Ecologica Sinica,2010,30(2):527-532.(in Chinese) |
| [2] | Giller K E,Beare M H,Lavelle P,et al.Agricultural intensification,soil biodiversity and agroco system function[J].Applied Soil Ecology,1997(6):3-16. |
| [3] | Grayston S J,Prescott C E.Microbial communities in forest floors under four tree species in coastal British Columbia[J].Soil Biology and Biochemistry,2005,37(6):1157-1167. |
| [4] | 吴凤芝,王学征,潘凯.小麦和大豆茬口对黄瓜土壤微生物生态特征的影响[J].应用生态学报,2008,19(4):794-798.WU Feng-zhi,WANG Xue-zheng,PAN Kai.Effects of wheat and soybean stubbles on soil microbial ecological characteristics in cucumber field[J].Chinese Journal of Applied Ecology,2008,19(4):794-798.(in Chinese) |
| [5] | 郑华,欧阳志云,王效科,等.不同森林恢复类型对土壤微生物群落的影响[J].应用生态学报,2004,15(11):2019-2024.ZHENG Hua,OUYANG Zhi-yun,WANG Xiao-ke,et al.Effects of forest restoration patterns on soil microbial communities[J].Chinese Journal of Applied Ecology,2004,15(11):2019-2024.(in Chinese) |
| [6] | Hai L,Li X G,Li F M,et al.Long-term fertilization and maturing effects on physically-separated soil organic matter pools under a wheat-wheatmaizecropping systemin an arid region of China[J].Soil Biology and Biochemistry,2010,42(2):253-259. |
| [7] | 夏雪,谷洁,车升国,等.施氮水平对埋娄土微生物群落和酶活性的影响[J].中国农业科学,2011,44(8):1618-1627.XIA Xue,GU Jie,CHE Sheng-guo,et al.Effects of nitrogen application rates on microbial community and enzyme activities in Lou soil[J].Scientia Agricultura Sinica,2011,44(8):1618-1627.(in Chinese) |
| [8] | Li Z P,Wu X C,Chen B Y.Changes in transformation of soil organic C and functional diversity of soil microbial community under different land uses[J].Agricultural Sciences in China,2007,6(10):1235-1245. |
| [9] | 刘景辉,曾昭海,焦立新,等.不同青贮玉米品种与紫花苜蓿的间作效应[J].作物学报,2006,32(1):125-130.LIU Jing-hui,ZENG Zhao-hai,JIAO Li-xin,et al.Intercropping of different silagemaize cultivars and alfalfa[J].Acta Agronomica Sinica,2006,32(1):125-130.(in Chinese) |
| [10] | 杨智仙,汤利,郑毅,等.不同品种小麦与蚕豆间作对蚕豆枯萎病发生、根系分泌物和根际微生物群落功能多样性的影响[J].植物营养与肥料学报,2014,20(3):570-579.YANG Zhi-xian,TANG Li,ZHENG Yi,et al.Effects of different wheat cultivars intercropped with faba bean on faba bean fusarium wilt,root exudates and rhizosphere microbial community functional diversity[J].Journal of Plant Nutrition and Fertilizer,2014,20(3):570-579.(in Chinese) |
| [11] | Suman A,Lal M,Singh A K,et al.Microbial biomass turnover in Indian subtropical soils under different sugarcane intercropping systems[J].Agronomy Journal,2006,98:698-704. |
| [12] | 何国艳.玉米马铃薯间作对土壤微生物多样性的影响[D].昆明:云南农业大学,2012.HE Guo-yan.Effects of maize and potato intercropping on the amount of soil microorganisms[D].Kunming:Yunnan Agricultural University,2012.(in Chinese) |
| [13] | 李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学出版社,2008.LI Zhen-gao,LUO Yong-ming,TENG Ying.Method of soil and environmental microorganisms[M].Beijing:Science Press,2008.(in Chinese) |
| [14] | 董艳,杨智仙,董坤,等.施氮水平对蚕豆枯萎病和根际微生物代谢功能多样性的影响[J].应用生态学报,2013,24(4):1101-1108.DONG Yan,YANG Zhi-xian,DONG Kun,et al.Effects of nitrogen application rate on faba bean fusarium wilt and rhizospheric microbial metabolic functional diversity[J].Chinese Journal of Applied Ecology,2013,24(4):1101-1108.(in Chinese) |
| [15] | Diosma G,Aulicino M,Chidichimo H,et al.Effect of tillage and N fertilization on microbial physiological profile of soils cultivated with wheat[J].Soil&Tillage Research,2006,91:236-243. |
| [16] | WeberKP,Grove J A,Gehder M,et al.Datatransformations in the analysis of community-level substrate utilization data from micro plates[J].Journal of Microbiological Methods,2007,69:461-469. |
| [17] | Schloter M,Dilly O,Munch J N.Indicators for evaluating soil quality[J].Agriculture Ecosystems and Environment,2003,98(1/3):255-262. |
| [18] | 肖新,李英峰,韩贻涛,等.尿素施用量对道地药材滁菊土壤微生物活性的影响[J].水土保持学报,2011,25(5):99-102.XIAO Xin,LI Ying-feng,HAN Yi-tao,et al.Effect of urea fertilizer application on soil microbial activities of Chuzhou Chrysanthemum morifolium Ramat[J].Journal of Soil and Water Conservation,2011,25(5):99-102.(in Chinese) |
| [19] | 杨瑞吉,马海灵,杨祁峰,等.种植密度与施氮量对麦茬复种饲料油菜土壤微生物活性的影响[J].应用生态学报,2007,18(1):113-117.YANG Rui-ji,MA Hai-ling,YANG Qi-feng,et al.Effects of planting density and nitrogen application rate on soil microbial activity under wheat//forage rape multiple cropping[J].Chinese Journal of Applied Ecology,2007,18(1):113-117.(in Chinese) |
| [20] | 张向前,黄国勤,卞新民,等.施氮肥与隔根对间作大豆农艺性状和根际微生物数量及酶活性的影响[J].土壤学报,2012,49(4):732-739.ZHANG Xiang-qian,HUANG Guo-qin,BIAN Xin-min,et al.Effects of nitrogen fertilization and root separation on agronomic traits of intercropping soybean,quantity of microorganism and activity of enzymes in soybean rhizosphere[J].Acta Pedologica Sinica,2012,49(4):732-739.(in Chinese) |
| [21] | 董艳,汤利,郑毅,等.小麦蚕豆间作条件下氮素营养水平对根际微生物区系的影响[J].应用生态学报,2008,19(7):1559-1566.DONG Yan,TANG Li,ZHENG Yi,et al.Effects of nitrogen application rate on rhizosphere microbial community in wheat-faba bean intercroppingsystem[J].Chinese Journal of Applied Ecology,2008,19(7):1559-1566.(in Chinese) |
| [22] | 孔维栋,朱永官,傅伯杰,等.农业土壤微生物基因与群落多样性研究进展[J].生态学报,2004,24(12):2894-2900.KONG Wei-dong,ZHU Yong-guan,FU Bo-jie,et al.A review on microbial gene and community diversity in agricultural soil[J].Acta Ecologica Sinica,2004,24(12):2894-2900.(in Chinese) |
| [23] | 刘广才.不同间套作系统种间营养竞争的差异性及其机理研究[D].兰州:甘肃农业大学,2005.LIU Guang-cai.Difference and its mechanism of interspecific nutrition competition in different intercropping system[D].Lanzhou:Gansu Agricultural University,2005.(in Chinese) |
| [24] | 宋亚娜,MARSCHNER Petra,张福锁,等.小麦/蚕豆,玉米/蚕豆和小麦/玉米间作对根际细菌群落结构的影响[J].生态学报,2006,26(7):2268-2274.SONG Ya-na,MARSCHNER Petra,ZHANG Fu-suo,et al.Effect of intercropping on bacterial community composition in rhizosphere of wheat (Triticum aestivum L),maize (Zea mays L) and faba bean (Vicia faba L)[J].Acta Ecologica Sinica,2006,26(7):2268-2274.(in Chinese) |
| [25] | 樊晓刚,金轲,李兆君,等.不同施肥和耕作制度下土壤微生物多样性研究进展[J].植物营养与肥料学报,2010,16(3):744-751.FAN Xiao-gang,JIN Ke,LI Zhao-jun,et al.Soil microbial diversity under different fertilization and tillage practices:A review[J].Plant Nutrition and Fertilizer Science,2010,16(3):744-751.(in Chinese) |
| [26] | 李鑫,张会慧,岳冰冰,等.桑树-大豆间作对盐碱土碳代谢微生物多样性的影响[J].应用生态学报,2012,23(7):1825-1831.LI Xin,ZHANG Hui-hui,YUE Bing-bing,et al.Effects of mulberrysoybean intercropping on carbon-metabolic microbial diversity in saline-alkaline soil[J].Chinese Journal of Applied Ecology,2012,23(7):1825-1831.(in Chinese) |
| [27] | 章家恩,高爱霞,徐华勤,等.玉米/花生间作对土壤微生物和土壤养分状况的影响[J].应用生态学报,2009,20(7):1597-1602.ZHANG Jia-en,GAO Ai-xia,XU Hua-qin,et al.Effects of maize/peanut intercropping on rhizosphere soil microbes and nutrient contents[J].Chinese Journal of Applied Ecology,2009,20(7):1597-1602.(in Chinese) |
| [28] | 田春杰,陈家宽,钟扬.微生物系统发育多样性及其保护生物学意义[J].应用生态学报,2003,14(4):609-612.TIAN Chun-jie,CHEN Jia-kuan,ZHONG Yang.Phylogenetic diversity of microbes and its perspectives in conservation biology[J].Chinese Journal of Applied Ecology,2003,14(4):609-612.(in Chinese) |
| [29] | 谢文军,周健民,王火焰.重金属Cu2+、Cd2+及氯氰菊酯对不同施肥模式土壤微生物功能多样性的影响[J].环境科学,2008,29(10):2919-2924.XIE Wen-jun,ZHOU Jian-min,WANG Huo-yan.Influence of Cu2+,Cd2+ and cypermethrin on microbial functional diversity in different fertilization soils[J].Environmental Science,2008,29(10):2919-2924.(in Chinese) |
 2015, Vol. 32
2015, Vol. 32