文章信息
- 余银生, 刘春波, 胥腾飞, 宋子琛, 张文曌, 王永忠
- YU Yin-sheng, LIU Chun-bo, XU Teng-fei, SONG Zi-chen, ZHANG Wen-zhao, WANG Yong-zhong
- 基于微生物电解池利用有机废弃物产氢研究进展
- Research Progress of Hydrogen Production fromOrganic Wastes in Microbial Electrolysis Cell(MEC)
- 农业资源与环境学报, 2015, 32(4): 327-331
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2015.0021
-
文章历史
- 收稿日期:2015-01-20
2. 重庆大学生物工程学院, 重庆 400030;
3. 重庆美的通用制冷设备有限公司, 重庆 401336
2. School of Bioengineering, Chongqing University, Chongqing 400030, China;
3. Chongqing Midea General Refrigeration Equipment Co, Ltd, Chongqing 401336, China
当前,世界各国经济发展对能源依赖性不断加强,由此引发了产生能源危机的可能性。氢气作为清洁高效能源具有无污染、可再生、燃烧热值高等优点,被誉为"未来燃料"。另外,作为最基本的工业原料,氢气广泛用于石油化工、电子工业、有机合成、氨合成工业及食品加工等领域[1, 2, 3]。目前,氢气的生产主要包括传统的化学方法和生物方法。化学方法制氢具有能耗高、净增能值低、环境污染大等缺点。而厌氧发酵生物制氢则具有氢气产率低、氢气分离困难等不足。因此,Logan等[4]在微生物燃料电池(MFC)基础上提出了一种新的产氢方法--微生物电解池制氢,Liu等[5]提出了微生物电解池(MEC)的概念。MEC产氢与其他生物制氢方式相比,比产氢率高、可用底物广泛及可承受的温度范围广、兼具电化学和微生物学的优点。相对于传统电解水制氢方式,输入产氢电压低,故MEC电解制氢技术的方式有望成为未来解决可能出现的能源危机的一种有效途径。由于有机废弃物具有成分复杂、含有众多有毒有害物质、酸碱度高等特性,未经处理会引起严重环境污染,而已有的研究表明,有机废水如生活污水、玉米秸秆发酵液、酒厂废水、活性污泥等各种有机废弃物可作为MEC产氢的理想底物来源[6, 7]。
本文结合MEC的工作原理,分析了预处理方式、底物类型、微生物菌群、外加条件(电压、温度、pH值)等因素对MEC利用有机废弃物产氢性能的影响。
1 MEC产氢基本原理MEC根据其反应器的结构类型不同,可分为双室MEC和单室MEC。单室MEC反应器的阴极和阳极没有用质子交换膜隔开,结构较简单、成本低。双室MEC包含阴极室、阳极室,以及中间的质子交换膜。双室MEC阴极和阳极由质子交换膜隔开,因此产生的氢气与其他气体分开,不仅有效地提高了产生氢气的纯度,还降低了后期产物分离所需经济投入。MEC运行时,阳极微生物将有机废弃物中的有机物氧化,产生氢离子和电子,所产生的电子通过介体或者微生物的呼吸链传递到MEC的阳极,并经导线由外电路传至阴极,氢离子则通过质子交换膜或者直接传递到阴极,低电压下阴极室中的氢离子接受电子而产氢[8]。以下以乙酸为例阐述MEC产氢的具体工作原理,乙酸在微生物的作用下分解生成CO2、H+和电子,H+向阴极运动,电子在电势差的作用下沿外电路传导至阴极,H+与来自外电路的电子在阴极结合发生还原反应生成H2,然后在阴极侧顶部收集H2,在阳极侧顶部收集CO2,从而在微生物电解池内产氢。以乙酸为底物的MEC生物制氢的反应方程式如下:
总反应方程式:
CH3COOH+2H2O→2CO2+4H2
阳极反应方程式:
CH3COOH+2H2O-8e-→2CO2+8H+
阴极反应方程式:
8H++8e-→4H2
MEC产氢效率比微生物发酵产氢高,并能将有机物彻底氧化,因此为有效处理和回收有机废水和农林废弃物提供了可能。MEC (单室和双室结构)产氢的工作原理如图 1所示。

|
| 图 1 MEC产氢示意图 Figure 1 The schematic diagram of MEC |
目前,以MEC为基础,建立起以有机废水、农林废弃物等有机废物为底物的MEC系统中,预处理方式、底物类型、产氢菌群、外加条件(电压、温度、pH值)等对系统的运行性能和产氢效率都有极大影响,改善运行条件可以改善MEC性能,进而提高产氢效率。
2.1 预处理方式对MEC产氢性能的影响适当的预处理如酸碱预处理、化学氧化预处理、热预处理、机械预处理等方式可以有效破坏有机废弃物中微生物细胞壁,可释放胞内的有机物质,同时还可降解细胞壁外的胞外聚合物(EPS),增加有机废弃物液相中有机物的浓度,在胞外酶的作用下水解成易于被微生物利用的小分子有机物从而提高产氢速率。活性污泥是有机废水的主要副产物,直接丢弃或填埋造成严重的环境问题,厌氧生物方法也伴随着效率低、有机物分解不彻底等局限,因此剩余污泥的采用预处理以实现能量充分回收和产氢性能改善是国内外学者的研究焦点。刘常青等[9]发现利用酸性预处理方式可抑制污泥中的耗氢微生物,提高污泥厌氧发酵的产氢量,当预处理酸液pH=2.0时,对耗氢微生物抑制作用最明显,但同时也抑制了产氢微生物的生物活性,当预处理酸液pH=3.0时,H2产量最高,酸性预处理促进了微生物的融胞作用,增加污泥体系中的溶解性蛋白质和糖。
此外,添加适当的氧化剂如氯氧化剂、O3、H2O2、过氧乙酸等氧化污泥胞外聚合物和细胞壁,使细胞中的有机物质释放到细胞外,同时还可提高有机物的降解率,提高反应速率。康灵玲[10]以化学预处理后的污泥厌氧发酵液作为MEC产氢底物,实验结果表明氢氧化钠、过氧乙酸等处理后底物产氢能力较高,而鼠李糖脂最低。机械预处理也可以提高氢气产量,Cheng等[11]研究了降解有机废弃物同时产氢的MEC系统。以活性污泥为底物,经超声波处理后,可使有机废弃物中的短链脂肪酸接近90%地转化为氢气。为消除生物产氢系统接种污泥中的耗氢菌,加速系统的启动进程并提高产氢效能,以啤酒厂废水处理车间的厌氧颗粒污泥为对象,经热处理后的产氢系统,其产氢量均大于未经处理的活性污泥系统,其中,经95℃处理过的厌氧活性污泥具有更高的发酵产氢性能[12]。故采用合理的预处理方式,可以有效提高有机废弃物中有机物的利用效率,提高氢气产量和系统的能量回收率。
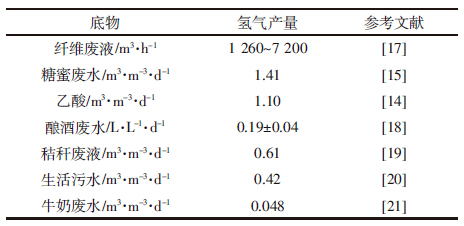
2.2 底物类型对MEC产氢性能的影响在MEC的研究中所采用实际底物有生活污水、发酵废液、垃圾浸出液、活性污泥、有机酸、纤维素等有机废弃物。由于氢被微生物消耗会带来电子损失,使得电子在MEC运行中的分配情况较为复杂[13]。此外,有机废水、农林废弃物等有机废弃物中往往同时含有碳水化合物、有机酸、蛋白质、脂类等多种性质差异较大的物质,深入研究电极微生物对上述有机废弃物中所含有的有机物的梯级利用情况,才能进行有效的底物预处理和运行调控以改善产氢性能。MEC虽然能直接利用可发酵底物(如碳水化合物)产氢,但往往给微生物菌群带来较大的代谢压力,导致发酵细菌大量增长,造成底物(电子供体)损失。由于有机废弃物中含有的各种可利用的底物性质、成分、浓度存在差异,故产氢性能显著不同。Lalaurette等[14]以纤维素为原料,采用MEC利用热纤维梭菌分步厌氧发酵玉米秸秆产氢,产氢效率得到明显改善;Lu等[15]以糖蜜废水为底物发酵产氢,在0.6 V外加电压下,利用缓冲糖蜜发酵液获得的最大产氢速率为1.41 m3·m-3·d-1,氢气回收率提高至81%。然而Mahmoud等[16]以垃圾渗滤液为底物进行发酵,利用双室MEC处理发酵废水,电流密度仅为23 A·m-3,并未产生氢气,MEC仅仅作为污水处理装置并没有能量输出。目前报道MEC利用各种不同的有机废弃物中的底物产氢中主要存在的问题是产氢速率较低,产氢时系统运行不稳定并伴随有甲烷生成而造成氢气产量下降等。不同底物下的MEC产氢性能如表 1所示。
分解有机废弃物的微生物来源十分广泛,已有的大多数研究都以生活污水、厌氧污泥和水体沉积物作为接种物,使得微生物群落具有较高多样性。已分离得到菌群包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria)等门类。与传统微生物相比,人们对电极微生物的认识还处于初级阶段,对其食物网结构、代谢机制、协同作用、电子传递和转移过程不甚明了。同时由于对产氢微生物的基因序列和染色体构成的认识不足,已有的提高产氢效率的措施均为采用混合菌群[22, 23]。
混合菌群培养可以在一定程度上增加氢气量,Liu等[24]在研究热纤梭菌JN4和热解糖高温厌氧杆菌GD17在MEC中的产氢特性时,发现当采用热纤梭菌JN4细菌时,JN4细菌可以降解微晶纤维素产氢。其氢气产量约为0.8 mol H2·mol-1 glucose。然而2种厌氧细菌联合培养时,氢气的产量约为1.8 mol H2·mol-1 glucose。Call等[25]采用Geobacter sulfurreducens、Geo-bacter metallireducens和混合consortium细菌,实验表明,在外加电场强度为0.7 V时,G.sulfurreducens和混合细菌都能产生相同的电流密度160 A·m-3,氢气的产率为1.9 m3 H2·m-3·d-1,然而采用G.metallireducens细菌时电流密度和氢气产率分别为(110±7) A·m-3和(1.3±0.1) m3 H2·m-3·d-1。有机废弃物中微生物菌群可影响MEC系统中离子浓度,促进电子的转移,进而提高产氢效率。Wang等[26]首次从双室MEC阳极悬浮液中分离出一种以葡萄糖、酵母提取物和乳酸钠作为碳源的W7细菌,可降解Fe3+形成Fe2+,增加电子的转移,提高产氢效率。王为等[21]以牛奶废水为底物,以PCR-DGGE的分子生物学分析得知阳极生物膜中以Geobacter sp作为优势菌,上述结果表明在利用有废弃物中的大分子有机物时,菌群之间的协同作用更为明显。利用厌氧污泥作为MEC菌源,以消化污泥为底物,产氢量可达消化污泥生物发酵的1.7~5.2倍,并伴随有甲烷产生。此外,实际有机废水、农林废弃物等有机废弃物中除含有常见分析手段能检测到的物质外,还含有大量未知成分,菌群对上述物质应答方式及相互作用使得产氢性能不稳定。目前研究者对这部分物质对微生物群落的影响知之甚少。阐明这些种群的功能,将为进一步揭示种群胞外电子与质子传递的协同与竞争机制打下基础。
2.4 外加电压对MEC产氢性能的影响在外加电压下,MEC得以运行,不同的外加电压使电场强度的不同,从而使电子受到电场力不同,同时酶的迁移和活性也受到一定的影响,进而影响反应进行的时间和产氢效率[27]。Guo等[28]采用乙酸钠为底物,当电解池外加电压为0.2~1.0 V时,氢气的产率从0.03 L·L-1·d-1增加到1.58 L·L-1·d-1,氢气的回收率从26.03%增加到87.73%,在外加电压为0.6 V时,最大的能量回收率达到86.78%。以牛奶废水为底物,改变外加电压,当外加电压升高到1.2 V时,最大电流密度可达到261 A·m-3,产氢速率可达0.048 m3·m-3·d-1,分别比外加电压为0.4 V的情形提高了467%和700%[21]。李小虎[29]以秸秆氢发酵废水为原料构建MEC系统,并考察系统产氢效率在0.5~0.8 V的外加条件下的变化趋势,实验研究发现MEC在利用发酵废水产氢过程中,仅有H2和CO2产生,且CO2产量不随电压改变,在0.5 V电压下,产氢198.5±8.6 mL,增大到0.7 V电压下,产氢量234.2±11.2 mL,继续增大电压至0.8 V,产氢量不再增大。由此可见,电流密度及产氢速率并不是随外加电压的增大而持续增大,当废水中的阳极微生物降解底物生成H+的速率,与外加电源提供的电子与H+结合的速率相适应时,电流密度及产氢速率将达到最大值。根据有机废弃物种类的不同,适当调整外加电压强度、降低系统内阻可使以MEC利用有机废弃物产氢时电流密度变大,进而加快反应速率,同时系统运行更加稳定,并显著提高氢气产量。
此外,温度和pH值对MEC利用废弃物产氢性能也具有重要影响。在高温条件下,从热力学和动力学的角度,MEC运行中的生化反应速度会显著上升,但是产氢微生物的生长和产氢活性常常受到抑制而使MEC产氢性能无法得到显著提高。研究人员对单室MEC在4℃和9℃的温度条件下实现了成功启动并运行,由于低温抑制了产甲烷菌活性,产甲烷过程得到抑制,而产氢速率不会受到较大影响,从而提高了MEC的产氢性能[30]。在MEC系统中,产氢微生物生长和代谢方式对pH值变化较为敏感,中性环境适宜产氢微生物的生长繁殖,低的pH值可有效抑制产甲烷菌的活性,但是也对产氢微生物造成不可逆转的损害。笔者所在的课题组在探究木质纤维素酶解糖化产氢的过程中发现,低的初始pH值使酶的活性充分体现,所以表现为中间产物的浓度较高[31]。而较高的初始pH值,利于细菌的生长,所以有机酸的消耗量较大。合适的初始pH值有利于MEC系统中微生物的正常生长和代谢活动,因此产氢性能好,当pH值为6.5时,氢气产率为67.5 mL·g-1 substrate[32]。适宜的pH值可使得产氢微生物和催化生化反应的酶处于最佳环境,可以有效提高生化反应速率,进而提高产氢效率。
3 结语与展望氢气作为新能源中的重要组成部分,基于MEC利用有机废弃物产氢技术将成为未来生物产能技术中研究领域的热点。以MEC技术利用各种富含有机质、无机难降解物质的废弃物作为反应底物为今后充分利用有机废弃物等生物质资源进行产能提供了广阔的前景。虽然国内外研究者对MEC产氢性能改善方面进行了有效的尝试,但是,就目前研究现状而言,MEC作为新兴制氢技术,其中涉及有关预处理方式、底物类型、微生物菌群、外加电压等对产氢效率的影响研究理论还很不完善,笔者认为还需从以下各方面来不断完善MEC的研究:
(1)探索对有机废气物采取各种预处理方式相结合的方式对系统预处理,以提高产氢性能。
(2)构建出MEC中微生物菌群的能量代谢过程和微生物食物网组成,建立电子传递效率机制的清晰理论(方程)和动力学模型(方程)。
(3)深入研究MEC中微生物菌群的基因组成和染色体序列,揭示菌群之间的协同作用机制。
(4)扩展可利用产氢废弃物范围,以含有难降解、环境危害巨大的有机废弃污染源作为底物来源,实现既能高效产氢又能回收有机废弃物的生物联产效应。
(5)优化反应的外加条件,突破极端条件限制,提高催化生化反应酶的活性,提高产氢效率。
| [1] | 毛宗强. 氢能---21世纪的绿色能源[M]. 北京: 化学工业出版社, 2005. MAO Zong-qiang. Hydrogen--21st century green energy[M]. Beijing: Chemical Industry Press, 2005. (in Chinese) |
| [2] | 滕继濮.微生物电解池:污水变氢气[N].科技日报, 2011-03-18(006) TENG Ji-pu. Microbial electrolysis cell: Water becomes hydrogen[N]. Science and Technology Daily, 2011-03-18(006). (in Chinese) |
| [3] | 吴畏. 利用废弃物衍生燃料的热化学处理法制富含氢气合成气[J].环境工程学报, 2013(4): 1515-1521. WU Wei. Hydrogen-rich synthesis gas production via thermochemical of refuse derived fuel[J]. Journal of Environmental Engineering, 2013(4): 1515-1521. (in Chinese) |
| [4] | Logan B E, Call D, Cheng S, et al. Microbial electrolysis cells for high yield hydrogen gas production from organic matter[J]. Environmental Science & Technology, 2008, 42(23): 8630-8640. |
| [5] | Liu H, Grot S, Logan B E. Electrochemically assisted microbial production of hydrogen from acetate[J]. Environ Sci Technol, 2005, 39(11): 4317-4320. |
| [6] | Ye Yejie, Wang Liyong, Chen Yingwen, et al. High yield hydrogen production in a single-chamber membrane-less microbial electrolysis cell[J]. Water Science and Technology, 2010, 61(3): 721-727. |
| [7] | 贾蓉, 曲东, 乔莎莎.发酵脱氢产氢过程对微生物铁还原的影响[J].农业环境科学学报, 2013(12): 2395-2402. JIA Rong, QU Dong, QIAO Sha-sha. Microbial iron reduction as influenced by fermentative dehydrogenation and hydrogen production[J]. Journal of Agricultural Environmental Science, 2013(12): 2395-2402. (in Chinese) |
| [8] | Liu H, Grot S, Logan B E. Electrochemically assisted microbial production of hydrogen from acetate[J]. Environ Sci Technol, 2005, 39(11): 4317-4320. |
| [9] | 刘常青, 赵由才, 张江山, 等. 酸性预处理污泥厌氧发酵产氢[J]. 环境 科学学报, 2008, 28(10): 2006-2011. LIU Chang-qing, ZHAO You-cai, ZHANG Jiang-shan, et al. Acidic hydrogen production by anaerobic fermentation of pretreated sludge[J]. Journal of Environmental Sciences, 2008, 28(10): 2006-2011. (in Chinese) |
| [10] | 康灵玲.化学预处理对污泥厌氧发酵及微生物电解耦合工艺的影 响[D].哈尔滨:哈尔滨工业大学, 2013. KANG Ling-ling. Effects of chemical pretreatment on anaerobic fermentation and microbial electrolysis coupling process[D]. Harbin: Harbin Institute of Technology, 2013. (in Chinese) |
| [11] | Cheng S, Logan B E. Sustainable and efficient biohydrogen production via electrohydrogenesis[J]. Proceedings of the National Academy of Sciences, 2007, 104(47): 18871-18873. |
| [12] | 王淑静, 李建政, 昌盛, 等. 不同预处理温度对厌氧颗粒污泥发酵产氢的影响[J].化工学报, 2011, 62(3): 811-815. WANG Shu-jing, LI Jian-zheng, CHANG Sheng, et al. Prosperity different pretreatment temperature of anaerobic granular sludge fermentation hydrogen production[J]. Chemical Technology, 2011, 62(3): 811-815. (in Chinese) |
| [13] | 刘文宗. 有机废水微生物电解产氢研究及电极微生物功能解析[D].哈尔滨:哈尔滨工业大学, 2011. LIU Wen-zong. Research on organic wastewater microbial electrolysis hydrogen production and electrode microbial function analysis[D]. Harbin: Harbin Institute of Technology, 2011. (in Chinese) |
| [14] | Lalaurette E, Thammannagowda S, Mohagheghi A, et al. Hydrogen production from cellulose in a two-stage process combining fermentation and electrohydrogenesis[J]. International Journal of Hydrogen Energy, 2009, 34(15): 6201-6210. |
| [15] | Lu Lu, Ren Nanqi, Xing Defeng, et al. Hydrogen production with effluent from an ethanol-H2 coproducing fermentation reactor using a single-chamber microbial electrolysis cell[J]. Biosensors and Bioelectronics, 2009, 24: 3055-3060. |
| [16] | Mahmoud M, Parameswara P, Torres C, et al. Fermentation pretreatment of landfill leachate for enhanced electron recovery in a microbial electrolysis cell[J]. Bioresource Technology, 2014, 151: 151-158. |
| [17] | Abhijeet P Borole, Jonathan R Mielenz. Estimating hydrogen production potential in biorefineries using microbial electrolysis cell technology[J].International Journal of HydrogenEnergy, 2011, 36:14787-14795. |
| [18] | Roland D Cusick, Ill Bryan, Enny S Parker. Performance of a pilot scale continuous flow microbial electrolysis cell fed winery wastewater[J]. Appl Microbiol Biotechnol, 2011, 89: 2053-2063. |
| [19] | Anders Thygesen, Assimo Marzorati, IcoBoon, et al. Upgrading of straw hydrolysate for production of hydrogen and phenols in a microbial electrolysis cell(MEC)[J]. Appl Microbiol Biotechnol, 2011, 89: 855-865. |
| [20] | Jenna Ditzig, Hong Liu, Bruce E Logan, et al. Production of hydrogen from domestic wastewater using a bioelectrochemically assisted microbial reactor(BEAMR)[J]. International Journal of Hydrogen Energy, 2007, 32(13): 2296-2304. |
| [21] | 王为, 骆海萍, 刘广立, 等. 利用微生物电解池处理牛奶废水过程中产电菌落与产氢性能之间的关系[J]. 微生物学通报, 2013, 40 (11): 2075-2082. WANG Wei, LUO Hai-ping, LIU Guang-li, et al. Exoelectrogens community analysis and hydrogen production in the microbial electrolysis cell using dairy wastewater[J]. Microbiology, 2013, 40(11): 2075-2082. (in Chinese) |
| [22] | 王瑞兴, 钱春香, 袁晓明. 发酵制氢微生物与高效发酵途径的研究进展[J].环境科学与技术, 2013(12): 90-99. WANG Rui-xing, QIAN Chun-xiang, YUAN Xiao-ming. Research advance on fermentative microorganism and efficient approaches of hydrogen production[J]. Environmental Science & Technology, 2013(12): 90-99. (in Chinese) |
| [23] | 林明, 任南琪, 王爱杰, 等.混合菌种在发酵法生物产氢中的协同作用[J].环境科学, 2003(2): 54-59. LIN Ming, REN Nan-qi, WANG Ai-jie, et al. Cooperation of mixed culturing bacteria in the hydrogen production by fermentation[J]. Environmental Science, 2003(2): 54-59. (in Chinese) |
| [24] | Liu Y, Yu P, Song X, et al. Hydrogen production from cellulose by coculture of Clostridium thermocellum JN4 and Thermoanaerobacterium thermosaccharolyticum GD17[J]. International Journal of Hydrogen Energy, 2008, 33(12): 2927-2933. |
| [25] | Call D F, Wagner R C, Logan B E. Hydrogen production by Geobacter species and a mixed consortium in a microbial electrolysis cell[J]. Applied and Environmental Microbiology, 2009, 75(24): 7579-7587. |
| [26] | Wang A, Liu L, Sun D, et al. Isolation of Fe(Ⅲ)-reducing fermentative bacterium Bacteroides sp. W7 in the anode suspension of a microbial electrolysis cell(MEC)[J]. International Journal of Hydrogen Energy, 2010, 35(7): 3178-3182. |
| [27] | 张军合, 张全国, 尤希凤, 等.环流型光生物反应器光合产氢运行条件的研究[J]. 农业环境科学学报, 2005(6): 1217-1220. ZHANG Jun-he, ZHANG Quan-guo, YOU Xi-feng, et al. Operation parameters of photosynthetic hydrogen production by loop photo-bioreactor[J].Journal of Agricultural Environmental Science, 2005(6): 1217-1220. (in Chinese) |
| [28] | Guo K, Tang X, Du Z, et al. Hydrogen production from acetate in a cathode-on-top single-chamber microbial electrolysis cell with a mipor cathode[J]. Biochemical Engineering Journal, 2010, 51(1): 48-52. |
| [29] | 李小虎. 秸秆类生物质结合暗发酵-MEC两阶段过程高效产氢的研究[D]. 郑州: 郑州大学, 2014. LI Xiao-hu. The research on high efficient hydrogen production from corn stalk biomass by integrating dark fermentation and microbial electrolysis cell[D]. Zhengzhou: Zhengzhou University, 2014. (in Chinese) |
| [30] | 许林季. 微生物电解低温处理污泥发酵液产氢效能强化分析[D]. 哈尔滨:哈尔滨工业大学, 2013. XU Lin-ji. Enhancing microbial electrolysis cell generating hydrogen from sludge fermentation liquid in low temperature[D]. Harbin: Harbin Institute of Technology, 2013. (in Chinese) |
| [31] | 刘頔, 李茹莹, 季民, 等.起始pH对秸秆与污泥混合发酵产氢 产甲烷的影响[J].农业环境科学学报, 2013(6): 1271-1276. LIU Di, LI Ru-ying, JI Min, et al. Effect of pHco-production of hydrogen and methane from sewage sludge and cornstalk in the two-stage fermentation process[J]. Journal of Agro-environment Science, 2013(6): 1271-1276. (in Chinese) |
| [32] | 胥腾飞.基于木质纤维同步酶解的微生物电解池产氢过程中传输 与反应特性[D]. 重庆: 重庆大学, 2014. XU Teng-fei. Characteristics of mass transfer and biochemical reaction during hydrogen production in microbial electrolysis cell through lignocellulose saccharification[D]. Chongqing: Chongqing University, 2014. (in Chinese) |
 2015, Vol. 32
2015, Vol. 32