文章信息
- 潘 瑶, 尹 洁, 高子平, 王景安, 刘仲齐
- PAN Yao, YIN Jie, GAO Zi-ping, WANG Jing-an, LIU Zhong-qi
- 硫对水稻幼苗镉积累特性及亚细胞分布特征的影响
- Effects of Sulfur on the Accumulation and Subcellular Distribution of Cadmium in Rice Seedlings
- 农业资源与环境学报, 2015, 32(3): 275-281
- Journal of Agro-Environment Science, 2015, 32(3): 275-281
- http://dx.doi.org/10.13254/j.jare.2015.0026
-
文章历史
- 收稿日期:2015-01-27
2.农业部环境保护科研监测所生态毒理与环境修复研究中心, 天津 300191
2.Centre for Research in Ecotoxicology and Environmental Remediation, Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China
随着工农业的迅速发展,重金属污染日益严重。重金属首先污染土壤、水源,然后经过生物富集作用积累在水稻营养体和稻米中,再通过食物链进入人体,干扰人体正常生理功能。其中以铅、镉(Cd)、砷、汞和铬毒性最大,被称为“五毒”。水稻是容易吸收累积土壤中Cd的大田作物之一[1, 2],当土壤含Cd量为2.211 mg·kg-1时,糙米中Cd即达2.640 mg·kg-1,大大超过了国家食品卫生限量标准0.2 mg·kg-1 (GB 2762—2012)[3]。因此,控制水稻Cd吸收量,对于保障我国稻米及其加工产品的质量安全具有重要现实意义。
植物对重金属的耐受性与植物对重金属的吸收运输、重金属在植物细胞各部位的分布及与体内物质的结合形态密切相关[4]。Cd的迁移性很强且易被植物吸收和积累[5, 6, 7],水稻从土壤中吸收Cd,大部分富集在根部,迁移至地上部的一般较少[8],这可能与Cd进入根的皮层细胞后和根内蛋白质、多糖类、核糖类、核酸等形成稳定的大分子络合物或不溶性有机大分子而沉积下来有关[9]。
植物耐受重金属方式主要有根部滞留、细胞壁固定化、液泡区室化以及植物螯合态(PCs)等[10, 11, 12]。植物体内的谷胱甘肽(GSH)、非蛋白巯基(NPT)也可能是植物缓解重金属Cd胁迫的主要成分之一,在植物对重金属的耐性中起着重要的作用[13],这些植物组分的特点之一是都含硫(S)。硫是植物必需的营养元素,被认为是继氮、磷和钾之后的第四位对植物正常生长和发育有重要作用的营养元素,并且均能够抑制Cd对植物体的毒害[14, 15, 16]。另有报道显示施S显著增加水稻根表胶膜铁锰含量,其效应与S形态及含量有关,而且施S能显著减少水稻重金属Cd吸收[17]。
本研究通过分析硫元素对水稻Cd吸收累积的影响及其基因型间的差异性,旨在探索硫元素影响水稻Cd吸收转运的作用过程及其剂量效应关系,为制定污染农田稻米安全生产技术提供依据。
1 材料与方法 1.1 实验材料与培养条件本实验以高积累水稻品种T优705和低积累品种湘早籼24作为材料[18],选取饱满均一的水稻种子,在5%的NaClO溶液中浸泡15 min,用去离子水洗净后浸种24 h,然后在恒温箱中(30±1) ℃暗光催芽48 h,播种于填满蛭石和石英砂的浅盘中,待幼苗长出第1片真叶后,选大小均一的水稻幼苗移到装有8 L营养液的塑料盆(34 cm×25 cm×12 cm)中进行预培养。用1/4营养液、1/2营养液和全营养液各培养1周。营养液的pH值用0.1 mol·L-1 HCl和0.1 mol·L-1 NaOH调节至5.5。培养期间,持续向营养液中泵气,每次换营养液时交换塑料盆的位置,以保证光照均匀。水培试验的整个过程都在人工气候室中进行,昼夜时间为16 h/8 h,昼夜温度为25 ℃/20 ℃,白天光照为105 μmol·m-2·s-1,相对湿度为60%[19]。待长出四叶一心后,挑选形态相似、长度相当的水稻幼苗进行不同浓度处理(每组处理50株)。在去离子水中加入不同浓度的硫和镉溶液,Cd(CdCl2)水平分别为0(Cd0)、0.1(Cd1)、0.3(Cd2)、0.5 mg·L-1(Cd3);S(Na2S)水平分别为0(S0)、0.3(S1)、2.8 mg·L-1(S2)。处理时间为7 d,持续向水培液中泵气。所供Hoagland营养液的组成为(1 L):
A液:Ca(NO3)2 94.5 g
B液:KNO3 60.7 g、NH4·H2PO4 11.5 g、MgSO4·7H2O 49.3 g
C液:H3BO3 2.86 g、MnCl2·4H2O 1.81 g、ZnSO4·7H2O 0.22 g、CuSO4·5H2O 0.08 g、(NH4)2·4H2O·Mo7O24 0.02 g
D液:FeSO4·7H2O 5.57 g、Na2-EDTA 7.45 g
1.2 重金属镉的测定处理结束时,将根系浸泡于20 mmol·L-1的Na2-EDTA溶液中15 min,以除掉根系表面残留的Cd2+,再用去离子水洗净,最后用无灰滤纸吸干。将根系和地上部分装入信封中,置于烘箱中105 ℃杀青15 min,再于75 ℃下烘至恒重。称量地上部分和根干重,粉碎后分别称取水稻幼苗根系0.100 0 g和水稻幼苗地上部分0.200 0 g于消煮管中,加入7 mL HNO3浸泡过夜,用消解仪ED54于110 ℃下加热1.5 h,待其冷却后加入1 mL H2O2,继续加热2.5 h,赶酸至体积为1 mL左右,定容至25 mL,用原子吸收仪(AAS ZEEnit700)测定样品Cd含量。
1.3 镉的转运效率转运效率(%)=100×(地上部分Cd含量×地上部生物量)/(根系Cd含量×根系生物量+地上部分Cd含量×地上部分生物量)
1.4 镉的亚细胞分离称取新鲜的水稻根系和地上部分各0.200 0 g分别置于研钵中,加入预冷的提取缓冲液充分研磨成匀浆液。提取缓冲液组成为:250 mmol·L-1蔗糖,50 mmol·L-1 Tris-HCl(pH值7.5)和1 mmol·L-1的二硫赤鲜醇。实验操作过程均在4 ℃下进行,具体操作参照文献[20, 21]。将匀浆液在3 000 r·min-1下离心15 min,沉淀即为细胞壁组分。上清液在15 000 r·min-1下离心30 min,沉底为细胞器组分,上清液为胞液组分(包括细胞质及液泡)。并测定Cd全量计算回收率[22],回收率为92%~101%,之后将各组分用HNO3-H2O2法消化后,用原子吸收仪(AAS ZEEnit700)测定样品Cd含量。
1.5 数据分析数据用Origin 8.6作图,并用SPSS进行方差分析。
2 结果分析 2.1 硫对水稻幼苗体内Cd含量的影响不同硫镉水平处理对高积累品种和低积累品种的根系和地上部分Cd含量影响显著,高积累品种根系和地上部分中的Cd含量大约是低积累品种的2倍,幼苗根系各部位的Cd含量大约是地上部分的10倍(图 1),这表明根系是水稻积累Cd的主要部位。
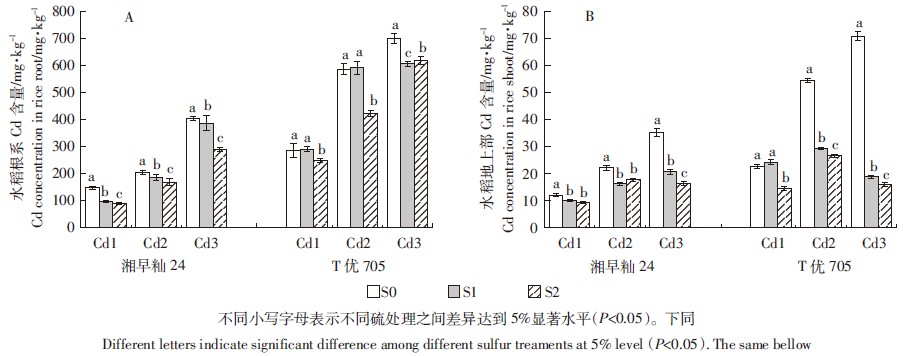
|
| 图 1 硫对水稻幼苗根(A)和茎(B)Cd积累量的影响 Figure 1 Effects of S on the Cd concentration in root (A) and shoot (B) of rice seedling |
随着Cd处理浓度从0.1 mg·L-1增大到0.5 mg·L-1,水稻根系中的Cd含量明显增加。施硫浓度为2.8 mg·L-1时,根系中的Cd含量显著降低(P < 0.05)。施硫浓度为0.3 mg·L-1时,低积累品种湘早籼24根系中的Cd含量显著降低(P < 0.05);而高积累品种T优705根系中的Cd含量与Cd1和Cd2的对照并没有显著差异,只是显著低于Cd3的对照,这表明低Cd处理中,施硫对高积累品种T优705根系中的Cd积累量影响较小。随着Cd处理浓度的增加,水稻地上部分Cd含量显著增加。增施0.3~2.8 mg·L-1的S能显著降低湘早籼24地上部分的Cd含量(P < 0.05)。当Cd处理浓度为0.1 mg·L-1时,增施0.3 mg·L-1的S并没有显著降低T优705地上部分的Cd含量,当增施的S浓度提高到2.8 mg·L-1时,其地上部分的Cd含量显著下降;当Cd处理浓度为0.3~0.5 mg·L-1时,增施0.3~2.8 mg·L-1的S能显著降低T优705地上部分的Cd含量。综上所述,增施2.8 mg·L-1的S,对于2个水稻品种湘早籼24和T优705的根系和地上部分Cd含量影响显著。
2.2 硫对Cd在水稻体内亚细胞分布的影响不同硫镉水平处理对Cd在高积累和低积累品种体内的亚细胞分布有显著影响。水稻根系不同组分(F1细胞壁、F2细胞器、F3胞液)的Cd含量大于地上部分,高积累品种T优705各组分的Cd含量大于低积累品种湘早籼24(图 2),与水稻幼苗体内Cd积累总量变化规律一致。
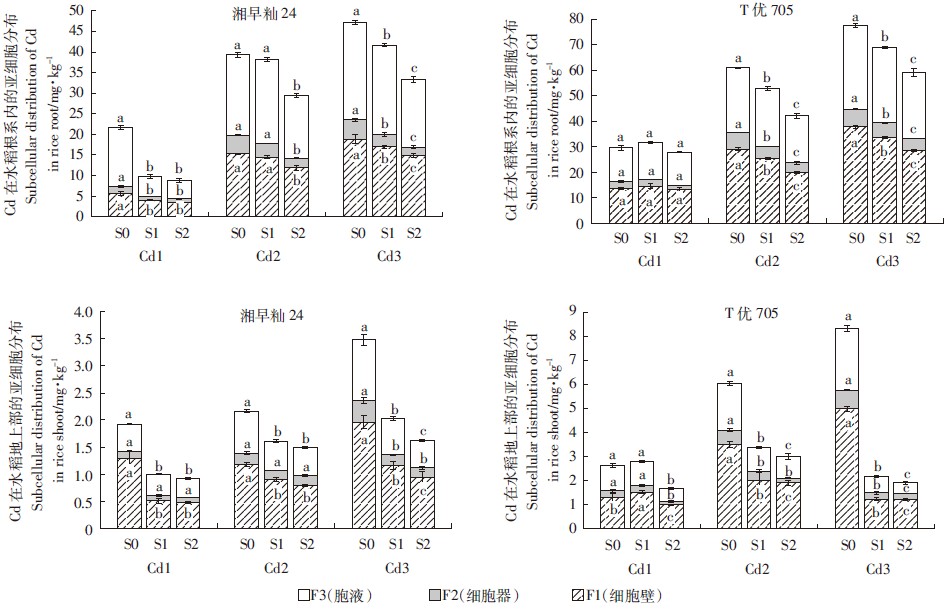
|
| 图 2 Cd在水稻幼苗体内的亚细胞分布 Figure 2 Subcellular distribution of Cd in rice seedlings |
Cd在2个水稻品种根系中亚细胞分布表现为F3 > F1 > F2。随着Cd处理浓度从0.1 mg·L-1增大到0.5 mg·L-1,水稻幼苗根系中各组分的Cd含量均增加,其中细胞壁Cd含量的增加最为显著,这表明水稻幼苗应对Cd胁迫的第一道屏障是细胞壁。施硫可降低水稻根系胞液及细胞壁组分中的Cd含量,相较细胞器,胞液中Cd含量的变化更为显著。但低Cd处理中,施硫浓度为0.3 mg·L-1时,高积累品种T优705根系各组分Cd含量并未显著下降,这与根系内Cd积累总量变化规律一致。Cd在2个水稻品种地上部分中亚细胞分布表现为F1 > F3 > F2。随着Cd处理浓度从0.1 mg·L-1增大到0.5 mg·L-1,水稻幼苗地上部分各组分的Cd含量均增加,其中细胞壁Cd含量的增加最为显著,施硫可有效地降低水稻幼苗地上部分中各组分的Cd含量。
施硫显著改变了Cd在水稻幼苗体内的亚细胞分配比例(图 3)。低硫环境中,Cd在低积累品种湘早籼24根系内的分配比例为F3 > F1 > F2,其中细胞液组分(F3)中的分配比例高达53.8%,而细胞器组分(F2)中的分配比例只有6.5%~13.5%。而Cd在高积累品种水稻T优705根系内的分配比例为F1 > F3 > F2,其中含细胞壁组分(F1)中的最高分配比例为50.4%,细胞器的组分(F2)中的最低分配比例为5.5%。随着施硫浓度的增加,2个品种根系胞液中的Cd分配比例显著增加。这表明施硫是通过提高水稻幼苗根系胞液中的Cd分配比例,来保证细胞器生理功能的正常发挥。在3个Cd处理水平下,Cd在2个品种地上部分中的分配比例均为F1 > F3 > F2,Cd在低积累品种湘早籼24地上部分细胞壁中的分配比例最高可达56.25%,在高积累品种水稻T优705地上部分细胞壁中的分配比例最高可达59.83%,这表明水稻幼苗地上部分应对Cd胁迫的主要部位是细胞壁。施硫可增加水稻幼苗地上部分细胞壁组分F1中Cd的分配比例,降低细胞液组分F3中Cd的分配比例,从而保证了细胞生理功能的正常发挥。
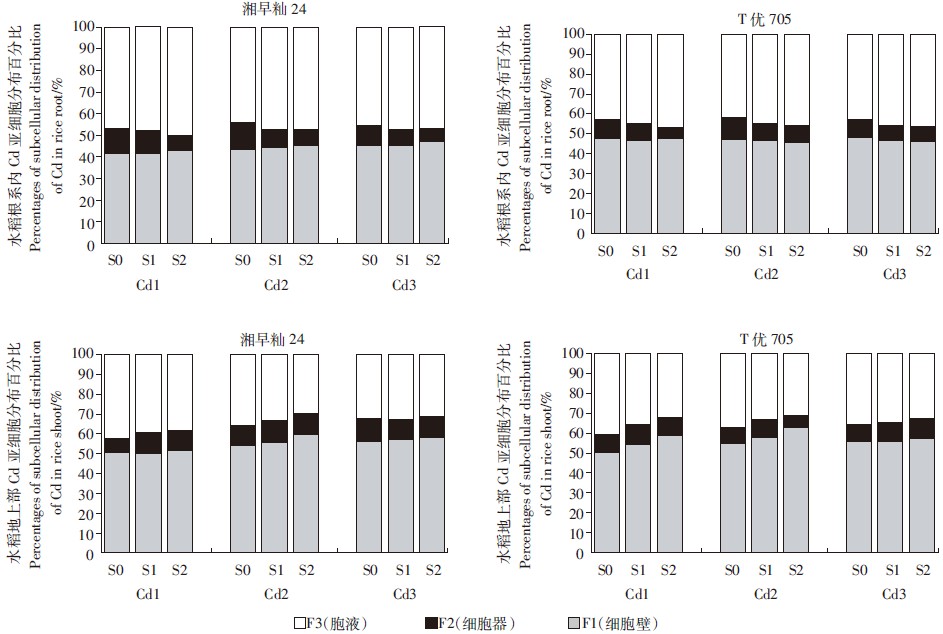
|
| 图 3 水稻幼苗体内Cd亚细胞分布百分比 Figure 3 Percentages of subcellular distribution of Cd in rice seedlings |
以上结果表明,细胞壁和细胞可溶性部分是Cd在水稻细胞内的主要储存部位,只有少量的Cd分布在叶绿体、线粒体和内质网等细胞器组分中。
2.3 硫对水稻体内Cd转运效率的影响Cd在高积累和低积累品种水稻体内的转运效率变化趋势一致,都随着Cd处理浓度的增加而降低(图 4)。这表明根系是水稻幼苗积累Cd的主要场所。施硫可降低水稻体内Cd转运效率,说明硫可以将Cd固定在水稻根系内,减少Cd向地上部分转运。施硫可以显著降低高积累品种水稻T优705和低积累品种水稻湘早籼24体内Cd转运系数(P < 0.05),低Cd水平中,随着施硫水平从0.3 mg·L-1增大到2.8 mg·L-1,水稻幼苗体内的转移系数增加,这可能是施硫可增加水稻幼苗的生物量所致;高Cd水平中,随着施硫水平从0.3 mg·L-1增大到2.8 mg·L-1,水稻幼苗体内的转移系数降低。
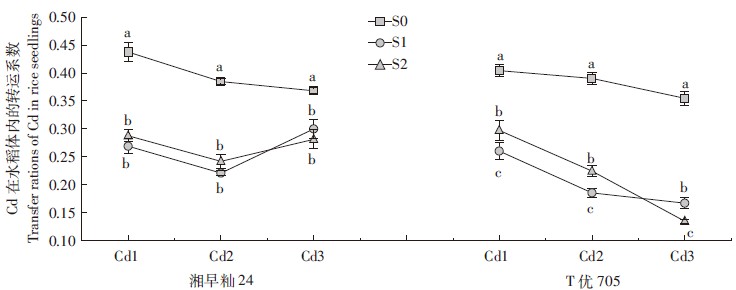
|
| 图 4 水稻幼苗体内Cd的转运系数 Figure 4 Transfer rations of Cd in rice seedlings |
S和Se具有相似的生理生化性质,通过影响PC合成酶和谷胱甘肽进而影响植物螯合肽的合成,缓解植物对重金属的胁迫和积累[23]。根系是水稻积累Cd的主要部位,根系中的Cd含量大约是地上部分的10倍。低水平增施硫处理并不能有效降低Cd在水稻幼苗体内的积累量,当施硫水平达到2.8 mg·L-1时,水稻根系和地上部分的镉含量显著降低,这与以往报道一致[24]。不同植物和同种植物不同的基因型对Cd胁迫的耐性有很大差异[25, 26]。本实验中高积累水稻品种T优705根系的Cd积累量大约是低积累水稻品种湘早籼24的2倍,增施2.8 mg·L-1硫不仅能显著降低Cd在水稻根系中的积累量,而且显著降低Cd向地上部分的转移。而在高浓度Cd处理实验中,随着施硫水平的增加,低积累品种湘早籼24幼苗体内Cd转运效率反而增加,这可能是由于施硫增加了水稻幼苗的生物量。
细胞壁固持和液泡区隔化在提高植物对重金属的耐性和富集能力方面起着主要作用[27]。细胞壁含有多种能与进入植物体的金属离子配位结合的多糖、蛋白质等物质,从而减少金属离子的跨质膜运输,降低原生质体中的金属离子浓度,维持细胞的正常生理代谢,是植物体内重金属解毒的主要部位[28]。本实验表明,Cd在水稻根系中的含量和分配比例为F3 > F1 > F2,而在地上部分中表现为F1 > F3 > F2,这与于辉等[29]的研究结果一致。细胞器是植物细胞生命活动的主要场所,在该部位积累量越低,细胞正常代谢受到的破坏就越少,增施S有助于抑制水稻根系和地上部分组织中的Cd向细胞器中转运,从而保证细胞器功能的正常运转。
硫是植物生长发育的必需元素之一,可以和重金属形成有机化合物,从而减轻重金属的生理毒害作用[30]。水稻、油菜、小麦等作物对S的利用效率存在显著的基因型差异[31, 32, 33]。本研究发现,在不施S的情况下,水稻地上部的Cd含量显著低于根系中的Cd含量,湘早籼24各部位的Cd含量显著低于T优705。水稻幼苗地上部Cd含量比根系更容易受到S的影响,低积累品种湘早籼24比高积累品种T优705对S更敏感。增施0.3 mg·L-1的S以后,地上部Cd下降的幅度显著大于根系,湘早籼24根系和地上部的Cd下降幅度都显著大于T优705,说明S的利用率和在水稻体内的分布可能是决定Cd积累量的关键因素。湘早籼24对Cd积累特性可能与其对S的敏感性以及其高效利用特性有密切的关系。因此,针对不同水稻品种,在幼苗期合理施硫可有效地缓解Cd毒害,硫肥使用方法及用量依据水稻品种确定,例如尝试采用叶面喷施的方法对湘早籼24进行施硫处理,使其既能充分发挥其有效生理作用,又能保证水稻正常生长,确保农产品的食用安全性。
4 结论(1)水稻幼苗地上部Cd含量比根系更容易受到S的影响,增施2.8 mg·L-1硫不仅能显著降低Cd在水稻根系中的积累量,而且显著降低Cd向地上部分的转移。
(2)水稻对S的利用效率存在显著的基因型差异,低积累品种湘早籼24比高积累品种T优705对S更敏感。
(3)Cd在水稻根系中的含量和分配比例为胞液 > 细胞壁 > 细胞器,而在地上部分中表现为细胞壁 > 胞液 > 细胞器,施硫增加水稻地上部细胞壁中的Cd分配比例,降低胞液中的Cd分配比例。
| [1] | M R Gomez, S Cerutti, L L Sombm, et al. Determination of heavy metals for the quality control in Argentinian herbal medicines by ETAAS and ICP-OES[J]. Food Chem & Toxicolo, 2007, 45(6): 1060-1064. |
| [2] | 郑守国, 李 淼, 翁世壮, 等. 稻米中重金属污染现状与检测方法[J]. 农产品质量与安全, 2012(z1): 25.ZHENG Shou-guo, LI Miao, WENG Shi-zhuang, et al. Heavy metal pollution status and detection method of rice[J]. The Quality and Safety of Agricultural Products, 2012(z1): 25.(in Chinese) |
| [3] | 中国预防医学科学院标准处. 食品卫生国家标准汇编[M]. 北京: 中国标准出版社, 1988: 702.Office of China Standard Academy of Preventive Medical Science. The national food hygiene standard compilation[M]. Beijing: Standards Press of China, 1988: 702.(in Chinese) |
| [4] | Yang J-R, Bao Z-P, Zhang S-Q. The distribution and binding of Cd and Pb in plant cell[J]. China Environmental Science, 1993, 13(4): 263-268. |
| [5] | Sanitdi T L, Gabbrielli R. Response to cadmium in higher plants[J]. Environmental and Experimental Botany, 1999, 41: 105-130. |
| [6] | Kelly J M, Parker G R, McFee W W. Heavy metal accumulation and growth of seedlings of five forest species as influenced by soil cadmium level[J]. J Environ Qual, 1979, 8: 361-364. |
| [7] | 蔡婷婷, 王文全, 阿米娜, 等. 重金属Cd在再生水-土壤-蔬菜体系中的迁移[J]. 环境保护科学, 2013, 39(6): 48.CAI Ting-ting, WANG Wen-quan, A Mi-na, et al. The heavy metals of Cd migration in the reclaimed water in the soil vegetable system[J]. Environmental Protection Science, 2013, 39(6): 48.(in Chinese) |
| [8] | 张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报, 2000, 20(3): 515.ZHANG Jin-biao, HUANG Wei-nan. Research progress of physiological and ecological effects of cadmium on plants[J]. Journal of Ecology, 2000, 20(3): 515.(in Chinese) |
| [9] | 王焕校. 污染生态学基础[M]. 昆明: 云南大学出版社, 1990: 71-148.WANG Huan-xiao. Pollution ecology foundation[M]. Kunming: Yunnan University Press, 1990: 71-148.(in Chinese) |
| [10] | 安志装, 王校常, 严蔚东, 等. 植物鳌合肽及其在重金属胁迫下的适应机制[J]. 植物生理学通讯, 2001, 37(5): 463-467.AN Zhi-zhuang, WANG Xiao-chang, YAN Wei-dong, et al. Phytoch-elatins and adaptive mechanism under heavy metal stress[J]. Communication of Physiology of Plant, 2001, 37(5): 463-467.(in Chinese) |
| [11] | 安志装, 王校常, 严蔚东, 等. 镉硫交互处理对水稻吸收累积镉及其蛋白巯基含量的影响[J]. 土壤学报, 2004, 41(5): 729.AN Zhi-zhuang, WANG Xiao-chang, YAN Wei-dong, et al. Cadmium sulfide interactive processing effects on rice cadmium accumulation and protein sulfhydryl content[J]. Acta Pedologica Sinica, 2004, 41(5): 729.(in Chinese) |
| [12] | 张 雯. 硫硒交互对水稻幼苗镉累积和毒害的影响机制研究[D]. 上海: 华东理工大学, 2014: 12-26.ZHANG Wen. Sulfur selenium interaction on Cd accumulation and toxicity in rice seedlings effect mechanism research[D]. Shanghai: East China University of Science and Technology, 2014: 12-26.(in Chinese) |
| [13] | 原海燕, 郭 智, 佟海英, 等. Pb胁迫下外源GSH对马蔺体内Pb积累和非蛋白巯基化合物含量的影响[J]. 水土保持学报, 2013, 27(4): 213-215.YUAN Hai-yan, GUO Zhi, TONG Hai-ying, et al. Under the effect of exogenous GSH on Iris lactea in vivo Pb accumulation and non protein sulfhydryl compounds content in Pb stress[J]. Journal of Soil and Water Conservation, 2013, 27(4): 213-215.(in Chinese) |
| [14] | 孙 新, 杨志敏, 徐朗莱. 缺硫条件下油菜对镉毒害的敏感性[J]. 南京农业大学学报, 2003, 26(4): 56-59.SUN Xin, YANG Zhi-min, XU Lang-lai. Sensitivity under sulfur deficiency of oilseed rape to cadmium[J]. Journal of Nanjing Agricultural University, 2003, 26(4): 56-59.(in Chinese) |
| [15] | 孙 新, 杨志敏, 徐朗莱. 镉诱导油菜叶片氧化胁迫及硫化物的络合作用[J]. 西北植物学报, 2003, 23(9): 1506-1511.SUN Xin, YANG Zhi-min, XU Lang-lai. Complexation of cadmium sulfide stress induction and rape leaf oxidation[J]. Acta Botanica Boreali-Occidentalia Sinica, 2003, 23(9): 1506-1511.(in Chinese) |
| [16] | Reese R N, White C A, Wing D R. Long-distance transport of reduced sulfur in spruce (Price abies)[J]. Journal of Experimental Botany, 1992, 43: 1243-1250. |
| [17] | 胡正义, 夏 旭, 吴 丛, 等. 硫在稻根微域中化学行为及其对水稻吸收重金属的影响机理[J]. 土壤, 2009, 41(1): 27-31.HU Zheng-yi, XIA Xu, WU Cong, et al. Chemical behavior of sulfur in the rhizosphere of rice and its impacts on heavy metals uptake in rice[J]. Soil, 2009, 41(1): 27-31.(in Chinese) |
| [18] | 居学海, 张长波, 宋正国, 等. 水稻籽粒发育过程中各器官镉积累量的变化及其与基因型和土壤镉水平的关系[J]. 植物生理学报, 2014, 50(5): 634-640.JU Xue-hai, ZHANG Chang-bo, SONG Zheng-guo, et al. Changes in various organs of the rice grain Cd accumulation process development and its relationship with genotype and soil Cd levels[J]. Journal of Plant Physiology, 2014, 50(5): 634-640.(in Chinese) |
| [19] | 陆仲烟, 刘仲齐, 宋正国, 等. 大麦中镉的亚细胞分布和化学形态及PCs合成的基因型差异[J]. 农业环境科学学报, 2013, 32(11): 2125-2131.LU Zhong-yan, LIU Zhong-qi, SONG Zheng-guo, et al. Subcellular distribution and chemical form and PCs synthesis of genotypic difference in cadmium in barley[J]. Journal of Agro-Environment Science, 2013, 32(11): 2125-2131.(in Chinese) |
| [20] | Wang Xin, Liu Yun-guo, Zeng Guang-ming, et al. Subcellular distribution and chemical forms of cadmium in Bechemeria nivea (L.) gaud[J]. Environmental and Experimental Botany, 2008, 62(1): 389-393. |
| [21] | Weigel H J, Jager H J. Subcellual distribution and chemical form of cadmium in bean plants[J]. Plang Physiol, 1980, 65(1): 480-482. |
| [22] | 张 雯, 林匡飞, 周 健, 等. 不同硫浓度下叶面施硒对水稻幼苗镉的亚细胞分布及化学形态的影响[J]. 农业环境科学学报, 2014, 33(5): 844-852.ZHANG Wen, LIN Kuang-fei, ZHOU Jian, et al. Effects of different sulfur concentration of foliage spraying selenium on subcellular distribution and chemical forms of cadmium in rice seedlings[J]. Journal of Agro-Environment Science, 2014, 33(5): 844-852.(in Chinese) |
| [23] | 袁思莉, 余 垚, 万亚男, 等. 硒缓解植物重金属胁迫和累积的机制[J]. 农业资源与环境学报, 2014(6): 545-550.YUAN Si-li, YU Yao, WAN Ya-nan, et al. Selenium relief mechanism of plant to heavy metal stress and accumulation[J]. Journal of Agricultural Resources and Environment, 2014(6): 545-550.(in Chinese) |
| [24] | 于立旭. 硫化氢对盐和镉胁迫下黄瓜种子萌发及氧化损伤的缓解效应[D]. 泰安: 山东农业大学, 2012: 6.YU Li-xu. Effects of hydrogen sulfide on cucumber germination andperoxidation damage induced by salinity and cadmium stress[D]. Taian: Shandong Agricultural University, 2012: 6.(in Chinese) |
| [25] | Dunbar K R, Mclaughlin M J, Reld R J. The uptake and portioning of cadmium in two cultivars of potato (Solanum tuberosum L.)[J]. J Exp Bot, 2003, 54(381): 349-354. |
| [26] | Stolt J P, Sneller F E C, Bryngelsson T, et al. Phytochelatin and cadmium accumulation in wheat[J]. Environ Exp Bot, 2003, 49: 21-28. |
| [27] | Fu X, Dou Chen Y, et al. Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J]. Journal of Hazard Material,2011, 186(1): 103-170. |
| [28] | 亢希然, 范稚莲, 莫良玉, 等. 超富集植物的研究进展[J]. 安徽农业科学, 2007, 35(16): 4895-4897.KANG Xi-ran, FAN Zhi-lian, MO Liang-yu, et al. Research progress of hyperaccumulation plants[J]. Anhui Agricultural Sciences, 2007, 35(16): 4895-4897.(in Chinese) |
| [29] | 于 辉, 杨中艺, 杨知建, 等. 不同类型镉积累水稻细胞镉化学形态及亚细胞和分子分布[J]. 应用生态学报, 2008, 19(10): 2221-2226.YU Hui, YANG Zhong-yi, YANG Zhi-jian, et al. Rice cell CD chemical forms and subcellular and molecular distribution of different types of cadmium accumulation[J]. Chinese Journal of Applied Ecology, 2008, 19(10): 2221-2226.(in Chinese) |
| [30] | Chao Dai-yin, Patrycja Baraniecka, John Danku, et al. Variation in sulfur and selenium accumulation is controlled by naturally occurring isoforms of the key sulfur assimilation enzyme adenosine 59-phosphosulfate reductase2 across the arabidopsis species range[J]. Plant Physiology, 2014, 166: 1593-1608. |
| [31] | Chardon F, Noël V, Masclaux-Daubresse C. Exploring NUE in crops and in arabidopsis ideotypes to improve yield and seed quality[J]. J Exp Bot, 2014, 63: 3401-3412. |
| [32] | Anna Koprivova, Andrea L Harper, Martin Trick, et al. Dissection of the control of anion homeostasis by associative transcriptomics in brassica napus[J]. Plant Physiology, 2014, 166: 442-450. |
| [33] | 王 芳, 丁 杉, 张春华, 等. 不同镉耐性水稻非蛋白巯基及镉的亚细胞和分子分布[J]. 农业环境科学学报, 2010, 29(4): 625-629.WANG Fang, DING Shan, ZHANG Chun-hua, et al. Non-protein thiols, subcellular and molecular distribution of cadmium in two rice cultivars with difference tolerance[J]. Journal of Agro-Environment Science, 2010, 29(4): 625-629.(in Chinese) |
 2015, Vol. 32
2015, Vol. 32




