文章信息
- 许育新,喻 曼, 陈喜靖, 安文浩, 王云龙, 肖 华, 沈阿林
- XU Yu-xin, YU Man, CHEN Xi-jing, AN Wen-hao, WANG Yun-long, XIAO Hua, SHEN A-lin
- 天然沸石对水中氨氮吸附特性的研究
- Characteristics of Ammonia Nitrogen Adsorption on Natural Zeolite in Water
- 农业资源与环境学报, 2015, 32(3): 250-256
- Journal of Agro-Environment Science, 2015, 32(3): 250-256
- http://dx.doi.org/10.13254/j.jare.2015.0008
-
文章历史
- 收稿日期:2015-01-06
随着城市人口的日益膨胀和工农业的迅速发展,氨氮污染的来源越来越广泛,排放量也越来越大,氨氮的污染日益严重。氨氮排入水体,容易引起水中藻类及其他微生物大置繁殖,形成富营养化污染,这不但会使水中溶解氧下降,鱼类大量死亡,严重时甚至会影响饮水安全[1, 2, 3]。因此,去除水体中的氨氮对于防治水体富营养化和保障水产养殖生产至关重要。
天然沸石是含水多孔铝硅酸盐的总称,其结晶构造主要由(SiO)四面体组成,其中部分Si4+为Al3+取代,导致负电荷过剩,因此,结构中有碱金属(碱土金属)等平衡电荷的离子。同时沸石构架中有一定孔径的空腔和孔道,决定了其具有吸附、离子交换等性质,因此其对氨氮具有很强的选择性吸附能力,因而可被应用于氨氮废水的处理[4, 5, 6, 7]。对沸石处理氨氮废水进行了许多研究,但是吸附动力学和等温吸附的研究结果不尽相同,尤其是对沸石饱和吸附量的研究鲜见报道[8, 9, 10, 11],因此有必要做进一步研究。本实验探讨了氨氮浓度、温度、时间、沸石粒径对天然沸石吸附氨氮的影响,研究了沸石对氨氮的动态吸附过程,旨在探索沸石对氨氮吸附的规律,为沸石用于氨氮废水处理奠定基础。
1 材料与方法 1.1 仪器设备岛津UV2550 紫外分光光度计;MILLIPORE超纯水器;上海智诚ZHWY-211C恒温培养振荡器;梅特勒Five Easy pH测定仪;干燥器;Thermo移液枪。
1.2 实验材料选用浙江缙云的天然沸石为实验材料,密度2.16 g·cm-3,硬度3~4,硅铝比4.25~5.25,孔隙率为30%~40%。试验前将沸石洗净、干燥,氨氮溶液用NH4Cl和超纯水配制,试验药品均为分析纯。
1.3 天然沸石的筛选选用孔隙不同的筛网,将选用的浙江缙云天然沸石放入筛网中,振荡筛选出0.5~1、1~2、2~3、3~5 mm和5~8 mm的沸石,用超纯水将筛选出的沸石洗净,105 ℃烘干,然后放入干燥器中保存。
1.4 试验方法在25 ℃下,取100 mL一定浓度的氨氮废水于250 mL 锥形瓶中,向其加入一定质量和粒径的沸石,将锥形瓶置于恒温振荡器中以200 r·min-1的速度振荡一定时间后静置,取上清液,用纳氏试剂分光光度法[12]测定水样的氨氮浓度。比较不同实验条件下,沸石对氨氮吸附的影响,以不加沸石的样品作为对照(CK),对照和处理每组设置3个重复,按下式计算氨氮去除率和沸石对氨氮的吸附量:
氨氮去除率:

单位质量沸石对氨氮的吸附量Q(mg·g-1):

式中:C0为氨氮试液初始浓度(mg·L-1);Ci为吸附平衡后试液氨氮的残留浓度(mg·L-1);V为试液体积(L);M为投加的沸石的质量(g)。
1.4.1 吸附动力学试验在250 mL的锥形瓶中分别加入1 g沸石和100 mL氨氮浓度为50 mg·L-1的NH4Cl溶液,分别在10、25、40 ℃下,以200 r·min-1振荡,分别在0、5、15、30、60、120、180、360、1 080、1 440 min取样测定氨氮浓度。
1.4.2 吸附等温试验在250 mL的锥形瓶中分别加入1 g沸石和100 mL氨氮浓度分别为10、20、50、100、150、200 mg·L-1的NH4Cl溶液,在25 ℃下,以200 r·min-1振荡360 min,取样测定氨氮浓度。
1.4.3 吸附影响因素试验在一系列250 mL的锥形瓶中分别加入沸石和100 mL氨氮浓度为50 mg·L-1 NH4Cl溶液,分别改变沸石粒径、沸石用量、氨氮溶液pH值,以200 r·min-1振荡360 min,取样测定氨氮浓度。
1.4.4 动态试验(穿透曲线)在Φ=35 mm的吸附柱中装入粒径为1~2 mm斜发沸石100 g,将氨氮浓度为50 mg·L-1的NH4Cl溶液以10 mL·min-1的流量通过沸石,测定其出水的氨氮浓度,每次各取3份样品作为重复。
1.5 数据整理与分析采用Excel 2003和SPSS 11.0软件进行数据处理,处理间多重比较用LSD 法。
2 结果与分析 2.1 吸附动力学研究通过在不同温度下进行试验,研究不同时间内沸石对氨氮的吸附量,进而得出反应速率变化的规律和物质浓度随时间变化的规律。沸石对氨氮的吸附量随时间而变化见图 1。在不同温度下,沸石对氨氮的吸附量都是随着时间的增加而增加,但并不一定随着温度的升高而增加。在吸附反应初始阶段(0~60 min),沸石对氨氮的吸附速率较大,吸附量上升很快,随着吸附反应的不断进行,吸附速率降低,在360 min后吸附基本达到平衡。沸石对氨氮的快速吸附阶段是氨氮在沸石表面和内部孔隙中的扩散吸附过程,第二阶段为平衡吸附过程,此时吸附速率随着溶液中氨氮浓度的降低而变慢,最终达到固液两相平衡。10、25 ℃和40 ℃下的平衡吸附容量分别为3.60、4.05 mg·g-1 和3.87 mg·g-1左右。采用SPSS软件进行处理间多重比较LSD分析,结果表明在3种温度下沸石对氨氮的吸附容量有显著性差异(P < 0.05)。

|
| 图 1不同温度下沸石吸附氨氮的动力学曲线 Figure 1Kinetic curves of NH4+ adsorption on zeolite at different temperature |
为了进一步描述沸石对氨氮吸附过程的动力学特征,利用图 1中的数据,用以下准二级动力学方程进行拟合:
t/Qt=1/(k2·Qe2+t/Qe
式中:t为吸附时间(min);Qt为t时刻的吸附量(mg·g-1);Qe为平衡吸附量(mg·g-1);k2为二级吸附速率常数(g·mg-1·min-1)。不同温度下沸石对氨氮吸附过程的动力学参数列于表 1。
表 1中数据显示,k2随着吸附温度的升高而增大,说明在10~40 ℃的范围内,沸石对氨氮的吸附速率是随着温度的升高而加快。其中二级吸附动力学方程的相关系数R2在各个温度下均达0.999以上,通过模型计算出的10、25 ℃和40 ℃下的平衡吸附质量分别为3.373、4.115、3.89 mg·g-1,与实验测定值十分接近,因此准二级吸附动力学模型可以较好地描述该吸附过程。但是,在10~40 ℃的温度下,沸石的平衡吸附量并不和温度成正比,在25 ℃下沸石的平衡吸附量最大,可能在25 ℃下更有利于沸石吸附反应的进行。
 |
对于给定的固-液体系,达到平衡时的固相吸附量同溶液中吸附质的平衡浓度有关。把固相的吸附质量比(Q)随溶液溶质平衡浓度(Ce)而变化的曲线称为吸附等温线。常见的吸附等温理论模型有Langmuir等温吸附模型和Freundlich等温吸附模型。
Langmuir等温吸附方程式为:
Ce/Qe=1/(Qm·KL)+Ce/Qm
式中:Qe为沸石平衡吸附量(mg·g-1);Ce为氨氮平衡浓度(mg·L-1);Qm为沸石对氨氮最大吸附量(mg·g-1);KL为表征吸附剂吸附能力的Langmuir常数(L·mg-1)。
Freundlich等温吸附方程式为:
lnQe=1/n×lnCe+lnKF
式中:n为与吸附亲和力相关的Freundlich常数;KF为与吸附量相关的Freundlich常数(L·mg-1)。
利用Langmuir等温吸附模型对实验数据进行拟合,即以Ce为横坐标,Ce/Qe为纵坐标作图(图 2a)。
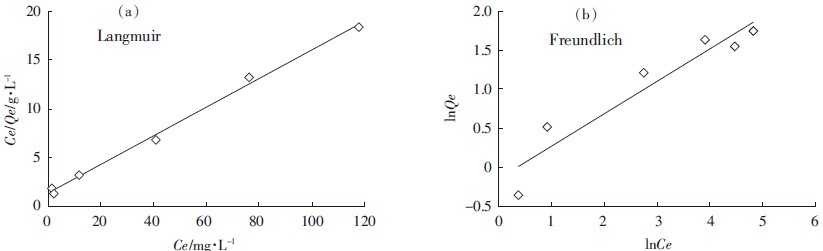
|
| 图 2 Langmuir和Freundlich等温模型拟合曲线 Figure 2 Fitting curve of Langmuir and Freundlich isotherm models |
根据拟合出直线方程的斜率和截距可以计算出沸石对氨氮的最大吸附量Qm、常数KL(表 2)。采用SPSS软件做Langmuir等温方程的相关性分析,结果表明相关系数达到极显著水平(P<0.01),Langmuir等温吸附模型可以很好地描述沸石对氨氮的吸附进程。同时,利用Freundlich等温吸附模型对实验数据进行拟合分析,即以lnQe对lnCe作图(图 2b),计算得出Freundlich等温吸附常数KF和1/n(表 2)。在Freundlich方程中,KF表示吸附能力,KF值越大,吸附剂的吸附能力越强。1/n值反映吸附剂的吸附强度,其值小于0.5,表明吸附容易进行,当其大于2时,吸附很难进行[13]。根据Freundlich方程计算1/n为0.416,表明沸石对氨氮吸附容易进行。
 |
实验中,在250 mL的锥形瓶中分别加入粒径1~2 mm的沸石和100 mL氨氮浓度为50 mg·L-1 NH4Cl溶液,沸石用量分别为2、5、10、20 g·L-1和30 g·L-1,温度25 ℃,反应360 min。不同用量的沸石对氨氮的吸附实验结果如图 3所示,结果表明,随着沸石用量的增加,沸石对氨氮的去除率由20%增大到95%,而单位吸附量由4.48 mg·g-1下降到1.59 mg·g-1。此外,当沸石用量低于10 g·L-1时,氨氮的单位吸附量随着沸石用量的减少迅速增加,而氨氮去除率快速上升,当沸石用量高于20 g·L-1后,氨氮去除率接近100%,而单位吸附量继续降低。沸石用量增加后,溶液中氨氮浓度快速降低,表现为吸附速率下降,吸附量减少。

|
| 图 3 沸石用量对氨氮吸附的影响 Figure 3 Effects of zeolite dosage on NH4+ adsorption |
实验中,在250 mL的锥形瓶中分别加入粒径1~2 mm的沸石和100 mL氨氮浓度为50 mg·L-1 NH4Cl溶液,沸石用量1 g,pH值分别为4.0、5.0、6.0、7.0、8.0、9.0和10.0,温度25 ℃。结果如图 4所示,当初始pH值在4~8 时,随着pH值的增加,沸石对氨氮的吸附量增大;当初始pH值在8~10 时,沸石的吸附量显著降低,pH=8时,沸石的吸附量达到最大值3.86 mg·g-1。溶液中pH值的变化会引起NH4+浓度的变化,进而影响到沸石对氨氮的吸附。

|
| 图 4 pH值对沸石吸附氨氮的影响 Figure 4 Effects of pH on zeolite NH4+ adsorption |
实验中,在250 mL的锥形瓶中分别加入粒径0.5~1、1~2、2~3、3~5、5~8 mm的沸石和100 mL氨氮浓度为50 mg·L-1 NH4Cl溶液,不同粒径的沸石对氨氮的吸附实验结果如图 5所示。结果表明,随着沸石粒径的增大,沸石对氨氮的单位吸附量减小,由3.75 mg·g-1减少到1.25 mg·g-1,可见粒径与沸石的吸附量成反比。这是由于随着沸石粒径的减小,比表面积增大,吸附量也会增加。

|
| 图 5 沸石粒径对氨氮吸附的影响 Figure 5 Effect of zeolite size on NH4+ adsorption |
在动态试验吸附柱中加入粒径为1~2 mm的沸石100 g,以10 mL·min-1流量加入氨氮浓度为50 mg·L-1 NH4Cl溶液,经过168 h连续运行,穿透曲线见图 6。
从图 6可知,在40 h左右,出水氨氮为26.5 mg·L-1,穿透率达到50%左右,至68 h时,出水氨氮为45 mg·L-1穿透,穿透率达90%,至96 h时,出水氨氮接近50 mg·L-1,沸石吸附柱已完全被穿透,根据穿透曲线可以计算沸石的“动态饱和吸附量”[14] (当出水浓度与进水浓度一样时吸附量)为18.8 mg·g-1。在本实验的条件下,沸石吸附柱可以连续使用40 h左右,超过这个时间就需要更换沸石或进行再生,才能保证氨氮去除效果。

|
| 图 6 沸石吸附氨氮的穿透曲线 Figure 6 Throughout curve of NH4+ adsorption on zeolite |
沸石是1756年由瑞典矿物学家Cronstedt发现的,其分子式通式为Mn/2·Al2O3·xSiO2·yH2O,式中M 为碱金属(碱土金属)阳离子,易被溶液中其他阳离子所替换,使沸石具有离子交换特性[15]。又因沸石具有不同连接方式的的硅(铝)氧四面体结构,沸石中便形成了大量的孔穴和孔道,因其比表面积很大,大量分子进入其中,因而具有很好的吸附性能。沸石对液相中NH4+的吸附主要包括物理吸附和离子交换作用两部分,物理吸附主要由沸石表面和孔隙内的色散力、静电力和毛细力等产生,与一般多孔性材料的吸附过程相同;离子交换是沸石晶体内阳离子与NH4+交换的化学过程,可用公式Zn-·Mn++nNH4+⇆Zn-·nNH4++Mn+来表示。2种吸附作用的主要差别就在于离子交换作用具有高度的选择性,在实验中将2种吸附作用的吸附总量称之为沸石对氨氮的吸附量[16]。自20世纪70年代以来出现了关于沸石吸附处理氨氮废水的实验报道,大多数研究者[8, 17, 18]都认为沸石对氨氮的吸附更符合(准)二级动力学方程。然而对于沸石吸附等温线的研究结果则不尽相同,Komarowaki等[19]研究了澳大利亚天然沸石对废水中NH4+的吸附作用,研究结果表明吸附平衡符合Freundlich吸附等温式。Kithome等[20]通过天然斜发沸石对不同pH值、不同起始氨氮浓度溶液中的铵离子吸附和解析实验数据的分析,得出吸附过程符合修正的Freundlich公式。温东辉等[9]、张曦等[10]通过对天然斜发沸石铵吸附容量的实验研究证明天然斜发沸石对NH4+的吸附符合Freundlich吸附等温式。这与唐登勇等[11]、Azhar等[21]的研究结果相一致。与此同时,Nguyen等[22]进行污水的除铵实验,得到了符合Langmuir公式的吸附等温式。还有些研究者[14, 23, 24]也认为沸石对氨氮的等温吸附过程更符合Langmuir吸附模型。本研究也发现二级动力学方程和Langmuir等温吸附模型可以更好地拟合沸石对NH4+的吸附。笔者认为,由于Langmuir方程和Freundlich方程成立的条件不同,从而导致不同浓度下Langmuir方程和Freundlich拟合效果偏离较大,也自然就出现了不同试验得出不同的结论。
氨氮在水中以氨(NH3)和铵(NH4+) 2种形态存在。在pH值较低时,由于H+的浓度较高,NH4+必须在沸石交换位置上与H+产生竞争交换,故沸石对NH4+的去除率较低。当水的pH值接近7时,H+的影响较小,主要表现为沸石对NH4+的交换吸附,因而沸石对NH4+的吸附率达到最高。当pH值继续升高,水中OH-增多,NH4+易与OH-结合,形成游离态的NH3,NH3不带电,不易与沸石中的Na+发生离子交换,主要依靠沸石的表面吸附作用,故沸石对NH4+的去除率大大降低。总的来看,OH-比H+对沸石的交换吸附影响更大,因此碱性条件下吸附量下降更快。
通常,吸附是由快速、缓慢吸附2个过程构成的。沸石颗粒表面的物理吸附,表面阳离子与NH4+的交换属快速吸附过程,而NH4+向沸石孔隙内部运动及与内部阳离子发生交换作用,内部阳离子向液相扩散则属缓慢吸附过程。刘玉亮等[25]采用吸附柱的方法研究了沸石对NH4+等动态吸附过程,吸附反应初期溶液中氨氮质量浓度的降低速率和沸石对氨氮的吸附速率均增加较快,快速吸附过程起主要作用;随着吸附时间的延长,缓慢吸附过程逐渐占主导位置,使得吸附反应速率减缓,直至沸石对NH4+的吸附达到饱和,本研究也得到了相似的结论。
4 结论本实验首先研究了沸石吸附氨氮的动力学特性,分别在10、25、40 ℃ 3种不同的温度条件下,分析了沸石吸附氨氮的动力学,结果表明在3种不同温度下,沸石吸附氨氮的过程均符合准二级动力学模型,而且计算出的平衡吸附量与实测值很接近。
在10~200 mg·L-1范围内,Langmuir方程比Freundlich方程能更好地描述氨氮在沸石上的吸附行为,且1/n为0.416,说明斜发沸石对氨氮有良好的吸附性能,是一种高效的吸附剂。
增加沸石的投加量,可以增加氨氮的去除率,但是沸石的单位吸附量会下降,而减小沸石的粒径可以提高沸石的吸附量。
通过动态吸附柱实验,研究了沸石的穿透曲线,在装入粒径为1~2 mm的沸石100 g,以10 mL·min-1流量加入氨氮浓度为50 mg·L-1 NH4Cl溶液的条件下,经过96 h沸石柱被完全穿透,根据穿透曲线计算出沸石的“动态饱和吸附量”约为18.8 mg·g-1。
由于沸石具有交换吸附的特性,今后将在阳离子对沸石吸附的影响和沸石改性等方面开展进一步研究,并将沸石作为吸附基质材料,进行水体富营养化治理和水产养殖污水处理等实际应用研究。
| [1] | Zorpas A, Constantinides T, Vlyssides A G, et al. Heavy metal uptake by natural zeolite and metals partitioning in sewage sludge compost[J]. Bioresource Technology, 2000, 72(2): 113-119. |
| [2] | Ortega E, Cheeseman C, Knight J, et al. Properties of alkal-inactivated clinoptilolite[J]. Cement and Concrete Research, 2000, 30(10): 1641-1646. |
| [3] | Lahav O, Green M. Ammonium removal using ion exchange and biological regeneration[J]. Water Research, 1998, 32(7): 2019-2028. |
| [4] | Pond W G, Mumpton J A. Zeolite-agriculture[M]. Boulder, Colorado:Westview Press, 1984: 33-54. |
| [5] | Tsitisihvili G V, Ronikashvili T G. Natural zeolites[M]. Chichester: England: Ellis Horwood Limited, 1992. |
| [6] | Booker N A, Cooney E L, Priestley A J. Ammonia removal from sewage using natural Australian zeolite[J]. Water Sci Technol, 1996, 34(9): 17-24. |
| [7] | 李 晔, 王建兵, 肖文浚, 等. 沸石去除水源中低浓度氨氮的实验研究[J]. 武汉理工大学学报, 2003, 25(2): 4-6.LI Ye, WANG Jian-bing, XIAO Wen-jun, et al. The experimental study of removing low concentration of ammonia nitrogen from the water source by zeolites[J]. Journal of Wuhan University of Technology, 2003, 25(2): 4-6.(in Chinese) |
| [8] | 王文超, 管俊芳, 严春杰, 等. 斜发沸石处理氨氮废水[J]. 环境工程学报, 2014(3): 1036-1040.WANG Wen-chao, GUAN Jun-fang, YAN Chun-jie, et al. Adsorption of ammonium-nitrogen in wastewater by clinoptilolite[J]. Chinese Journal of Environmental Engineering, 2014(3): 1036-1040.(in Chinese) |
| [9] | 温东辉, 唐孝炎, 马倩如. 天然沸石铵吸附容量的研究[J]. 环境科学研究, 2003, 16(2): 31-34.WEN Dong-hui, TANG Xiao-yan, MA Qian-ru. Research on the adsorption capacity for ammonium of natural zeolite[J]. Research of Environmental Sciences, 2003, 16(2): 31-34.(in Chinese) |
| [10] | 张 曦, 吴为中, 温东辉. 氨氮在天然沸石上的吸附及解析[J]. 环境化学, 2003, 22(2): 166-171.ZHANG Xi, WU Wei-zhong, WEN Dong-hui. Adsorption and desorption of ammonia-nitrogen onto natural zeolite[J]. Environmental Chemistry, 2003, 22(2): 166-171.(in Chinese) |
| [11] | 唐登勇, 郑 正, 林志荣, 等. 天然沸石吸附低浓度氨氮废水的研究[J]. 环境科学与技术, 2010, 33(12): 206-209.TANG Deng-yong, ZHENG Zheng, LIN Zhi-rong, et al. Adsorption of ammonium-nitrogen from low concentration wastewater by natural zeolite[J]. Environmental Science & Technology, 2010, 33(12): 206-209.(in Chinese) |
| [12] | 国家环境保护总局. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社, 2002.State Environmental Protection Administration of China. Analyse method of water and wastewater (4th Edition)[M]. Beijing: China Environmental Science Press, 2002.(in Chinese) |
| [13] | Budhendra B, Jon H, Bernie E, et al. Assessing watershed-scale, long-term hydrologic impacts of land-use change using a GIS-NPS model[J]. Environmental Management, 2000(6): 643-658. |
| [14] | 祝万鹏, 杨津湘, 杨志华, 等. 氨氮在饱和水粉砂土和亚砂土层中吸附过程及其模拟[J]. 环境科学, 1996, 17(2): 9-11.ZHU Wan-peng, YANG Jin-xiang, YANG Zhi-hua, et al. Adsorption behavior of ammonium ion in saturated silty sand and sandy loam[J]. Environment Science, 1996, 17(2): 9-11.(in Chinese) |
| [15] | 王万军, 邵聚红, 赵彦巧. 天然沸石在环境污染治理中的研究现状和发展趋势[J]. 资源环境与工程, 2007, 21(2): 187-192.WANG Wan-jun, SHAO Ju-hong, ZHAO Yan-qiao. The application of zeolite to treatment of environmental pollution: its status quo and tendency[J]. Resources Environment and Engineering, 2007, 21(2): 187-192.(in Chinese) |
| [16] | Rozic M, Cerjan-Stefanovic S. Ammoniacal nitrogen removal from water by treatment with clays and zeolites[J]. Water Research, 2000, 34(14): 3675-3681. |
| [17] | 袁时珏, 黄远星, 李 亮, 等. 沸石吸附水体中氨氮的热力学和动力学过程研究[J]. 水资源与水工程学报, 2013(4):11-14.YUAN Shi-jue, HUANG Yuan-xing, LI Liang, et al. Study on thermodynamic and kinetic of ammonia in water body adsorbed by zeolite[J]. Journal of Water Resources & Water Engineering, 2013(4): 11-14.(in Chinese) |
| [18] | 李元志, 沈志强, 周岳溪, 等. 天然斜发沸石对氨氮的快速吸附特性研究[J]. 环境工程技术学报, 2014(4): 275-281.LI Yuan-zhi, SHEN Zhi-qiang, ZHOU Yue-xi, et al. Study on quick adsorption characteristics of ammonia on natural clinoptilolite[J]. Journal of Environmental Engineering Technology, 2014(4): 275-281.(in Chinese) |
| [19] | Komarowski S, YU Q. Ammonium ion removal from wastewater using Australian natural zeolite: batch equilibrium and kinetic studies[J]. Environ Technol, 1997, 18(11): 1085-1097. |
| [20] | Kithome M K, Paul J W, Lavkulich L M, et al. Kinetics of ammonium adsorption and desorption by the natural zeolite clinoptilolite[J]. Soil Science Society of America Journal, 1998, 62(3): 622-629. |
| [21] | Azhar A Halima, Hamidi A Azizb, Megat Azmi Megat Joharib, et al. Comparison study of ammonia and COD adsorption on zeolite, activated carbon and composite materials in landfill leachate treatment[J]. Desalination, 2010, 262(2): 31-35. |
| [22] | Nguyen M L, Tanner C C. Ammonium removal from wastewaters using natural New Zealand zeolites[J]. New Zealand Journal of Agricultural Research, 1998, 4(3): 427-446. |
| [23] | 游少鸿, 佟小薇, 朱义年. 天然沸石对氨氮的吸附作用及其影响因素[J]. 水资源保护, 2010, 26(1): 70-74.YOU Shao-hong, TONG Xiao-wei, ZHU Yi-nian. Experimental study on ammonium adsorption onto natural stellerite and its factors[J]. Water Resources Protection, 2010, 26(1): 70-74.(in Chinese) |
| [24] | 徐电波. 天然斜发沸石对水中氨氮吸附影响因素研究[J]. 价值工程, 2013(17): 285-287.XU Dian-bo. Study on influencing factors of natural stellerite adsorbing ammonia and nitrogen[J]. Value Engineering, 2013(17): 285-287.(in Chinese) |
| [25] | 刘玉亮, 罗固源, 阙添进. 斜发沸石对氨氮吸附性能的试验分析[J]. 重庆大学学报, 2004, 27(1): 62-65.LIU Yu-liang, LUO Gu-yuan, QUE Tian-jin. Experimentation study on the adsorption capability about the ammonia nitrogen from water using clinoptilolite[J]. Journal of Chongqing University, 2004, 27(1): 62-65.(in Chinese) |
 2015, Vol. 32
2015, Vol. 32



