文章信息
- 康凌云, 黄诗坤, 陈硕, 陈清
- KANG Ling-yun, HUANG Shi-kun, CHEN Shuo, CHEN Qing
- 轮作不同高粱品种阻控设施菜田氮素损失潜力研究
- The Potential to Reduce Nitrogen Loss Through Rotating Different Sorghum Varieties in Greenhouse Vegetable Field
- 农业资源与环境学报, 2015, 32(3): 215-221
- Journal of Agricultural Resources and Environment, 2015, 32(3): 215-221
- http://dx.doi.org/10.13254/j.jare.2014.0336
-
文章历史
- 收稿日期:2014-11-29
针对蔬菜种植的高收益和人多地少等矛盾,大多数菜田普遍存在养分过量投入和长期连作问题,不仅导致养分积累和土壤微生物区系失衡、根结线虫等土传病害问题,而且造成菜田生产更依赖于化肥、有机肥以及化学药剂的供给,盲目高量施肥(氮肥和有机肥)成为农户传统蔬菜管理体系的典型特征[1, 2]。施入农田中的氮肥,当季被作物利用的仅有30%~40%,其余的则通过氨挥发、硝化、反硝化、渗漏和径流等多种途径损失[2]。在设施蔬菜生产中,氮肥的淋洗损失被认为是氮素损失的主要途径之一,也是造成地下水硝酸盐污染的重要原因[3]。我国北方设施菜田夏季揭棚休闲期及秋冬季定植后正是土壤硝态氮淋洗的高峰期[4]。夏季温度升高,微生物活动增强,有机肥氮素矿化量与速率均呈增大的趋势[5],在北方设施菜田有机肥氮素矿化的季节性差异明显,设施菜田中冬春茬和秋冬茬每周土壤有机氮素矿化平均速率分别为2.9 kg·hm-2和6.2 kg·hm-2 [6],夏季休闲期的矿化速率可能还要更高,从而导致大量的无机氮累积,休闲期揭膜后雨水及下茬定植后大量灌水均会导致土壤表层累积的无机氮向深层淋洗[7]。研究表明夏季休闲期种植填闲作物甜玉米通过吸收(和)或固定作用可以在很大程度上进一步阻控硝酸盐淋洗,减少氮素损失[8, 9, 10, 11, 12],但是由于设施菜田表层土壤养分较高,甜玉米根系下扎能力不足,0~45 cm土层的根长分别占0~105 cm土层总根长的85%[8],对深层氮素的吸收作用较弱。而高粱在我国旱作农区,凡不适于玉米、小麦栽培的干旱或半干旱瘠薄耕地,种植高粱均能获得较高和较稳定的籽粒产量[13],其抗逆性较强的特点与发达的根系有关[14],因此本文选择北方常见的6个高粱品种作为填闲作物,以甜玉米作为对照,在北京郊区设施菜田研究不同品种高粱在生物量、养分带走量、根系发育及土壤氮素转化方面的差异,筛选适宜于北方夏季种植、生长迅速、根系下扎深且高效吸氮的填闲作物,为控制我国北方集约化蔬菜种植区硝态氮淋失、减轻地下水污染提供依据。 1 材料与方法 1.1 供试日光温室及土壤
试验地点选于北京市房山区温室菜园,为2010年新建日光温室,采取半下沉式设计,低于地面约30 cm,实际面积为5.2 m×61 m。试验土壤为壤土,试验开始前0~30 cm土层的pH值为6.87(水土比为2.5∶1),EC值为0.84 mS·cm-1(水土比为5∶1),无机氮(Nmin)含量为174.0 mg·kg-1,土壤有机质含量为18.7 g·kg-1,全氮含量、Olsen-P 以及 NH4OAc-K 含量分别为1.62 g·kg-1、121 mg·kg-1和 210 mg·kg-1。 1.2 供试品种
选择适宜北方地区生长的高粱品种:晋杂12 [15]、晋杂15[16]、抗四[17]、晋中405[18]、龙杂9号[19]、冀梁2号[20],根据品种特性、生育期、株高等设施菜田休闲期种植作物限制因素,重点关注晋杂12、抗四和冀粱2号,玉米品种选择甜玉4号作为对照(表 1)。
试验包括7个不同品种的高粱、甜玉米及空白休闲对照,共8个处理,3次重复,常规方式种植,株行距35 cm×60 cm,每个小区定植3行作物,于2013年7月21日播种,后因高温出苗率低,于2013年8月1日补种,8月6日出苗,9月7日在高粱拔节期沟施尿素150 kg·hm-2,12月3日收获。 1.4 测定项目与方法
植株养分吸收量:在收获期,各小区分别取有代表性的植株3株,烘干后称重,测定生物量,粉碎过筛后测植株全氮、磷、钾。全氮:H2SO4-H2O2法消煮-半微量蒸馏法;全磷:H2SO4-H2O2法消煮-钼锑抗吸光光度法;全钾:H2SO4-H2O2法消煮-火焰光度法[21]。
株高:在收获期,各小区分别取有代表性的植株3株,测定其株高。
根系生长:在收获期,选择冀粱2号、抗四、晋杂15测定根系生长情况,甜玉4号作为对照。用根钻法采集根系样品,以植株为中轴沿行间方向用高为15 cm、直径为10 cm的根钻密集取样。采样深度为0.45 m,水平方向取3钻。样品采集后装入封口袋,带入室内,用洗根法将根挑出、洗净后使用EPSON-V750扫描仪进行扫描,利用WinRHIZO软件进行分析,得出根长、根直径、表面积等数据。
土壤无机氮测定:在施肥后1、3、5 d及收获后分0~30 cm和30~60 cm 2个土层于植株行内两株植株之间用土钻取土,将同一土层的样品迅速装入一个封口袋内,带回室内,立即过2 mm筛并混匀。称取20 g左右鲜土于铝盒中,在105 ℃下烘干12 h,测定土壤含水量;同时称取12.00 g 鲜土样于塑料瓶中,加入1 mol·L-1 KCl溶液100 mL浸提,过滤后置-18 ℃冰柜内冷冻贮存,流动分析仪San++system测定铵态氮、硝态氮[21]。
试验数据利用SAS 8.0统计软件和Excel 2013进行统计分析。 2 结果与分析 2.1 填闲作物株高及生物量
收获后各处理株高及生物量(干重)如图 1所示,对比株高,甜玉4号株高达到2.8 m,显著高于各品种高粱,高粱株高在1.3~2.1 m范围内,其中晋杂12>抗四>晋中405>龙杂9号>晋杂15>冀粱2号,相比甜玉米,高粱品种对于不同拱高的设施大棚适用性更广。对比生物量,收获后晋杂12地上部分的生物量达到了11.2 t·hm-2,显著高于晋杂15、龙杂9号、冀梁2号、晋中405、甜玉4号的地上部分生物量,其中冀梁2号地上部分生物量显著低于晋杂12,为6.0 t·hm-2,和甜玉4号无显著性差异。
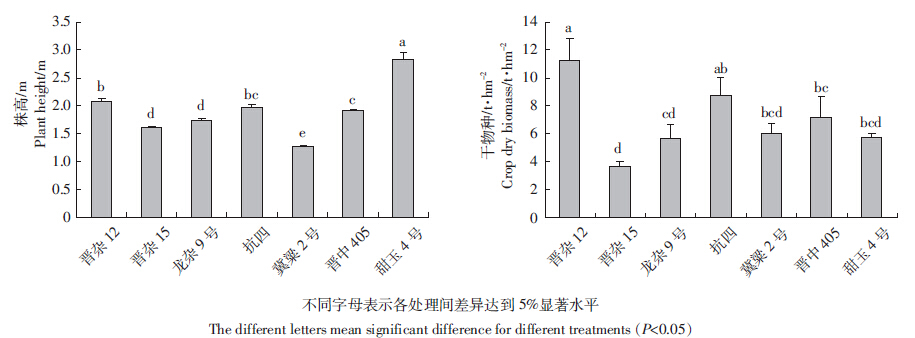
|
| 图 1 不同高梁品种筛选试验植株株高及生物量 Figure 1 Plant height and above-gound dry biomass of sorghum selection experiment in greenhouse located at Fangshan, Beijing in 2013 |
收获后各处理作物地上部氮磷钾养分带走量如表 2所示。晋杂12植株从土壤中带走的氮素养分量达到138.8 kg·hm-2,与晋杂15、龙杂9号、晋中405、甜玉4号氮素养分带走量有显著性差异。晋杂12从土壤中带走的磷养分含量达到28.2 kg·hm-2,与晋杂15、甜玉4号有显著性差异。晋杂12从土壤中带走的钾养分含量达到126.3 kg·hm-2,与晋杂15、龙杂9号、抗四、冀梁2号、晋中405、甜玉4号钾养分带走量有显著性差异。
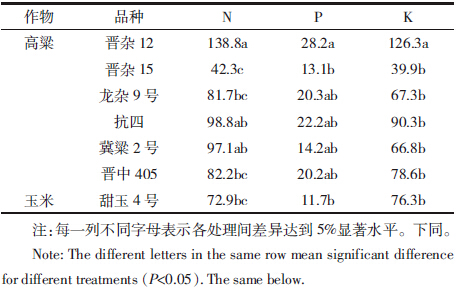 |
收获后冀粱2号、抗四、晋杂12、甜玉4号0~45 cm土层总根长、根表面积、根系平均直径及根体积分布如图 2所示。晋杂12的根长在0~15 cm的土层内达到138 m,显著高于冀梁2号;15~30 cm土层内各处理根长无显著性差异;30~45 cm土层内晋杂12根长可达到69 m,显著高于冀梁2号。晋杂12在0~15 cm土层内根表面积达到2 961 cm2,显著高于冀梁2号、抗四、甜玉4号这3种作物;而在15~30、30~45 cm深度的土层内,4种作物根表面积无显著性差异。各处理根系在不同土层直径无显著性差异,其中晋杂12在0~15、15~30、30~45 cm土层内平均根直径可达到2.94、0.75、0.63 mm。晋杂12在0~15 cm土层内的根体积可达到59.9 cm3,显著高于冀梁2号、甜玉4号,15~30、30~45 cm土层内4种作物根体积无显著性差异。
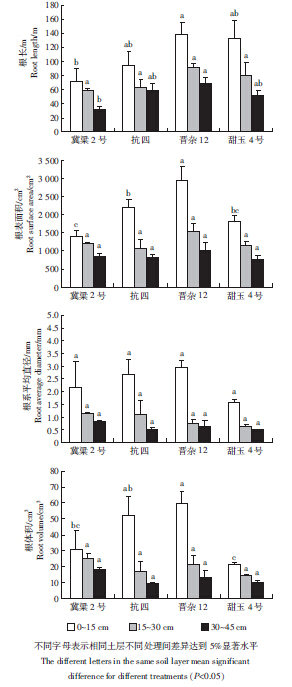
|
| 图 2 不同高粱品种筛选试验不同土层植株总根长、根表面积、根系平均直径及根体积分布 Figure 2 Root length, surface area, average diameter and volume at different soil layers of sorghum selection experiment in greenhouse located at Fangshan, Beijing in 2013 |
施肥后1、3、5 d后土壤中0~30、30~60 cm土层的无机氮含量如图 3所示。从图 3中可得知,在施肥后1 d,晋杂12、甜玉4号和空白土壤中0~30 cm土层内的硝态氮迅速达到了峰值,之后呈明显下降趋势。而冀梁2号在施肥1 d后,NO3--N显著低于其他品种,施肥3~5 d后,NO3--N含量缓慢达到峰值;30~60 cm土壤NO3--N呈现相同变化趋势。施肥后空白和甜玉4号处理0~30 cm土层铵态氮含量显著低于晋杂12和冀粱2号。施肥1 d及5 d后,冀粱2号铵态氮含量显著高于晋杂12;在30~60 cm土层内,施肥1~3 d各处理土壤铵态氮呈下降趋势,5 d后随表层养分淋洗,铵态氮含量呈增加趋势,其中晋杂12和冀粱2显著高于甜玉4号和空白。
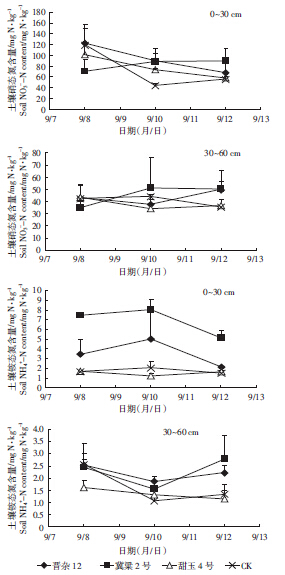
|
| 图 3 不同高粱品种筛选试验0~60 cm土壤无机氮含量 Figure 3 Soil mineral nitrogen content in different soil layers after urea application of catch crop selection experiment in greenhouse located at Fangshan, Beijing in 2013 |
根据休闲期前后0~60 cm土壤无机氮含量、肥料投入及植株养分带走量计算填闲期表观氮素平衡,从表 3可见试验开始前各处理0~60 cm土层无机氮含量无显著性差异,休闲结束后,休闲处理0~60 cm土层中无机氮含量有明显的积累现象,而填闲作物的种植由于氮素吸收减少了无机氮在土体中的积累,各填闲处理无机氮含量显著低于休闲处理,但品种间差异不显著。
综合比较甜玉米和高粱在株高、生物量、氮磷钾养分带走量及根系生长特征等方面的差异,可见高粱植株为矮壮型,株高均低于甜玉4号;除晋杂15外,高粱生物量均高于甜玉4号;高粱氮磷钾养分带走量均显著高于或与甜玉4号养分带走量无显著性差异,根长、根表面积、根平均直径及根体积高粱均高于甜玉4号,特别是晋杂12的生物量最大、带走养分最多、根系最发达,同时具有生育周期短、耐高温、抗涝等特点,可以作为北方夏季填闲作物种植,特别是越冬长茬温室种植,在7—10月约有4个月的夏季休闲期,可以保证高粱100~123 d的生育期[13]。
通过研究高粱拔节期尿素施用后土壤中硝态氮和铵态氮的动态变化,初步可以看出高粱冀梁2号处理土壤中的硝态氮出现高峰时间较其他作物根系环境土壤中硝酸盐高峰时间滞后,且铵态氮含量保持较高水平,下降速度缓慢,其他作物根际土壤中的硝酸盐通常在施肥后一两天就达到了峰值,铵态氮则迅速下降到最低,推测冀梁2号处理土壤中的硝化速率较为缓慢。甜玉米则未发生硝化速率降低的现象。Subbarao等[22, 23, 24]关于生物硝化抑制剂(BNI)的研究可以解释这一现象,高粱根系可以分泌对羟基苯丙酸甲酯[25],具备显著的硝化抑制物质分泌能力,但不同品种的高粱分泌生物硝化抑制剂能力也各不相同,要通过实验,综合各种因素评定最优选。另外的常见粮食作物如大麦、小麦、玉米均不具备充分的生物硝化抑制剂能力,部分品种水稻具备一定BNI能力,但是在田间试验中氮素形态变异较大,受多方面因素影响,除了自然条件的影响外,冀粱2号生物量较低,根系吸氮速率可能会低于其他品种作物,而且不同品种对氨氮及硝氮的偏好也是未知的,冀粱2号是否是由于释放生物硝化抑制剂导致的土壤硝化过程减缓仍需进一步证明,可以通过收集根系分泌物,使用重组亚硝化单胞细菌(Nitrosomonas europaea)的生物发光方法来检测根系分泌的硝化抑制剂活性[19]。Subbarao等[22]通过收集臂形草根系分泌物,添加至土壤中进行培养试验,证明根系分泌生物硝化抑制剂培养55 d后仍对硝化过程有抑制作用。高粱分泌的硝化抑制剂是否能发挥55 d的作用,仍值得研究,但已进一步明确高粱填闲作物收获后对下茬作物生长期间土壤氮素硝化过程的抑制作用强度及作用时间。张莹等[26]研究表明高粱分泌生物硝化抑制剂的能力主要受土壤中不同形态氮素的影响,相对于硝态氮,铵态氮明显地促进了硝化抑制剂的分泌,同时pH值也影响了生物硝化抑制剂的分泌,在pH<6时,硝化抑制剂的活性随着根系分泌氢离子的增加而增强。在北方设施菜田,pH值普遍在7~9之间[27],硝态氮含量一般高于铵态氮,是否会对高粱分泌生物硝化抑制剂能力有所限制,还需要进一步的试验证明。
填闲季结束后填闲处理及休闲处理氮素平衡均出现负值,说明在设施蔬菜种植体系,夏季高温环境下,土壤中有大量氮素被矿化,且大部分土壤氮素存留在土壤表层,造成土壤无机氮素在夏季填闲结束后都有所增加,填闲处理显著降低土壤表层无机氮的积累,减少了下一季由于定植大量灌水而造成的淋洗风险。
综上比较各处理作物生物学性状及对氮素转化的影响,可知晋杂12因其较大的生物量、发达的根系,从土壤中带走养分的能力是最强的,而冀梁2号虽然在生物量、根系、生物量等方面不如晋杂12,但是冀梁2号明显减缓了土壤中发生的硝化反应,使铵态氮保持较高水平,可以减少硝酸盐淋洗风险。但是填闲作物从土壤中提氮和抑制硝化的能力并不匹配,究竟较大的养分带走量减少硝酸盐淋洗的作用更强,还是通过分泌硝化抑制剂抑制硝化过程减少硝酸盐淋洗更重要,我们仍需要进一步的深入研究。 4 结论
(1)从养分带走量、生物量、根系等方面来看,晋杂12较其他品种均占优势,成熟期生物量为11.2 t·hm-2,0~45 cm根长为299 m,氮素带走量为139 kg·hm-2,均显著高于常规填闲甜玉米,是北方设施菜田较好的填闲作物品种,可以替代甜玉米推广使用。
(2)冀梁2号处理在尿素施用后土壤铵态氮含量高于其他处理,可能是作物根系分泌的生物硝化抑制剂减缓了土壤硝化过程,但是该品种生物量、根长等指标低于甜玉米,仍需进一步试验研究比较释放生物硝化抑制剂和生物提氮作用在减少氮素损失方面的作用,以筛选出更高效减少氮素损失的高粱品种。
| [1] | 何飞飞. 设施番茄生长体系的氮素优化管理及其环境效应研究[D]. 北京: 中国农业大学博士论文, 2006: 16-28. HE Fei-fei. Studies on optimizing nitrogen management and environmental implications in greenhouse tomato cropping system[D]. Beijing: China Agricultural University, 2006: 16-28.(in Chinese) |
| [2] | Ju X T, Liu X J, Zhang F S. Nitrogen balance and groundwater nitrate contamination: Comparison among three intensive cropping systems on the north China plain[J]. Environmental Pollution, 2006, 143: 117-125. |
| [3] | Di H J, Cameron K C. Nitrate leaching in temperate agroecosystems: sources, factors and mitigating strategies[J]. Nutrient Cycling Groecosystems, 2002, 46: 237-256. |
| [4] | 和 亮, 刘宏斌, 文宏达, 等. 设施菜地夏季休闲期甜玉米经济产量及环境效益分析[J]. 玉米科学, 2011, 19(5): 105-109. HE Liang, LIU Hong-bin, WEN Hong-da, et al. Economic yield and environmental benefits of sweet corn in facility vegetable field in summer[J]. .Journal of Maize Sciences, 2011, 19(5): 105-109(in Chinese) |
| [5] | Deneve S, Hartmann R, Hofman G. Temperature effects on N mineralization: changes in soil solution composition and determination of temperature coefficients by TDR[J]. European Journal of Soil Science, 2003, 54: 49-61. |
| [6] | 贾 伟, 王丽英, 陈 清. 华北平原菜田有机氮素净矿化速率的季节性差异[J]. 华北农学报, 2013, 28(5): 198-205. JIA Wei, WANG Li-ying, CHEN Qing. Seasonal differences in net mineralization rate of organic nitrogen in vegetable field of north China plain[J]. Acta Agriculturae Boreali-Sinica, 2013, 28(5): 198-205.(in Chinese) |
| [7] | Spalding R F, Exner M E. Occurrence of nitrate in groundwaier: A review[J]. Journal of Environmental Quality, 1993, 22: 392-402. |
| [8] | 郭瑞英. 设施黄瓜根层氮素调控及夏季种植填闲作物阻控氮素损失研究[D]. 北京: 中国农业大学博士论文, 2007: 43-44. GUO Rui-ying. Studies on nitrogen control in rootzone and summer catch crop planting for reducing N loss in greenhouse cucumber cropping system[D]. Beijing: China Agricultural University, 2007: 43-44.(in Chinese) |
| [9] | 任智慧, 李花粉, 陈 清, 等. 甜玉米填闲减缓菜田土壤硝酸盐淋溶的研究[J]. 农业工程学报, 2006, 22(9): 245-249. REN Zhi-hui, LI Hua-fen, CHEN Qing, et al. Soil nitrogen uptake by sweet corn to reduce nitrogen leaching in the vegetable field[J]. Transactions of the CSAE, 2006, 22(9): 245-249.(in Chinese) |
| [10] | 赵小翠, 姜春光, 袁会敏, 等. 夏季种植甜玉米减少果类菜田土壤氮素损失的效果[J]. 北方园艺, 2010(15): 194-196. ZHAO Xiao-cui, JIANG Chun-guang, YUAN Hui-min, et al. Effect of summer sweet corn planting on the reduction of soil N loss in greenhouse vegetable field[J]. Northern Horticulture, 2010(15): 194-196.(in Chinese) |
| [11] | 张继宗, 刘培财, 左 强, 等. 北方设施菜地夏季不同填闲作物的吸氮效果比较研究[J]. 农业环境科学学报, 2009, 28(12): 2663-2667. ZHANG Ji-zong, LIU Pei-cai, ZUO Qiang, et al. Nitrogen uptake by different catch crops in facility vegetable field[J]. Journal of Agro-Environment Science, 2009, 28(12): 2663-2667.(in Chinese) |
| [12] | 赵秀芬, 赵扩元, 李俊良. 填闲作物在日光温室黄瓜生产中的应用效果[J]. 安徽农业科学, 2009, 37(12): 5446-5447, 5478. ZHAO Xiu-fen, ZHAO Kuo-yuan, LI Jun-liang. Effects of catch crop on cucumber production in solar greenhouse[J]. Journal of Anhui Agriculture Science, 2009, 37(12): 5446-5447, 5478.(in Chinese) |
| [13] | 辽宁农业科学院. 中国高粱栽培学[M]. 北京: 农业出版社, 1988: 22-23. Liaoning Academy of Agricultural Sciences. China sorghum cultivation[M]. Beijing: Agriculture Press, 1988: 22-23.(in Chinese) |
| [14] | 张喜英. 高梁根系生长发育规律及动态模拟[J]. 生态学杂志, 1999, 18(5): 65- 67. ZHANG Xi-ying. Characters and dynamic model of sorghum root growth and development[J]. Chinese Journal of Ecology, 1999, 18(5): 65-67.(in Chinese) |
| [15] | 韦耀明, 李团银, 李三棉, 等. 高粱杂交种晋杂12号选育报告[J]. 山西农业科学, 1992(9): 8-9. WEI Yao-ming, LI Tuan-yin, LI San-mian, et al. Breeding of Jinza 12 sorghum hybrid[J]. Journal of Shanxi Agriculture Science, 1992(9): 8-9.(in Chinese) |
| [16] | 平俊爱, 程庆军, 杜志宏, 等. 早熟高粱晋杂15特性及高产栽培技术[J]. 作物杂志, 2002(2): 31. PING Jun-ai, CHENG Qing-jun, DU Zhi-hong, et al. Characteristics and high-yield cultivation technique of Jinza 15 sorghum hybrid[J]. Journal of Crop, 2002(2): 31.(in Chinese) |
| [17] | 徐瑞洋, 赵随堂, 冯未娥, 等. 抗4、抗7高粱品种选育及对丝黑穗病抗性的遗传[J]. 华北农学报, 1997, 12(4): 33-37. XU Rui-yang, ZHAO Sui-tang, FENG Wei-e, et al. Breeding of Kang 4 and Kang 7 sorghum hybrids and inheritance of the resistance to head smut in sorghum[J]. Acta Agriculturae Boreali-Sinica, 1997, 12(4): 33-37.(in Chinese) |
| [18] | 董水仙. 杂交高粱—晋中405[J]. 作物杂志, 1990(4): 37-38. DONG Shui-xian. Breeding of Jinzhong 405 sorghum hybrid[J]. Journal of Crop, 1990(4): 37-38.(in Chinese) |
| [19] | 黑龙江省农业科学院作物育种研究所. 龙杂9号[EB//OL]. http://www.theworldseeds.com/dbindex.php?vid=1883, 2014, 4. Institute of Crop Breeding, Heilongjiang Academy of Agricultural Sciences. Longza 9 sorghum hybrid[EB//OL]. http://www.theworldseeds.com/dbindex.php?vid=1883, 2014, 4.(in Chinese) |
| [20] | 张继益. 高粱新品种冀粱2号[J]. 作物品种资源, 1996(2): 50-51. ZHANG Ji-yi. Breeding of Jiliang 2 sorghum hybrid[J]. Journal of Crop Variety Resources, 1996(2): 50-51.(in Chinese) |
| [21] | 鲍士旦. 土壤农化分析(第三版)[M]. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil and agricultural chemistry analysis (third edition)[M]. Beijing: China Agriculture Press, 2000.(in Chinese) |
| [22] | Subbarao G V, Ishikawa T, Ito O, et al. A bioluminescence assay to detect nitrification inhibitors released from plant roots: a case study with Brachiaria humidicola[J]. Plant and Soil, 2006, 288(1-2): 101-112. |
| [23] | Subbarao G V, Rondon M, Ito O, et al. Biological nitrification inhibition (BNI): is it a widespread phenomenon?[J]. Plant and Soil, 2007, 294(1-2): 5-18. |
| [24] | Subbarao G V, Nakahara K, Ishikawa T, et al. Biological nitrification inhibition (BNI) activity in sorghum and its characterization[J]. Plant and Soil, 2013, 366(1-2): 243-259. |
| [25] | Zakir H A K M, Subbarao G V, Pearse S J, et al. Detection, isolation and characterization of a root exuded compound, methyl 3-(4-hydroxyphenyl) propionate, responsible for biological nitrification inhibition by sorghum (Sorghum bicolor)[J]. New Phytologist, 2008, 180(2): 442-451. |
| [26] | 张 莹, 张明超, 朱毅勇, 等. 高粱在不同氮源处理下分泌生物硝化抑制剂的差异[J]. 土壤, 2012, 44 (6): 982-986. ZHANG Ying, ZHANG Ming-chao, ZHU Yi-yong, et al. The mechanism of biological nitrification inhibitor released by sorghum under different nitrogen sources[J]. Soils, 2012, 44 (6): 982-986.(in Chinese) |
| [27] | 曹文超, 张运龙, 严正娟, 等. 种植年限对设施菜田土壤 pH及养分积累的影响[J]. 中国蔬菜, 2012(18): 134-141. CAO Wen-chao, ZHANG Yun-long, YAN Zheng-juan, et al. Effect of planting years on soil pH and nutrient accumulation in greenhouse vegetable fields[J]. China Vegetables, 2012(18): 134-141.(in Chinese) |
 2015, Vol. 32
2015, Vol. 32






