文章信息
- 田爽, 吴秋彩, 王晓萍
- TIAN Shuang, WU Qiu-cai, WANG Xiao-ping
- 乙草胺降解菌WN-3的分离鉴定及其降解特性分析
- Isolation, Identification and Degradation Characteristics of Acetochlor Degradation Bacterium WN-3
- 农业资源与环境学报, 2015, 32(2): 192-197
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0306
-
文章历史
- 收稿日期:2014-11-03
乙草胺(Acetochlor),也可叫禾耐斯,于1971年由美国孟山都公司开发,目前是世界上最重要的除草剂品种之一,20世纪90年代初我国开始引进并生产,当前也是我国使用量最大的除草剂之一,尤其是在东北地区[1]。化学名称:2′-乙基-6′-甲基-N-(乙氧甲基)-2-氯代乙酰替苯胺(2-chloro-N-(ethoxymethyl)-N-(2-ethyl-6-methylph-enyl)ac-etamide),分子式C14H20ClNO2,分子量为269.77。属于内吸型、酰胺类、选择性、芽前土壤处理除草剂。具有除草效果好、低毒、高活性、强选择性等特性,可防除一年生禾本科杂草和某些一年生阔叶杂草,可用来去除大豆、花生、棉花、玉米田杂草[2, 3]。但由于乙草胺降解周期较长,还有容易残留、不易光解和挥发的特点,如果过量、频繁地对土壤施用乙草胺或施用方法不正确,会造成环境污染,改变生态环境质量,并威胁了动植物及人类的健康状况[4, 5],已经被美国环境保护局定为B-2类致癌物[6]。考虑到乙草胺对环境和人体的潜在危害,欧盟委员会已经决定不再登记,并对欧盟成员国下令于2012年7月23日取消登记。现存库存的使用宽限期不能超过12个月。因此,如何研究解决乙草胺的残留及其对农田环境的污染问题已成为科学家们亟待解决的热点问题。
作为农药残留主要降解者的微生物,因其具有针对性强、周期短、见效快等特点,已逐渐成为生物修复农药污染土壤的热点。本研究从长期受乙草胺污染的大豆田土壤中应用富集培养分离技术筛选出1株能够以乙草胺为唯一碳源的降解菌株(WN-3),并对其进行了初步的菌属鉴定及降解特性的研究。以期为酰胺类除草剂的环境修复研究工作提供良好的微生物资源和理论实践依据。 1 材料与方法 1.1 实验材料 1.1.1 供试土壤
黑龙江省尚志市鱼池乡虎峰村长年(至少4年)施用乙草胺的大豆田土壤,取土表及土表下5~15 cm的耕层土壤,过40目筛备用。 1.1.2 培养基
基础无机盐培养基(MSM,g·L-1):MgSO4·7H2O 0.2,CaCl2·H2O 0.1,KH2PO4 0.5,K2HPO4 0.5,NaCl 0.2,葡萄糖5.0,pH值7.0。LB培养基(g·L-1):蛋白胨10.0,酵母粉5.0,NaCl 5.0,pH值7.0~7.2。 1.1.3 农药
乙草胺标准品(纯度为93%,德国Dr.ehrenstorfer),990 g·L-1乙草胺乳油(济南绿邦化工有限公司)。 1.1.4 主要试剂
二氯甲烷(分析纯);无水硫酸钠;乙腈(色谱纯)。 1.1.5 主要仪器
pH 计(Beckman,美国);低温冷冻离心机(BeckmanAllegra 21R,美国);紫外分光光度计(U2008,日本);PCR扩增仪(PTC-100,MJRearch,美国);高效液相色谱仪(Waters515,美国)。 1.2 乙草胺降解菌株的富集与分离纯化[7]
取10 g备用土壤放入装有100 mL无菌生理盐水和少许玻璃珠的250 mL三角瓶中,在恒温摇床中振荡约1 min,形成菌悬液。以10%的接种量接到100 mL无机盐培养基(含100 mg·L-1乙草胺)中,置30 ℃、150 r·min-1的恒温摇床中振荡培养7 d。每周移种1次,以10%的接种量接种到新鲜无机盐培养液中,乙草胺浓度以100 mg·L-1的梯度递增,至培养基中乙草胺浓度达到500 mg·L-1。将最终所得的降解菌溶液用无菌水稀释成106~109倍,取0.1 mL菌液涂布到牛肉膏蛋白胨培养基上,置于35 ℃恒温培养箱中培养1~2 d,挑取单菌落,在培养基上多次反复划线分离,纯化。经过筛选和纯化后,将分离的降解菌接种于LB斜面培养基上,置于4 ℃条件下冷藏保存备用。 1.3 乙草胺降解菌的鉴定[7] 1.3.1 降解菌的形态观察及生理生化鉴定
用平板涂布法将富集和纯化后的乙草胺降解菌接种,30 ℃培养12~16 h后用电子显微镜观察菌体形态。 1.3.2 降解菌的分子鉴定
用CTAB法提取降解菌总DNA,16S rDNA引物F27:5′-AGAGTTTGATCCTGGCTCAG-3′;R1541:5′-AAGGAGGTGATCCAGCCGCA-3′。
扩增反应体系为:10×Buffer(Mg2+) 5 μL,dNTPs(2 mmol·L-1) 3 μL,引物(20 μmol·L-1)各加1 μL,菌体DNA(约50 mg·L-1) 1 μL,Taq DNA聚合酶(5 U·μL-1)0.5 μL,加ddH2O至50 μL。PCR反应条件:95 ℃ 5 min,94 ℃ 30 s,52 ℃ 30 s,72 ℃ 90 s,30个循环,72 ℃ 10 min。扩增产物在4 ℃中保存。
上海生工公司将PCR 扩增产物进行测序,将测序结果进入GenBank 数据库进行相似性分析。并与GenBank 中的相近序列在Clustal W 程序包中进行多重序列匹配排列分析,最后形成一个多重序列匹配排列阵,用MEGA 5.0 程序包中的 Neighbor-Joining 法构建系统进化树,计算模型为 Kimura2-parameter,计算次数为1 000次。 1.4 降解菌对乙草胺的降解性能测定[7] 1.4.1 乙草胺的提取
将培养后的待测样品以10 000 r·min-1离心5 min后将上清液转移至250 mL分液漏斗中,分3次加入二氯甲烷(CH2Cl2) 20、10、10 mL,剧烈振荡1 min,室温下静置10 min,待有机相与水相分层,有机相过无水硫酸钠柱后40 ℃旋转蒸发至干,用乙腈定容至10 mL,摇匀待测。 1.4.2 液相色谱检测条件
色谱柱为C18反相柱(5 μm,4.6 mm×250 mm i.d.,Diamonsil,USA),乙草胺流动相为:乙腈∶水∶冰乙酸(60∶40∶0.1,V/V/V),柱温为30 ℃,检测波长230 nm,进样量1 μL,流速为1 mL·min-1。样品中乙草胺的含量采用外标法测定,计算降解率。
乙草胺降解率(%)=〔1-(实验样实测残留量/对照样实测残留量)〕×100% 1.4.3 菌株降解乙草胺的影响因素研究
将菌株在LB液体培养基(pH值7.0)、温度为35 ℃、转速为150 r·min-1的恒温摇床中振荡培养18~24 h(OD600=0.30)后,按5%的量接种至无机盐培养基中,初始pH值为7.0、初始乙草胺浓度为50 mg·L-1、温度为35 ℃、150 r·min-1摇床振荡培养,分别进行以下几组处理测定生长量和降解率的变化,设接种灭活的菌株为对照,每种因素3个实验重复,培养7 d后测定OD600值和乙草胺的残留量。
(1)设培养时间分别为1、2、3、4、5、6、7 d;
(2)设温度分别为20、25、30、35、40、45 ℃;
(3)用NaOH或HCl调节初始pH值分别至4、5、6、7、8、9;
(4)设接种量分别为1%、2%、5%、10%、15%、18%、20%;
(5)设乙草胺初始浓度分别为10、25、50、75、100、200、300、400 mg·L-1;
(6)将菌株的培养时间、温度、初始pH值、接种量、乙草胺初始浓度都设置为优化后的最佳条件,测定乙草胺的降解率。 2 结果与分析 2.1 降解菌株的分离和生理生化鉴定
从长期受乙草胺污染的土壤中通过富集培养法分离出1株能够降解乙草胺的菌株,将其命名为WN-3。其菌落较小,黄色,表面整齐,光滑,不透明,易挑取。延长培养时间菌落略变大,分泌黄色水溶性色素,色素扩散至培养基呈黄色。呈杆状,无荚膜、芽孢及鞭毛(图 1),好氧,不具有运动性,革兰氏阳性菌。接触酶试验、柠檬酸盐作用试验、硝酸盐还原试验、V.P试验、淀粉水解试验、吲哚试验、乙醇氧化试验、脓青素的产生试验均呈阳性。甲基红(M.R)试验、丙二酸利用试验、反硝化试验、苯丙氨基酸脱氨酶试验、脲酶试验均呈阴性。
|
| 图 1 菌株WN-3的电镜照片(×15 000) Figure 1 Electron microscopic photo of strain WN-3 (×15 000) |
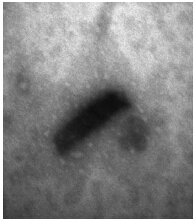
以细菌WN-3的基因组DNA为模板,用细菌16S rDNA通用引物进行PCR扩增,得到长度约为1.8 kb的扩增产物,测序后在GenBank 上登录,序列号为JN622012。将其与GenBank 上的其他序列用Blast 软件进行同源性比对,结果表明菌株WN-3与Burkholderia sp. B27(GQ169804.1)的16S rDNA 序列的同源性高达100%。将所得序列应用MEGA5.0软件采用近邻法构建系统发育树,如图 2所示。再结合形态学特征分析和生理生化反应特性的结果,将其初步鉴定为鼻疽菌属(Burkholderia sp.)。
|
| 图 2 菌株WN-3的系统发育树 Figure 2 The phylogenetic tree of strain WN-3 |
结果如图 3所示,在2~4 d内,菌WN-3大量生长,在第4 d达到最大值,OD600值为0.638,在4~6 d内,细菌数量基本稳定,在6~7 d内,细菌数量明显降低。在2~7 d之间,菌株的降解率随时间的延长而提高,其中2~4 d内,菌株的降解率大大提高,这和细菌数量的大量增多有一定关系。4~7 d内,降解率虽随时间的增加而提升,但幅度不大,趋于稳定。分析原因可能与降解菌自身的生理生化性质关系,降解菌在7 d后已经进入衰亡期,菌株几乎不再降解乙草胺。

|
| 图 3 培养时间对菌株WN-3生长和降解的影响 Figure 3 Effects of incubation time on the degradation rate of strains WN-3 |
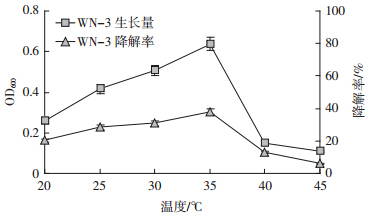
结果如图 4所示,菌株在20~45 ℃的温度范围内均可以生长。在20~35 ℃时,降解菌株WN-3的生长速度随温度升高而加快,最适生长温度为35 ℃,相同条件下培养相同的时间后生长量(OD600)达到最大,为0.638。温度与降解率基本上呈抛物线关系,在20~35 ℃的范围内降解率和温度呈正相关,降解率也在35 ℃时达到最高值,为37.7%。之后随着温度的进一步增加,降解率和生长量就急剧下降;在温度高于40 ℃的环境条件下生长量很小,与此同时降解率也逐步减小。
|
| 图 4 温度对菌株WN-3生长和降解的影响 Figure 4 Effects of different temperature on the degradation rate of strains WN-3 |
结果如图 5所示,菌株可以在较广泛的pH值范围内生活,在初始pH=4时的培养基环境中也具有良好的适应性,在pH值为6的偏酸性条件下菌体的生长情况最佳,OD600值达到最大为0.638,菌株的降解率也达到了最大,为37.89%。当pH值介于6.0~7.0时,菌体生长量逐步减少,降解率也渐渐下降,当pH值大于7.0时,菌株生长量和降解率急剧下降,分析原因可能是碱性条件会影响菌株细胞内酶的活性,细胞新陈代谢速度减慢,不利于菌株的生长和降解。
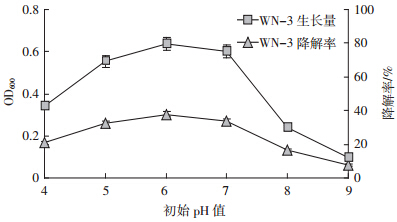
|
| 图 5 初始pH值对菌株WN-3生长和降解的影响 Figure 5 Effects of different initial pH on the degradation rate of strains WN-3 |
结果如图 6所示,降解菌株在接种量1%~10%的范围内随着接菌量的增加菌株的生长量和降解率也迅速增大,分析原因可能是在一定的范围内提高接菌量可以加快菌株细胞的新陈代谢速率,缩短延滞期。但是随着接菌量的继续增大,菌株的生长量反而下降,分析原因可能是由于接种量过大使营养物质消耗较快,代谢产物积累过多,培养基中的营养物质有限使后期菌体生长的营养匮乏,菌体之间发生竞争性抑制作用,抑制了菌株的生长,从而使生长量下降。
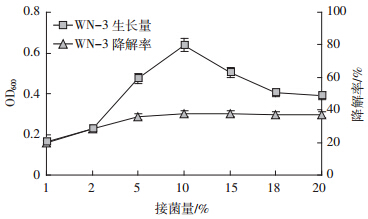
|
| 图 6 接种量对菌株WN-3生长和降解的影响 Figure 6 Effects of inoculum concentration on the degradation rate of strains WN-3 |
结果如图 7所示,降解菌株在10~50 mg·L-1的乙草胺浓度范围内随乙草胺浓度的增加,菌株大量生长繁殖,降解率也随之增大。分析原因可能是由于乙草胺水解的产物为其生长提供了良好的碳源。当乙草胺的浓度为50 mg·L-1时,菌株的生长量和降解率都达到了最高,降解率为37.89%;但当乙草胺浓度在50~200 mg·L-1时,菌株WN-3的生长量和降解率大幅度下降,推测可能是由于过浓的农药浓度对菌株产生了毒性,抑制了菌株的活性;也有可能当培养基中除草剂浓度过高时阻碍了菌体与氧气的接触,导致菌体不能良好的生长。当乙草胺浓度超过200 mg·L-1时,菌株的生长量趋于0,对乙草胺几乎无降解作用,分析原因可能是由于乙草胺作为一种土壤污染物,其对土壤微生物具有一定毒性,微生物须把乙草胺分子中的氯脱掉后才能利用其作为碳源和氮源,因而高浓度的乙草胺施入后会引起微生物活性的迅速下降进而影响对乙草胺的降解。由此可见,菌株WN-3的最佳降解乙草胺浓度为50 mg·L-1。
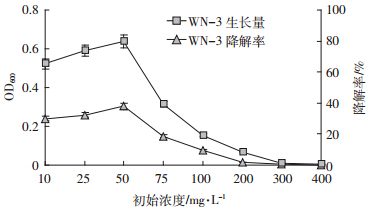
|
| 图 7 乙草胺初始浓度对菌株WN-3生长和降解的影响 Figure 7 Effects of acetochlor concentration on the degradation rate of strains WN-3 |
菌株WN-3在最佳生长条件(温度35 ℃,pH=6.0,接菌量10%,乙草胺浓度50 mg·L-1)下降解7 d后的降解率为38.3%,其色谱图如图 8所示。
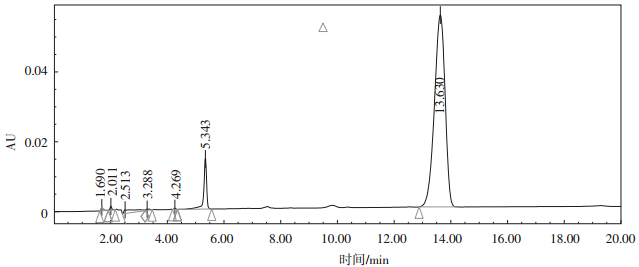
|
| 图 8 WN-3的色谱图 Figure 8 The chronmatogram of WN-3 |
目前,除草剂污染是影响我国范围最大的有机污染之一,严重影响土壤的可持续利用和人类的健康生活。乙草胺作为一种重要的选择性芽前土壤处理除草剂,在东北地区大面积使用,田地中普遍残留一定量的乙草胺,土壤里的微生物长期受到一定程度的乙草胺驯化。乙草胺降解菌的分离及降解特性的研究,不仅为利用生物手段修复乙草胺污染土壤的研究提供了理论基础,同时也为生产实践中的应用提供了技术支撑。因此,实验室通过进一步的驯化和富集培养,容易分离得到对乙草胺有较好降解效果的细菌。本实验从长期受农药乙草胺污染的土壤中分离出1株降解菌WN-3,将其鉴定为鼻疽菌属(Burkholderia sp.),该菌属还尚未发现能够降解乙草胺的菌株,因此WN-3的筛选及鉴定,具有重大的理论和现实意义,为后续的研究工作奠定了一定的基础,丰富了降解乙草胺的种质资源。
本研究还针对培养时间、接种量、乙草胺初始浓度、温度、初始pH值这5个影响因素对降解菌株的降解性能进行了研究。结果表明降解菌WN-3在温度35 ℃、pH 6.0、接种量为10%、乙草胺浓度为50 mg·L-1的无机盐培养基中培养7 d的条件下生长和降解情况最好,对乙草胺的降解率达38.3%。
目前,国内已报道的能够降解农药乙草胺的微生物主要分布在以下几个菌属:假单胞菌属(Pseudomo-nas)[8, 9],无色杆菌属(Achromobacter)、芽孢杆菌属(Ba-cillus)、微杆菌属(Microbacterium)、Parapusillimonas、短杆菌属(Brevibacterium)、苯基杆菌属(Phenylobacterium)[9],嗜麦芽寡养单胞菌属(Stenotrophomonas)[9, 10, 11, 12],鞘氨醇单胞菌属(Sphingomonas)[13],申氏杆菌(Shinella)[14],剑菌属(Ensifer)[15],红球菌属(Rhodococcus)[16]和副球菌属(Paracoccus)[17]。国外对乙草胺降解微生物的研究报道则相对较少。上述菌属的研究虽然进行了分离鉴定,但大部分未对菌株的生长条件及降解特性进行具体、深入的研究。
环境污染治理是一项长期而艰巨的任务,应严格防止各种不同形式农药污染给环境及人类生活带来的危害和灾难,如何利用现代生物技术同时兼顾效率和成本对已造成的污染进行治理,是一个热点和难点,需要更多的科学工作者进行研究与探讨。 4 结论
(1)从长期受农药乙草胺污染的土壤中分离出1株降解菌WN-3,根据菌株的形态学特征的观察结果和生理生化特性结果以及16S rDNA序列的分析,初步将其鉴定为鼻疽菌属(Burkholderia sp.)。
(2)降解菌WN-3的最佳生长和降解条件为温度35 ℃、pH 6.0、接种量为10%,乙草胺浓度为50 mg·L-1的无机盐培养基中培养7 d后对乙草胺的降解率为38.3%。
(3)笔者首次发现鼻疽菌属菌株,并研究其生长和降解乙草胺的特性,为利用鼻疽菌属菌株降解乙草胺,进行原位生物修复提供理论依据。
| [1] | 张一宾. 酰胺类除草剂的全球市场、品种及发展趋向[J]. 现代农药, 2011(1): 41-43. ZHANG Yi-bin. Market and products and development trend of amide herbicides[J]. Modern Agrochem, 2011(1): 41-43.(in Chinese) |
| [2] | Foley M E, Sigler V, Gruden C L. A multiphasic characterization of the impact of the herbicide acetochlor on freshwater bacterial communities[J]. International Society for Microbial Ecology, 2008, 2(1): 56-66. |
| [3] | 李 涛, 陈 雯, 章 芸, 等. 乙草胺对农田土壤动物群落结构的影响[J]. 安徽农业科学, 2009(20): 9502-9505. LI Tao, CHEN Wen, ZHANG Yun, et al. Effects of acetochlor on community structure of soil animals in farmland soil[J]. Journal of Anhui Agri Sci, 2009(20): 9502-9505.(in Chinese) |
| [4] | SU Zhen-cheng, ZHANG Hui-wen, LI Xin-yu, et al. Toxic effects of acetochlor, methamidophos and their combinationon nifH gene in soil[J].Journal of Environmental Sciences (China), 2007, 19(7): 864-873. |
| [5] | XIAO Neng-wen, JING Bo-bin, GE Feng, et al. The fate of herbicide acetochlor and its toxicity to Eisenia fetida under laboratory conditions[J]. Chemosphere, 2006, 62(8): 1366-1373. |
| [6] | U. S. Environment Protection Agency. Question and answers. Conditional registration of acetochlor[R]. Washington, D C: U. S. EPA, 1994: 18. |
| [7] | 刘 艳, 范丽薇, 王晓萍. 氯嘧磺隆降解菌L-6的分离鉴定及其降解特性[J]. 中国农学通报, 2010, 26(19): 339-343. LIU Yan, FAN Li-wei, WANG Xiao-ping. Isolation identification and degradation characteristics of chlorimuron-ethyl degradation bacteria L-6[J]. Chinese Agricultural Science Bulletin, 2010, 26(19): 339-343.(in Chinese) |
| [8] | XU Jun, QIU Xinghui, CAO Hong, et al. Isolation and characterization of a Pseudomonas oleovorans degrading the chloroacetanilide herbicide acetochlor[J]. Biodegradtion, 2006, 17(3): 219-225. |
| [9] | 周建娇, 邹 芳, 杨 汉, 等. 乙草胺降解菌筛选及其初步鉴定[J]. 中国土壤与肥料, 2013(6): 93-96. ZHOU Jian-jiao, ZOU Fang, YANG Han, et al. Screen for acetochlor degrading bacteria and identification[J]. Soils and Fertilizers Sciences in China, 2013(6): 93-96.(in Chinese) |
| [10] | ZENG W A, ZHAO S Y, LI H, et al. Isolation and screening of acetochlor-degrading strain and its degradation characteristics[J]. Appl Mecha Mater, 2011, 79: 318-323. |
| [11] | 赵 野, 邓新平, 胡国胜. 土壤中乙草胺降解菌的培养和筛选[C]//. 统筹城乡发展与植保科技进步, 2013: 182-187. ZHAO Ye, DENG Xin-ping, HU Guo-sheng. Culture and filtration of microbe assimilating acetochlor in soil[C]//. Balance Urban and Rural Development and Plant Protection Science and Technology Progress, 2013: 182-187.(in Chinese) |
| [12] | 金 雷, 郭远明, 陈雪昌, 等. 一株乙草胺降解菌株M-3的分离鉴定及其代谢途径的初步研究[J]. 农业生物技术学报, 2013(7): 863-869. JIN Lei, GUO Yuan-ming, CHEN Xue-chang, et al. Identification of an acetochlor-degrading strain M-3 and the preliminary metabolic pathway[J]. Journal of Agricultural Biotechnology, 2013(7): 863-869.(in Chinese) |
| [13] | 陈 青, 姚 利, 王成红, 等. 乙草胺降解菌Sphingomonas sp. DC-6的分离鉴定及其代谢途径的初步研究[J]. 中国农业科技导报, 2013(5): 67-74. CHEN Qing, YAO Li, WANG Cheng-hong, et al. Isolation and characterization of acetochlor-degrading strain Sphingomonas sp. DC-6 and preliminary studies on its metabolic pathway[J]. Journal of Agricultural Science and Technology, 2013(5): 67-74.(in Chinese) |
| [14] | 倪 俊, 沈维亮, 闫 新, 等. 乙草胺降解菌Y-4的分离鉴定及降解特性研究[J]. 农业环境科学学报, 2011(5): 946-951. NI Jun, SHEN Wei-liang, YAN Xin, et al. Isolation and characterization of a acetochlor-degrading strain Y-4 and its degrading characteristics[J]. Journal of Agro-Environment Science, 2011(5): 946-951.(in Chinese) |
| [15] | 董 滨, 王凤花, 林爱军, 等. 乙草胺降解菌A-3 的筛选及其降解特性[J]. 环境科学, 2011, 32(2): 542-547. DONG Bin, WANG Feng-hua, LIN Ai-jun, et al. Isolation and degradation characteristics of acetochlor-degrading strain A-3[J]. Environmental Science, 2011, 32(2): 542-547.(in Chinese) |
| [16] | 侯 颖, 王 飞, 董维亮, 等. Rhodococcus sp. T3-1菌株降解乙草胺的特性[J]. 中国环境科学, 2013(10): 1785-1790. HOU Ying, WANG Fei, DONG Wei-liang, et al. Degradation characteristics of an acetochlor-degrading bacterium Rhodococcus sp. T3-1[J]. China Environmental Science, 2013(10): 1785-1790.(in Chinese) |
| [17] | ZHANG Jun, ZHENG Jin-Wei, LIANG Bin, et al. Biodegradation of chloroacetamide herbicides by Paracoccus sp. FLY-8in vitro[J]. Journal of Agricultural and Food Chemistry, 2011, 59(9): 4614-4621. |
 2015, Vol. 32
2015, Vol. 32