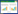文章信息
- 尚艺婕, 王海波, 史静
- SHANG Yi-jie, WANG Hai-bo, SHI Jing
- 外加镉处理下秸秆生物质炭对土壤酶活性的影响
- Effects of Straw Biomass Charcoal on Enzyme Activity in Cd Contaminated Soil
- 农业资源与环境学报, 2015, 32(1): 20-25
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0266
-
文章历史
- 收稿日期:2014-10-10
土壤酶的主要成分是蛋白质,是一种由生物细胞 产生的生物催化剂。土壤中的各种生化反应都是在相 应的酶参与下完成的,土壤中的酶活性决定了土壤中 进行的各种生物化学过程的强度和方向,酶的活性是 土壤的本质属性之一[1]。土壤酶活性受重金属元素的 污染的影响较为显著,其强弱与重金属的污染程度存 在着某种相关性,而土壤重金属污染中的Cd 污染具 有移动性强、生物毒性大等特点,容易通过食物链最 终进入人及其他生物体内,对人及其他生物的健康产生巨大的危害,因而土壤的Cd 污染问题受到全社会 的普遍关注。由于生物质炭的多孔及比表面积较高的 物理性质,其在Cd 污染土壤修复领域展示出极大的 应用潜力[2],并且大量的实验研究已表明生物质炭输 入可有效降低土壤重金属有效态含量。Novak 等[3]研 究发现向酸性土壤施入2%的生物炭,可有效降低土 壤中重金属的含量,并认为是生物质炭导致土壤pH 值升高所致;Neill 等[4]研究表明,生物质炭的施入可 以改善土壤结构,同时还可以增加土壤的基础呼吸及 呼吸速率,因而对污染土壤具有修复作用;Beesley[5]在 土壤中施入生物质炭后,Cd 浓度下降了10 倍,植物 毒害也降低显著。但是国内对生物质炭的施用对Cd 污染土壤中各类酶活性的研究较少,且生物质炭对 Cd 污染土壤的具体作用影响机制尚不明确,本文就 该方面对经生物质炭钝化后的Cd 污染土壤酶活性 变化进行分析与研究,以期为生物质炭对Cd 污染土 壤的修复从酶活性改善的角度提供科学依据。 1 材料与方法 1.1 试验设计
选取云南农业大学后山红壤作为试验供试土壤, 将CdCl2·2.5H2O 与去离子水配成母液,稀释成处理 浓度(5 mg·kg-1)后与土壤反复混合均匀,同时设置 Cd空白的对照。选取秸秆生物炭按添加量(0、2.5%、 5%的质量比)进行原状土添加,即得到6 种不同处理 的土样:(1)Cd含量0 mg·kg-1,生物质炭0%(Cd0C0); (2)Cd 含量0 mg·kg-1,生物质炭2.5%(Cd0C2.5);(3) Cd 含量0 mg·kg-1,生物质炭5%(Cd0C5);(4)Cd 含 量5 mg·kg-1,生物质炭0%(Cd5C0);(5)Cd 含量5 mg·kg-1,生物质炭2.5%(Cd5C2.5);(6)Cd 含量5 mg· kg-1,生物质炭5%(Cd5C5)。经处理的土壤样品分装 后置于玻璃温室中,在自然状态下进行老化处理60 d,保持土壤水分在田间水量的70%[6]。后对以上处理 过的6 种样品分别测定土壤中的FDA 水解酶、纤维 素酶、蛋白酶、脲酶、蔗糖酶、磷酸酶及过氧化氢酶的 活性。表 1为试验用生物炭的基本性质。
对FDA 水解酶(又名荧光素二乙酸酯酶)以无色的荧光素二乙酸为基质,采用比色法来测定其活性; 纤维素酶采用3,5-二硝基水杨酸比色法测定纤维素 酶解所产生的还原糖量来表示其活性;蛋白酶酶活的 测定采用茚三酮比色法,以24 h后1 g土壤中的氨基 氮的毫克数表示;脲酶的酶活采用苯酚钠-次氯酸钠 比色法,以尿素为基质,测定其活性;蔗糖酶酶活采用 二硝基水杨酸比色法测定,以24 h后1 g土壤中的葡 萄糖毫克数来表示;磷酸酶酶活的测定采用磷酸苯二 钠比色法来测定,以磷酸苯二钠为基质,在磷酸酶的 作用下,水解基质所生成的苯酚的量来表示;过氧化 氢酶酶活采用紫外分光光度法测定,以每20 min 内 每克土壤分解的过氧化氢的毫克数来表示[7, 8, 9, 10, 11]。为消 除土壤中原有物质对实验结果造成的误差,以上每种 土样的酶活测定均需要设置无基质对照,整个实验需 做无土对照,为使实验结果精准可靠,每种土样的酶 活测定也需做平行对照。 1.3 酶活性综合值的计算
根据前人研究结果及各种酶的具体作用及性质,
将所选取的土壤酶分为两大类,第一类为对土壤碳循
环变化响应较为明显的酶类,包括:FDA 水解酶、纤维
素酶、蛋白酶;第二类为对Cd 活性变化响应较为敏感
的酶类,这类酶也被称之为土壤氧化还原酶,其中包
括脲酶、蔗糖酶、磷酸酶及过氧化氢酶[12, 13, 14]。对这两大
类型的酶活性分别求取几何平均数,作为衡量土壤中
碳循环相关酶及氧化还原酶活性的指标,其中土壤碳
循环酶的公式为[15]:GMea1= ;土壤氧
化还原酶活性公式为:GMea2=
;土壤氧
化还原酶活性公式为:GMea2=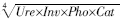 ;最
后,对不同处理下的土样的各种酶活性求几何平均
数,作为衡量土壤质量的综合酶活性指标,公式为:
GMea=
;最
后,对不同处理下的土样的各种酶活性求几何平均
数,作为衡量土壤质量的综合酶活性指标,公式为:
GMea=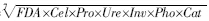 。式中,FDA
代表FDA水解酶活性;Cel代表纤维素酶活性;Pro代
表蛋白酶活性;Ure代表脲酶活性;Inv代表蔗糖酶的
活性;Pho代表磷酸酶的活性;Cat代表过氧化氢酶的
活性。
1.4 数据处理
。式中,FDA
代表FDA水解酶活性;Cel代表纤维素酶活性;Pro代
表蛋白酶活性;Ure代表脲酶活性;Inv代表蔗糖酶的
活性;Pho代表磷酸酶的活性;Cat代表过氧化氢酶的
活性。
1.4 数据处理
文中分析数据采用Excel(2007)统计软件及SPSS 软件进行分析处理。 2 结果与分析 2.1 外加镉处理下生物质炭输入对土壤碳循环酶活性的影响
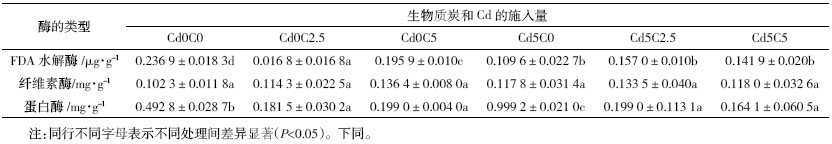
经测定,不同生物质炭量的输入对Cd 污染土壤碳循环相关的酶活性产生了显著影响。由表 2可以看 出,当试验土壤不加外源Cd 时,不同生物炭量的施 入对FDA 水解酶活性有着显著的影响,并且当生物 质炭的含量为2.5%时,该酶活降至最低值,为0.016 8 μg·g-1,比不添加生物质炭时的0.236 9 μg·g-1降低了 92.91%,当生物质炭的施入量为5%时,FDA 水解酶 的活性有所提高,为0.195 9 μg·g-1;而当Cd 的加入 量为5 μg·kg-1时,不同量的生物质炭的施入对FDA 水解酶活性的影响趋于平稳,酶活性之间的差异不明 显,最低值为不添加生物质炭,为0.109 6 μg·g-1,最高 值为生物质炭施入量2.5%时的0.157 μg·g-1,变化量 为29.94%。
纤维素酶的酶活在不同量的生物炭作用下大体 变化不是很显著。当不加Cd 时,纤维素酶的酶活性 随着生物质炭量的增加呈现出较为显著的递增关系, 从不添加生物质炭的0.102 3 mg·g-1增加到生物质炭 含量2.5%时的0.114 3mg·g-1再到生物质炭含量为5% 时的0.136 4 mg·g-1,分别增加了10.50%和16.42%;而 当Cd的加入量为5 mg·kg-1时,这种递增关系打乱,当 生物质炭的含量为2.5%时,纤维素酶的酶活性最高 为0.133 5 mg·g-1,比生物质炭含量为0 和5%时的 0.117 8 mg·g-1 和0.118 0 mg·g-1分别高出11.76%和 11.61%,由此可见当生物质炭的施入量为2.5%时,纤 维素酶在不同Cd污染程度下的活性变化相对显著。
蛋白酶的酶活性随着不同生物质炭量的加入变 化相当明显,由表 2 的数值可以明显看出,当土壤中 不加Cd 时,蛋白酶的活性从不加生物质炭的0.492 8 mg·g-1下降到生物质炭含量为2.5%时的0.181 5 mg· g-1,下降63.17%而后趋于平稳;而当Cd 的含量为5 mg·kg-1时,土壤蛋白酶的活性随着生物质炭量的增 加也是先显著降低然后趋于平稳,只是酶活的整体活 性水平有所提高,最高为不添加生物质炭时的0.999 2 mg·g-1,当土壤中生物质炭的含量为2.5%时,蛋白酶 的活性下降为0.199 0 mg·g-1,下降80.08%后趋于稳 定;当不加生物质炭时,蛋白酶的活性由不受Cd 污 染时的0.492 8 mg·g-1上升到Cd 含量为5 mg·kg-1 的 0.999 mg·g-1,上升50.65%。由此可见生物质炭含量 2.5%时,蛋白酶的变化梯度相对较为明显。
 |
测定表明,受Cd 污染土壤的脲酶活性在加入生 物炭后活性整体降低。由表 3 的数值易于看出当土壤 中不加Cd 时,随着生物质炭量的增加,脲酶的酶活性 改变不甚明显,而当Cd 含量为5 mg·kg-1 时,随着生 物质炭量的增加,该酶的活性亦是相对平稳,只是Cd 含量为5 mg·kg-1 时,脲酶活性的平均水平为0.084 9 mg·g-1,比不加Cd 时的0.116 6 mg·g-1低23.33%。可 见土壤受Cd 污染后对土壤脲酶活性具有抑制作用。
 |
随着土壤受Cd 污染的不同程度及生物质炭量 的施入,蔗糖酶活性变化显著。当土壤中Cd 的含量 为5 mg·kg-1时及土壤中不含Cd 时,随着生物质炭的 施入,蔗糖酶活性均呈现先高后低的趋势,最高均为 生物质炭的含量为2.5%时,土壤中不含Cd 时,蔗糖 酶活为0.075 2 mg·mL-1 ,土壤中Cd 的含量为5 mg· kg-1 时,蔗糖酶活为0.065 6 mg·mL-1 ,计算可得,这2类的酶活相差0.009 6 mg·mL-1 ,下降12.76%。当不加 生物质炭时,蔗糖酶的活性变化量相对较小,为 6.97%,当生物质炭的施入量为5%时,蔗糖酶活性变 化33.33%。
磷酸酶活性对土壤Cd 污染表现出极强的相关 性,由表 3 的数据可以分析得出当土壤中不加入Cd 时,随着生物质炭的施入,磷酸酶活性先高后低,此 时,该酶活性的平均值为0.063 1 μg·g-1,而当Cd 含 量为5 mg·kg-1时,土壤磷酸酶活性急剧下降,平均值 只有0.013 0 μg·g-1,与不受Cd 污染的土壤相比,下 降了79.40%,变化梯度显著,可见磷酸酶对Cd 污染 土壤的响应异常敏感。而当不加生物质炭时,土壤中 不加Cd 时磷酸酶的活性比Cd 含量为5 μg·g-1时下 降了68.75%,而当生物质炭的施入量为2.5%、5%时, 不同Cd 污染土壤磷酸酶的活性变化率分别为 79.73%和85.07%,变化幅度显著。
当土壤中不受Cd 污染时,随着生物质炭的施入 量的增加,过氧化氢酶的活性先是略微下降后上升; 当Cd的含量为5 mg·kg-1时,随着生物质炭的施入量 的增加,该酶酶活先升后降,最高为生物质炭的含量 为2.5%时的3.317 mL·g-1,比不加生物质炭时的 2.436 8 mL·g-1 及施加5%的生物质炭量的2.623 8 mL·g-1分布高出26.53%和20.89%。 2.3 外加镉处理下生物炭输入对土壤综合酶活性的影响
2.3.1 不同处理下土壤碳循环酶的综合酶活性比较
对不同处理下的土壤碳循环相关的酶活性求几 何平均数(Geometric mean),作为衡量土壤碳循环酶 的综合指标,其计算结果如图 1 所示。从图 1 中可看 出不同处理下的土壤碳循环相关酶活性变化,在土壤 不受Cd 污染的情况下,土壤碳循环的酶活综合指数 值最高为生物质炭用量为2.5%时,其值为0.235,而当生物质炭的施入量为5%时,酶活性下降显著,为 0.707,下降了69.92%;当土壤Cd 含量为5 mg·kg-1 时,土壤碳循环酶活性综合指数值最高亦为生物质炭 的施入量为2.5%时的0.174,比不加生物质炭时的 0.161 及生物质炭用量为5%时的0.140 分别高出 7.4%、19.5%。
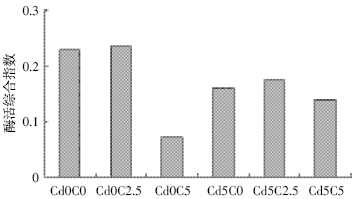
|
| 图 1 不同处理下土壤碳循环酶的综合活性分布 Figure 1 Soil carbon cycle enzymes activity distribution under different treatments |
对不同处理下的土壤氧化还原酶活性求几何平 均数,作为衡量土壤中氧化还原酶酶活性综合值的指 标,其计算结果如图 2所示。从图 2 可看出在土壤不 含Cd 时及Cd 的加入量为5 mg·kg-1 时,土壤氧化还 原酶的综合活性均是先升后降。当不加Cd 时,生物 质炭含量为2.5%时,土壤氧化还原酶的活性最高,其 值为0.202,比不加生物质炭时的0.157 及生物质炭 用量为5%时的0.194 分别高出22.52%、3.8%;当土 壤Cd 含量为5 mg·kg-1时,氧化还原酶综合活性指数 最高亦为生物质炭的施入量为2.5%时,其值为0.131, 比不加生物质炭时的0.107 及生物质炭用量为5%时 的0.093 分别高出18.50%、28.90%。

|
| 图 2 不同处理下土壤氧化还原酶的综合活性分布 Figure 2 Soil REDOX enzymes activity distribution under different treatments |
对不同处理下的土壤中各种酶活性求几何平均 数,作为衡量土壤质量的综合酶活性指标,其计算结 果如图 3 所示。无论土壤受Cd 污染与否,土壤各种 酶的综合活性指数最高值均为生物质炭的含量为 2.5%。当土壤不加Cd时,生物质炭含量2.5%时的综 合酶活性指数为0.215,比不加生物质炭时的0.184 及生物质炭用量为5%时的0.090 分别高出14.42% 及58.14%;当土壤Cd 添加量为5 mg·kg-1时,生物质 炭含量2.5%时的综合酶活性指数为0.108,比不加生 物质炭时的0.091 及生物质炭用量为5%时的0.077 分别高出16.26%及28.57%。
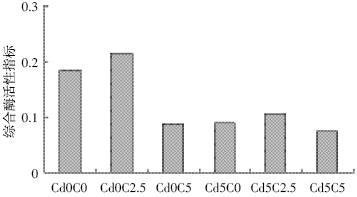
|
| 图 3 不同处理下两类土壤酶的综合活性分布 Figure 3 Integrated active distribution of two classes of soil enzymes under different treatments |
重金属对土壤酶活性的影响受多种因素的制约, 比较常见的有土壤类型、重金属种类、重金属的浓度 以及土壤酶的种类,由以上的数据分析结果可以得 知,当土壤受Cd 的污染程度一致时,不同类别的酶 随着生物质炭的不同量的添加,其活性有着不同的变 化趋势。这可能是由于生物质炭的强吸附作用,使得 生物质炭对土壤酶活性的影响较为复杂,一方面,生 物质炭对反应底物的吸附有助于酶促反应的进行而 提高土壤团聚体的酶活性,另一方面,生物质炭对酶 分子的吸附对酶促反应结合位点形成保护,而阻止酶 促反应的进行[16],这就使生物质炭对不同的酶活性所 产生的影响不尽相同。Beesley[5]通过向高Cd、高Cu 含 量的土壤中添加生物质炭60 d后,土壤毛细管水中 这2种重金属的浓度显著降低,从而使其对土壤酶的 抑制作用也有所下降。本文研究表明,外源有机物料 中生物质炭向土壤中的施入对Cd 污染土壤的酶活 产生一定影响,其中对其响应最为敏感的酶为FDA 水解酶。当生物质炭施入量为2.5%时,FDA水解酶酶 活从不加Cd 的0.016 8 μg·g-1上升到0.157 μg·g-1,上 升89.17%,这大致是因为土壤中的荧光素二乙酸酯 (FDA)通常能被许多酶如酯酶、蛋白酶、脂肪酶等所 水解而致[17]。
土壤中Cd元素的加入对土壤酶活存在着显著的 影响,其中以脲酶、磷酸酶等氧化还原酶类的反应最 为敏感,蔗糖酶次之,且其影响以抑制作用为主。对其 可能的抑制机理分析有:重金属直接作用于酶分子, 使酶的构象发生改变,从而影响酶的活性;重金属抑 制土壤微生物的生长繁殖,从而使微生物体内酶的合 成和分泌量减少,进而影响酶的活性;重金属影响到 作物的代谢活力,使根分泌、释放酶的能力受影响[17]。 脲酶是一种对尿素专性较强的酶,它能酶促尿素水解 成氨、二氧化碳和水,其活性反应土壤无机氮的供应 能力;磷酸酶是一种水解酶,能加速有机磷的脱磷速 度,提高土壤磷素有效性,其活性是评价土壤磷素生 物转化方向与强度的指标[18, 19]。从本文的实验结果可 以证明,通常采用脲酶的活性变化作为评价土壤是否 受Cd 污染是合理的,但是,在土壤中Cd 的含量为5 mg·kg-1时,磷酸酶的变化幅度较脲酶更为明显。
由于生物质炭独特的理化性质使得其向土壤中 的施入可以加速土壤中生物化学反应的活跃程度、土 壤微生物的活性以及养分物质的循环状况[20],进而改 变土壤酶的活性。Steiner 等[21]发现通常土壤中生物质 炭的施入量为5%~10%时,土壤呼吸及土壤微生物量 与生物质炭量呈线性关系,而本文通过实验证明,当 生物质炭的施入量为土壤质量比的2.5%时,对Cd 污 染土壤各类酶综合指数的影响均较明显,这可能是正 常土壤与外加Cd处理下的土壤区别所致。牛文静等[8] 研究表明,外源有机物料的施入显著提高了土壤中 200~2 000 μm 和<2 μm 两粒组中酶活性的综合指 数,可见土壤酶活性综合指数可以较好反映土壤生物 学性状,是指示土壤生物质量的综合评价指标[10]。本 实验研究证明外加Cd 处理下,2.5%的生物质炭施入 量提高了土壤酶活性综合指数,比其他2 种处理分别 提高了16.26%、28.57%。可见该用量的生物质炭对Cd 污染土壤酶活性的恢复具有更加深入的研究意义。 4 结论
(1)生物质炭对Cd 污染土壤的酶活会产生一定 的恢复效应,其中对其响应较为敏感的有FDA 水解 酶及蛋白酶;土壤中外源镉的添加对土壤酶活存在着 显著抑制作用,其中以脲酶、磷酸酶等氧化还原酶类 的反应最为敏感。
(2)土壤中Cd 的含量为5 mg·kg-1 时,在外源生 物质炭输入下,磷酸酶的变化幅度比其他氧化还原酶 均要高。证明在此情况下磷酸酶对土壤重金属的污染 的响应比普遍认为的脲酶更加敏感。
(3)本实验条件下土壤中的碳循环酶、氧化还原 酶及土壤质量的综合酶活性指标最高均为生物质炭 用量为2.5%,这表明此用量的生物质炭施入可对镉 污染土壤的酶活性起到最好的恢复作用。
| [1] | 陈怀满.环境土壤学[M].北京:科学出版社, 2011.CHENHuai-man. Environmental soil science[M]. Beijing:SciencePress, 2011.(in Chinese) |
| [2] | 朱庆祥. 生物炭对Pb、Cd 污染土壤的修复试验研究[D]. 重庆: 重庆 大学, 2011:546-589. ZHUQing-xiang. Biochar on theexperimental study ofPb, Cd contami-nated soil restoration[D]. Chongqing:Chongqing University, 2011:546-589.(in Chinese) |
| [3] | Novak JM, BusscherWJ, Laird DL, et al. Impact of biochar amendment on fertility ofa southeastern coastal plain soil[J]. Soil Science, 2009, 174:105-112. |
| [4] | ONeill B, Grossman J, Tsai MT, et al. Bacterial community composition in Brazilian anthrosols and adjacent soils characterized using culturing and molecular identification[J]. Microbial Ecology, 2009, 58(1):23-25. |
| [5] | LukeBeesley, Eduardo Moreno-Jimenez, JoseL Gomez-Eyles, et al. Ef-fects of biochar and green waste compost amendments on mobility, bioavailability and toxicity of inorganic and organic contaminants in a mul-ti-element polluted soil[J]. Environmental Pollution, 2010, 158:2282-2287. |
| [6] | Chan KY, Van Zwieten VL, Meszaros I, et al. Agronomic value of greenwaste biochar as a soil amendment[J]. Soil Research, 2007, 45(8):629-634. |
| [7] | 刘姣, 曹靖, 南忠仁,等.白银市郊区重金属复合污染对土壤酶 活性的影响[J].兰州大学学报(自然科学版), 2010, 46(5):38-42. LIUJiao, CAOJing, NANZhong-ren, et al. The compound pollution of heavy metals on soil enzymeactivity influence in Baiyin suburb[J]. Jour-nal ofLanzhouUniversity(Natural ScienceEdition), 2010, 46(5):38-42.(in Chinese) |
| [8] | 牛文静, 李恋卿,潘根兴,等.太湖地区水稻不同粒级团聚体中酶活 性对长期施肥的响应[J]. 应用生态学报, 2009, 20(9):2181-2186. NIUWen-jing, LILian-qing, PANGen-xing, et al. TheTaihuLake re-gion of riceenzymeactivity in different graded aggregate response to long-termfertilization[J]. Journal ofApplied Ecology, 2009, 20(9):2181-2186.(in Chinese) |
| [9] | 罗泽娇,张随成. 简易气量法测试土壤过氧化氢酶活性的研究[J].地 质科技情报, 2005, 24(4):87-90. LUOZe-jiao, ZHANGSui-cheng. Simple gas method study to test the soil catalaseactivity[J]. Journal ofGeological Scienceand Technology Information, 2005, 24(4):87-90.(in Chinese) |
| [10] | 崔娜, 张玉龙, 曲波, 等. 保水剂对苗期番茄根际土壤微生物 数量及土壤酶活性的影响[J]. 北方园艺, 2010(23):24-26. CUINa, ZHANGYu-long, QUBo, et al. Super absorbent polymers in seedling stage tomato rhizosphere soil microorganism quantity and soil enzymeactivity[J]. North Gardening, 2010(23):24-26.(in Chinese) |
| [11] | 郭文娟, 梁学峰, 林大松, 等. 土壤重金属钝化修复剂生物炭对镉 的吸附特性研究[J].环境科学, 2013, 34(9):3716-3721. GUOWen-juan, LIANGXue-feng, LINDa-song, et al. The study of passivation biochar repair agent on the soil heavy metal cadmium ad-sorption characteristics[J]. Journal ofEnvironmental Science, 2013, 34 (9):3716-3721.(in Chinese) |
| [12] | 陈晓博.生物炭环境效应和在农业面源污染防治中的应用[J]. 北方 环境, 2013(6):65-68. CHENXiao-bo. Biochar environmental effect and application in the prevention and control ofagricultural non-point source pollution[J]. Journal ofNorthern Environments, 2013(6):65-68.(in Chinese) |
| [13] | 徐楠楠, 林大松,徐应明,等.生物炭在土壤改良和重金属污染治理 中的应用[J]. 农业环境与发展, 2013, 30(4):29-34. XUNan-nan, LINDa-song, XUYing-ming, et al. Theapplication of biochar in soil improvement and heavy metal pollution[J]. Journal ofA-gricultural Environment and Development,2013,30(4):29-34.(inChinese) |
| [14] | 周玮,周运超,鲁秦安.不同土地利用方式下石灰土土壤团聚体 与土壤酶活性的关系[J].水土保持通报, 2011, 31(5):59-65. ZHOUWei, ZHOUYun-chao, LUQin-an. The calcareous soil under different land utilization way soil aggregateand the relationship between soil enzymeactivity[J]. Journal ofSoil and Water Conservation, 2011, 31(5):59-65.(in Chinese) |
| [15] | Ruiz RG, O choaV, H inojosaMB, et al. Suitability ofenzymeactivi-ties for the monitoring of soil quality improvement in organic agricul-tural systems[J]. Soil Biology and Biochemistry, 2008, 40:2137-2145. |
| [16] | 黄剑.生物质炭对土壤微生物量及土壤酶的影响研究[D].北京:中 国农业科学院, 2013:309-324. HUANGJian. The research of soil microbial biomass carbon and soil enzyme[D]. Beijing:ChineseAcademy ofAgricultural Sciences, 2013:309-324.(in Chinese) |
| [17] | 黄占斌, 张彤, 彭丽成, 等. 重金属Pb、Cd 污染对土壤酶活性的 影响[C].中国环境科学学会学术年会论文集, 2010:3824-3828. HUANGZhan-bin, ZHANGTong, PENGLi-cheng, et al. Heavy met-als ofPb and Cd pollution on soil enzymeactivity[C]. ChinaEnviron-mental ScienceSociety, Academic Essays, 2010:3824-3828.(in Chinese) |
| [18] | Solaiman ZM, Blackwell P, Abbott LK, et al. Direct and residual effect of biochar application on mycorrhizal root colonisation, growth and nu-trition of wheat[J]. Soil Research, 2010, 48:546-554. |
| [19] | Taketani RG, Tsai SM. The influence of different land uses on the structure ofarchaeal communities in Amazonian anthrosols based on 16S rRNAand amoA genes[J]. Microbial Ecology, 2010, 59:734-743. |
| [20] | 周桂玉,窦森,刘世杰.生物质炭结构性质及其对土壤有效养分 和腐殖质组成的影响[J]. 农业环境科学学报, 2011, 30(10):2075-2080. ZHOUGui-yu, DOUSen, LIUShi-jie, et al. Biomass carbon structural properties and its effects on soil available nutrients and humus compo-sition[J]. Journal ofAgricultural Environmental Science, 2011, 30(10):2075-2080.(in Chinese) |
| [21] | Steiner C, Glaser B, TeixeiraWG. Nitrogen retention and plant uptake on a highly weathered central Amazonian ferralsol ammended with com-post and charcoal[J]. Journal ofPlant Nutrition and Soil Science, 2008, 171(6):893-899. |
 2015, Vol. 32
2015, Vol. 32