文章信息
- 张帆, 谢丽, 邹晓阳, 朱建航
- ZHANG Fan, XIE Li, ZOU Xiao-yang, ZHU Jian-hang
- 响应面法优化制备高富硒产朊假丝酵母
- Optimization of Selenium-enriched Candida utilis by Response Surface Methodology
- 农业资源与环境学报, 2014, 31(6): 575-582
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0260
-
文章历史
- 收稿日期:2014-09-30
2. 丰城市中国生态硒谷现代农业管委会, 江西丰城330011
2. Modern Ecological Agricultural Management Committee of Selenium-enriched Valley, Fengcheng 330011, China
硒是生物体必需的微量营养元素,缺硒会导致很多疾病。人体缺硒会诱发心血管疾病和癌症[1,2,3],动物缺硒会导致白肌病和生长缓慢等[4]。目前用于防治疾病和作为饲料添加剂的主要是无机硒[5],有机硒与无机硒相比,具有较高的生物活性[6]和较低的毒性[7],故人们越来越重视有机硒的补充。有机硒可以通过人工合成、生物转化及生物富集等方式生产,通过微生物将无机硒转化为有机硒是目前比较普遍、实用、经济的生产方法[8]。富硒酵母中有机硒含量较高,相关文章报道富硒酵母中的有机硒的含量达90%以上[9,10,11],其中硒代半胱氨酸占60%以上,硒代蛋氨酸占20%左右,另外还有非氨基酸形式的有机硒化合物存在[12]。富硒酵母可以作为一种安全的硒源,是一种非常理想的功能性食品原料,具有广阔的市场应用前景[13]。一般而言,酵母中所能达到的最大硒量约为3 000 μg·g-1,而普通商业富硒酵母中硒含量一般为500~2 000 μg·g-1 [14]。
目前,国内外关于富硒发酵条件的优化的报道比较多,较多是考察培养基对酵母富硒的影响,考虑发酵条件中多个因素对富硒含量影响的报道却很少,尤其针对发酵过程中的加硒时间、加硒浓度、发酵温度、pH值、接种量和装液量等多个影响因素综合进行考察。多因素优化实验可以采用响应面法或正交实验法。响应面法(response surfacem methodology,RSM)是利用合理的实验设计并通过实验得到一些数据,然后采用多元二次回归方程来拟合因素与响应值之间的函数关系,最终通过对回归方程的分析来寻求最优工艺参数,解决多变量问题的一种统计方法。响应面法不仅能考察发酵条件中的各个关键因素,而且能同时考察各种显著影响因素之间交互作用对优化结果的影响,从而得到最优的发酵条件。
本研究所用产朊假丝酵母为一株高产谷胱甘肽的菌株,前期对其发酵产谷胱甘肽培养基进行了优化[15]。在此基础上本文对产朊假丝酵母的富硒能力进行研究,并对富硒条件进行单因素筛选和响应面优化,同时利用催化吸收光度法作为硒含量的定量测定方法[16],旨在为高性能富硒产朊假丝酵母的制备及应用提供基础依据。 1 材料与方法 1.1 菌种
菌种来源:从江西省丰城市富硒果园中采集土壤样品,在高硒浓度200 mg·L-1培养基中培养,划线分离纯化得到菌株,通过26S rDNA D1/D2序列测定分析及形态、生理生化试验初步鉴定为产朊假丝酵母(Candida utilis)。由本实验室筛选和保藏。 1.2 主要试剂及仪器
亚硒酸钠标准品;盐酸苯肼;EDTA二钠;变色酸;氯酸钾;高氯酸。
722s可见分光光度计;立式压力蒸汽灭菌器;TGL-16C离心机;洁净工作台SW-QJ-2FD;智能生化培养箱SPX-250;大容量恒温振荡器;PHS-3C精密pH计;FHH-1恒温水浴锅;A1104N分析天平。 1.3 培养基
种子培养基:葡萄糖40 g·L-1、酵母粉10 g·L-1、KH2PO4 2 g·L-1、K2HPO4 1 g·L-1,pH 6.5。
发酵培养基:葡萄糖40 g·L-1、酵母粉10 g·L-1、(NH4)2SO4 10 g·L-1、KH2PO4 1.2 g·L-1、K2HPO4 1.8 g·L-1、MgSO4 0.3 g·L-1,pH 6.5。 1.4 培养条件
斜面培养:将产朊假丝酵母接种于麦芽汁琼脂斜面上,30 ℃培养48 h。
种子培养:从平板上取1环斜面菌体接到装有200 mL种子培养基的500 mL三角瓶中,摇床(30 ℃,200 r·min-1)培养36 h。
发酵培养:将培养好的种子液以10%的接种量接种于装有200 mL发酵培养基500 mL三角瓶中,摇床(30 ℃,200 r·min-1)培养24 h,菌体对数生长中期添加亚硒酸钠溶液,添加浓度为25 mg·L-1。 1.5 分析方法 1.5.1 菌体干重的测定
取4 mL发酵液6 000 r·min-1离心5 min,去离子水洗3 次,收集菌体,105 ℃烘干至恒定质量,称重。 1.5.2 硒标准曲线的绘制
分别取含硒0.2 μg·mL-1的亚硒酸钠标准液0、1、2、3、4、5 mL于15 mL的比色管中,加入EDTA 1 mL,缓冲液2 mL,氯酸钾2 mL,变色酸2 mL,盐酸苯肼1 mL,加水至15 mL,摇匀,在沸水浴中加热20 min,于冷水中冷却后,用1 cm比色皿于508 nm波长下测定吸光度,绘制标准曲线。 1.5.3 产朊假丝酵母生长曲线的测定
500 mL的三角瓶中装入发酵培养基200 mL,然后以10%的接种量接种,此时培养基中不含硒,然后置于摇床(30 ℃、200 r·min-1)中振荡培养,发酵过程中每隔一定时间取样,测定发酵液的菌体干重。以菌体干重为纵坐标、培养时间为横坐标,绘出产朊假丝酵母的生长曲线。 1.5.4 样品的消解[17]
取10 mL发酵液于50 mL离心管中,6 000 r·min-1离心5 min,去离子水洗3次,收集菌体。将离心后得到的菌体置于150 mL三角瓶中,加入15 mL混合酸(硝酸∶高氯酸=4∶1),缓慢加热进行消化,直到溶液变成无色透明并伴有滚滚白烟时停止加热,冷却后,定容,待测。 1.5.5 菌体胞内硒含量的测定[17]
(1)胞内总硒含量的测定。在25 mL比色管中,加入样品1 mL,EDTA 1 mL,缓冲液2 mL,氯酸钾2 mL,变色酸2 mL,盐酸苯肼1 mL,加水至15 mL,摇匀,在沸水浴中加热20 min,于冷水中冷却后,用1 cm比色皿于最大吸收波长下测定吸光度,对应标准曲线算出硒含量。
(2)胞内无机硒含量的测定。取10 mL发酵液于50 mL离心管中,6 000 r·min-1 离心5 min,去离子水洗3次,收集菌体。在离心后得到的菌体中加入10 mL蒸馏水,80 ℃水浴中加热1 h,离心,测定上清液中硒浓度。 (3)胞内有机硒含量的测定。有机硒含量(μg·L-1)=总硒含量(μg·L-1)-无机硒含量(μg·L-1) 2 结果与分析 2.1 单因素分析 2.1.1 生长曲线的绘制
通过产朊假丝酵母生长曲线的绘制,了解其生长情况,为后期的发酵时间及加硒时间的确定提供数据依据。如图 1所示,产朊假丝酵母的生长情况0~4 h是延滞期,4~16 h为对数期,其中对数生长初期为4 h,对数生长中期为10 h,对数生长末期为16 h,16~48 h为稳定期。
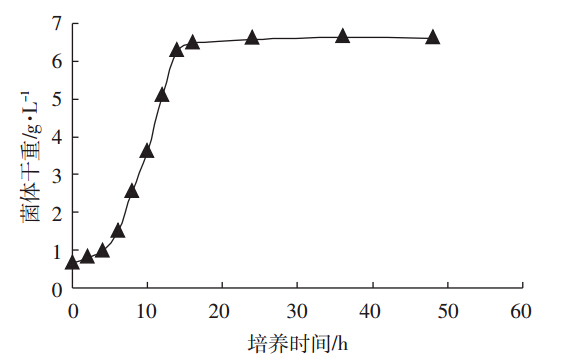 |
| 图 1 产朊假丝酵母的生长曲线Figure 1 The growth curve of Candida utilis |
根据产朊假丝酵母的生长曲线得出酵母进入生长对数初期、中期、末期的时间,分别选取加硒时间为发酵初期、对数初期、对数中期、对数末期,考察加硒时间对产朊假丝酵母生物量和含硒量的影响。如图 2所示,在初期添加亚硒酸钠对细胞生长和胞内硒的富集有不利影响,当加硒时间为对数中期时,总硒含量最高,加硒时间为对数末期时,生物量略有升高,但总硒含量呈下降趋势。因此,加硒时间选择对数中期最佳。
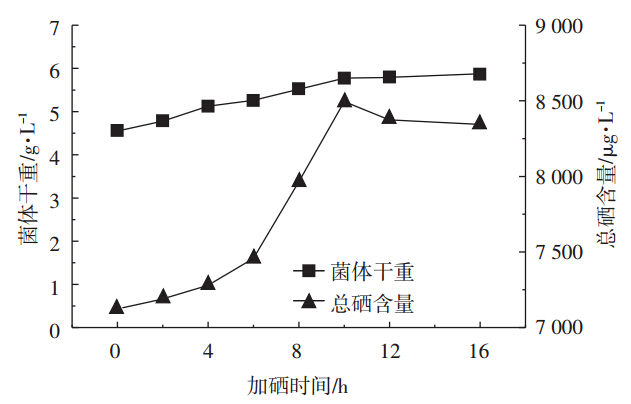 |
| 图 2 加硒时间对产朊假丝酵母生物量和含硒量的影响 Figure 2 Effects of time of adding selenium on the biomass and selenium content of Candida utilis |
选择发酵时间24、30、36、42、48 h,做发酵饰演的单因素实验,分析发酵时间对产朊假丝酵母生物量和含硒量的影响。如图 3所示,随着发酵时间的增加,产朊假丝酵母的生物量和总硒含量均呈上升趋势,培养30 h生物量和总硒含量均达到最高,培养时间延长,生物量和总硒含量均没有变化。因此,发酵时间选择30 h较合适。
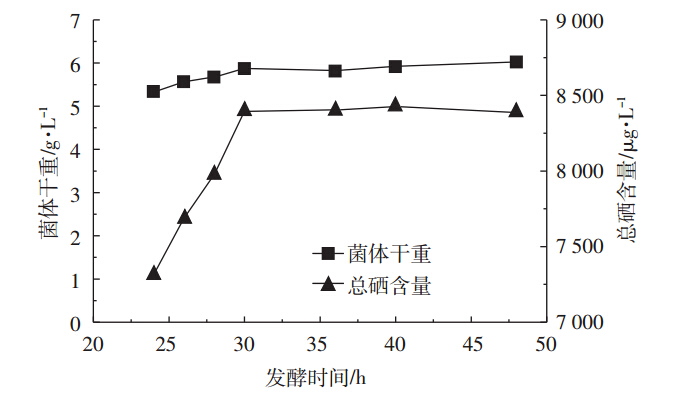 |
| 图 3 发酵时间对产朊假丝酵母生物量和含硒量的影响 Figure 3 Effects of incubation time on the biomass and selenium content of Candida utilis |
在发酵培养生长对数中期添加不同浓度的亚硒酸钠,考察加硒浓度对产朊假丝酵母生物量和含硒量的影响。如图 4所示,当亚硒酸钠浓度低于15 mg·L-1时,其添加对菌体的生长没有影响,总硒含量呈上升趋势,当亚硒酸钠浓度超过15 mg·L-1后,亚硒酸钠的添加对产朊假丝酵母的生长有一定的抑制作用;胞内总硒含量在亚硒酸钠添加量为30 mg·L-1时达到最高值,此时胞内总硒含量为10 212.6 μg·L-1,且可同时获得5.58 g·L-1的生物量。因此,选择亚硒酸钠的添加浓度为30 mg·L-1。
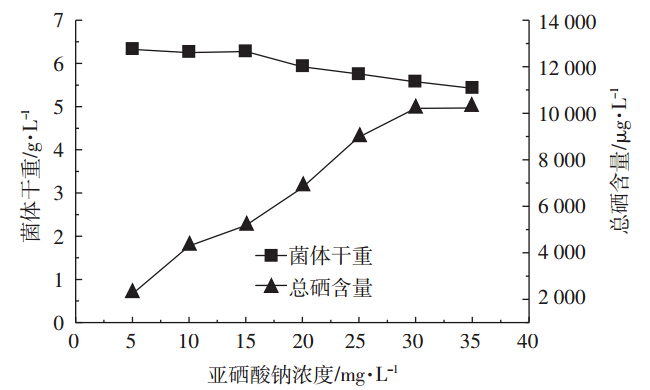 |
| 图 4 亚硒酸钠浓度对产朊假丝酵母生物量和含硒量的影响 Figure 4 Effects of sodium selenite concentration on the biomass and selenium content of Candida utilis |
为考察初始pH值对产朊假丝酵母生物量和含硒量的影响,分别选取初始pH值为5、5.5、6、6.5、7、7.5、8进行研究。如图 5所示,较低的初始pH值和较高的初始pH值均不利于胞内硒的富集,在初始pH值为6.5时,产朊假丝酵母生物量和总硒含量均达到最大值,为5.35 g·L-1和10 162.2 μg·L-1。因此最适的初始pH值为6.5。
 |
| 图 5 初始pH值对产朊假丝酵母生物量和含硒量的影响 Figure 5 Effects of inital pH on the biomass and selenium content of Candida utilis |
选取不同的接种量进行发酵培养,研究接种量对产朊假丝酵母生物量和总硒含量的影响。如图 6所示,随着接种量的增加,产朊假丝酵母的生物量和总硒量也呈上升趋势,在接种量超过10%后,菌体的生物量和总硒含量趋于稳定。因此选定发酵培养的接种量为10%。
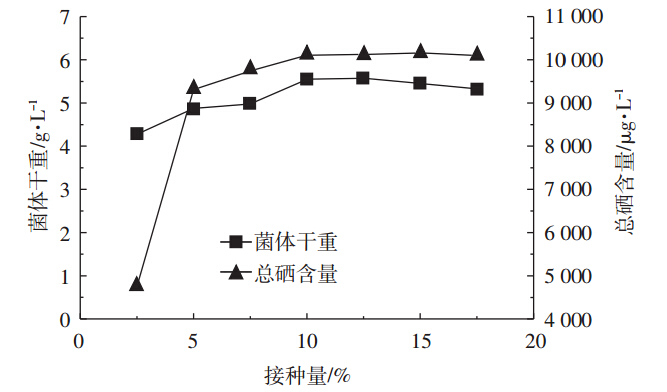 |
| 图 6 接种量对产朊假丝酵母生物量和含硒量的影响 Figure 6 Effects of inoculum concentration on the biomass and selenium content of Candida utilis |
微生物的生长以及代谢是由一系列的生化反应组成的,而温度对于这些反应具有较明显的影响,设置培养温度20~40 ℃,以5 ℃为间隔,研究温度对产朊假丝酵母生物量和总硒含量的影响。如图 7所示,温度对产朊假丝酵母的生长及胞内硒的富集具有较大影响,随着温度的升高,菌体生物量和总硒含量均呈现先升高后降低的趋势,并且菌体生物量及总硒含量均在25 ℃时达到最高。因此,选取25 ℃为发酵培养的最佳温度。
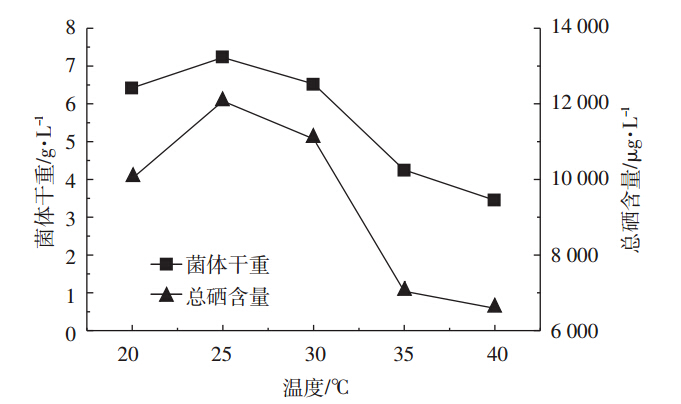 |
| 图 7 培养温度对产朊假丝酵母生物量和含硒量的影响 Figure 7 Effects of incubation temperature on the biomass and selenium content of Candida utilis |
分别用500 mL三角瓶装取50、100、150、200、250 mL的发酵培养基,考察装液量对产朊假丝酵母生物量和总硒含量的影响。如图 8所示,装液量对产朊假丝酵母的生长和硒的富集具有一定的影响,适当减少装液量以增加通气量可以提高产朊假丝酵母的生物量和总硒含量,而装液量为50 mL时,胞内总硒含量明显减少,在装液量为150 mL时菌体生物量和总硒含量均可达到最佳值。因此,选定150 mL/500 mL的装液量进行发酵培养。
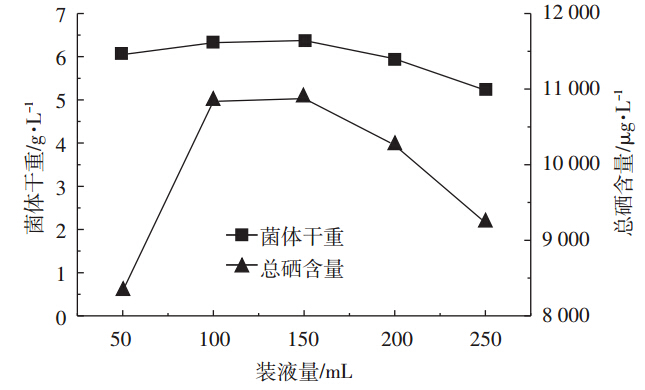 |
| 图 8 装液量对产朊假丝酵母生物量和含硒量的影响 Figure 8 Effects of medium volume on the biomass and selenium content of Candida utilis |
在单因素试验基础上,可知亚硒酸钠浓度、初始pH值和培养温度对产朊假丝酵母富硒工艺的影响较大。因此根据Box-Behnken试验设计原理,可选取这3个因素对提取工艺进行响应面分析。以产朊假丝酵母胞内总硒含量为响应值,选取亚硒酸钠浓度、初始pH值和培养温度进行三因素三水平共17组试验。利用响应面试验结果,确定产朊假丝酵母富硒的最佳工艺条件。响应面试验因素水平见表 1,响应面分析及结果见表 2。
采用Design-Expert软件对表 2中实验数据进行二次多项式逐步回归拟合,得到的数学模型为:
Y=-1.31×105+2 775.98A+21 831.34B+1 903.56C+83.98AB-0.45AC-28.74BC-49.60A2-1 810.56B2-31.56C2
如表 3所示,模型的F=151.38、P<0.05(显著),失拟项检验的P>0.05(不显著),R2=0.994 9,说明模型拟合实验数据充分,表明响应值胞内总硒含量实际值与预测值之间具有较好的拟合度。回归方程中各变量对响应值影响的显著性由F检验来判定,P值越小相应变量的显著程度越高。A、C、AB、A2、B2、C2的P值均小于0.05,说明亚硒酸钠浓度、温度、交互项AB及三因素的二次项对胞内总硒含量均具有显著影响。由回归方程各项方差结果可知,在所选取的各因素水平范围内,按照对结果的影响排序,其顺序为亚硒酸钠浓度>温度>初始pH值。运用Design-Expert软件分析处理实验所得数据,对提取率有交互影响的响应面分析立体曲面图见图 9。
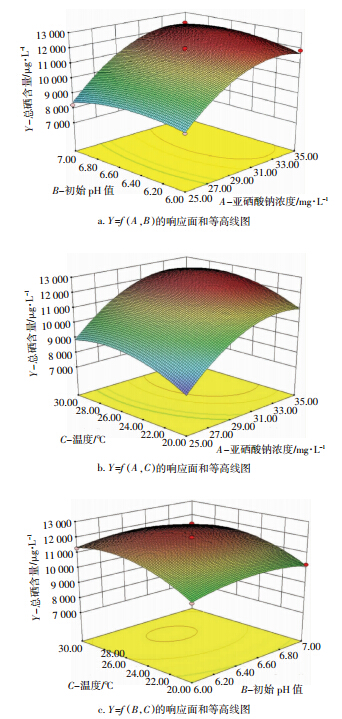 |
| 图 9 两因素交互作用对胞内总硒含量的响应面图和等高线图 Figure 9 Response surface and contour plots for the effect of operating parameters |
响应面图形是响应值对各试验因子A、B、C所构成的三维空间的曲面图,从响应面分析图上可形象地看出最佳参数及各参数之间的相互作用,等高线的形状可反映交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反[18,19]。根据回归方程得出不同因子的响应面分析图及相应等高线图结果见图 9。如图 9所示,亚硒酸钠浓度对胞内总硒含量的影响显著,温度的影响次之,初始pH值的影响较小;由等高线的密集程度及形状可知亚硒酸钠和初始pH值的交互作用显著。 利用软件分析可知,产朊假丝酵母富硒的最佳的工艺条件为亚硒酸钠浓度35.00 mg·L-1、初始pH 6.63、温度26.88 ℃,预测总硒含量为12 518.8 μg·L-1。 2.2.4 验证试验
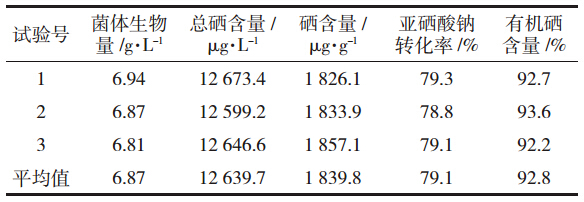
为了检验模型预测的准确性,将最佳工艺条件:培养时间30 h、加硒时间对数生长中期、亚硒酸钠浓度35 mg·L-1,初始pH 6.6、接种量10%、培养温度27 ℃、装液量150 mL/500 mL,平行进行3次实际培养实验,得出菌体的生物量,胞内总硒含量及有机硒含量,结果见表 4。如表 4所示,最优条件下总硒含量的实际值为12 639.7 μg·L-1,硒含量为1 839.8 μg·g-1,其中亚硒酸钠转化率为79.1%,有机硒含量占90%以上,与理论值12 518.8 μg·L-1的相对误差为0.94%,相差不显著,说明预测值与实际值之间有较好的拟合性,进一步验证了回归模型的可靠性。
由于酵母作为一种高效的富硒微生物,越来越受到科研工作者的重视,表 5中列出了近几年酵母菌富硒研究的相关进展,其中主要以酿酒酵母和产朊假丝酵母的富硒能力尤为突出,胞内硒含量平均达到2 000 μg·g-1以上。本研究通过考察发酵过程中的加硒时间、加硒浓度、发酵温度、pH值、接种量和装液量等多个影响因素综合进行评价。 通过产朊假丝酵母的培养时间及加硒时间的考察,发现富硒的时间主要集中在酵母的对数生长期,这与王大慧等[22]报道的结果类似。随着酵母生长进入稳定期,富硒含量逐渐趋于稳定,说明在酵母快速生长阶段对于硒的吸收与富集有较大影响,可能因为硒在酵母生长繁殖的过程中掺入到初级代谢产物中,到了稳定期以后,酵母的生长基本停止,代谢降低,乙醇等发酵产物开始积累,硒很难再掺入到细胞内。
由图 4可知,随着硒浓度的增大,菌体量则随之减少,是由于高浓度的硒对酵母生长产生了较大抑制,影响酵母正常代谢过程,葛晓光等[17]的研究中也发现了同样的现象,因此合适的亚硒酸钠添加量对于提高富硒酵母的性能十分必要。同时,酵母的培养条件如初始pH值、温度、装液量对富硒含量均有较大影响,在实验中发现pH值偏酸性有利于富硒含量的提高,王大慧等[28]通过酸胁迫来提高酵母富硒性能,通过对不同pH值环境下酵母细胞生长、谷胱甘肽合成以及有机硒转化情况进行研究,同样发现弱酸胁迫可以明显提高酵母胞内有机硒含量。 4 结论
通过单因素和响应面法试验优化产朊假丝酵母富硒工艺条件,得到最佳工艺参数为:培养时间30 h、加硒时间对数生长中期、亚硒酸钠浓度35 mg·L-1,初始pH 6.6、接种量10%、培养温度27 ℃、装液量150 mL/500 mL。在最优条件下,菌体生物量为6.87 mg·L-1,胞内总硒含量为12 639.7 μg·L-1,有机硒含量为1 839.8 μg·g-1,其中亚硒酸钠转化率为79.1%,有机硒占90%以上;胞内总硒含量与数学模型理论值12 518.8 μg·L-1的相对误差为0.94%,相差不显著,说明响应面模型与实际情况有较好的拟合性,响应面法能较好地优化产朊假丝酵母富硒工艺条件。
| [1] | Zagrodzki P, Laxzczyk P.Selenium and cardiovascular disease: selected issues[J].Advances in Hygiene and Experimental Medicine, 2006, 60: 624-631. |
| [2] | Jelicks L A, De Souza A P, Araujo-Jorge T C. Would selenium supplementation aid in therapy for chagas disease[J]. Trends Parasitol, 2011, 27 (3): 102-105. |
| [3] | Rayman M P.Selenium in cancer prevention:a review of the evidence and mechanism of action[J]. The Proceedings of the Nutrition Society, 2005, 64(4): 527-542. |
| [4] | 张影,单安山,尹佳佳.酵母硒在动物生产中的研究与应用[J].中国畜牧兽医, 2011(7): 16-19. ZHANG Ying, SHAN An-shan, YI Jia-jia. Research and application of selenium yeast in animal production[J]. Chinese Animal Husbandry and Veterinary Medicine, 2011(7): 16-19.(in Chinese) |
| [5] | 徐辉碧.生物微量元素硒[M].武汉:华中工学院出版社, 1983: 15-20. XUHui-bi. Biological trace element selenium[M].Wuhan: Huazhong Institute of Technology Press, 1983: 15-20.(in Chinese) |
| [6] | Yoon I, Werner T M, Butler J M. Effect of source and concentration of selenium on growth performance and selenium retention in broiler chickens[J]. Poultry Science Association, 2007, 86: 727-730. |
| [7] | Schrauzer G N, White D A. Elemental selenium inorganic seleniumcompounds: their chemistry and biology[J]. BioinorgChem, 1983, 8(3): 303. |
| [8] | 张欣文, 王旭辉, 白莉华, 等. 亚硒酸钠对果蝇谷胱甘肽过氧化物酶活力及寿命的影响[J]. 卫生研究, 2000(3): 166-167. ZHANG Xin-wen, WANG Xu-hui, BAI Li-hua, et al. Effects of sodium selenite on the activity of GSH-Px and the life-span of drosophila[J]. Journal of Hygiene Research, 2000(3): 166-167.(in Chinese) |
| [9] | Westermark T. Seleniumand selenides[J]. Acta Pharmacal Toxical, 1987, 4(1): 121. |
| [10] | 郝素娥, 滕冰. 硒酵母中有机硒及硒代氨基酸含量的测定方法[J].分析测试学报, 1999(3): 72-74. HAO Su-e, TENG Bing. Determination of content of organic selenium and seleniumamino acids in seleniumyeasts[J]. Journal of Instrumental Analysis, 1999(3): 72-74.(in Chinese) |
| [11] | 金丰秋, 金其荣. 高硒酵母与富硒酵母[J]. 江苏食品与发酵, 2000 (4): 37-38. JIN Feng-qiu, JIN Qi-rong. High Se yeast and rich Se yeast[J]. Jiangsu Food and Fermentation, 2000(4): 37-38.(in Chinese) |
| [12] | 蒋守群. 有机硒在动物营养上的研究与应用[J]. 饲料工业, 2005 (20): 43-45. JIANG Shou-qun. Research and application of organic selenium on animal nutrition[J]. Feed Industry, 2005(20): 43-45.(in Chinese) |
| [13] | 吴诚.机械工程材料测试手册(化学卷)[M]. 沈阳: 辽宁科学技术出版社, 1996: 622. WU Cheng. Handbook of mechanical engineering materials testing (Chemistry Vol)[M]. Shenyang: Liaoning Science and Technology Press, 1996: 622.(in Chinese) |
| [14] | Schrauzer G N. Selenium yeast: composition, quality, analysis, and safety[J]. Pure and Applied Chemistry, 2006, 78(1): 105-109. |
| [15] | 谢丽, 张帆, 朱建航, 等. 产朊假丝酵母高产GSH 发酵条件优化研究[J].食品工业科技, 2014(5): 158-162. XIE Li, ZHANG Fan, ZHU Jian-hang, et al. Study on the fermentation conditions of glutathione produced by Candida utilis [J]. Science and Technology of Food Industry, 2014(5): 158-162.(in Chinese) |
| [16] | 郝素娥,滕冰.硒酵母中硒含量测定方法研究[J].理化检验, 1999, 35(4): 151-153. HAO Su-e, TENG Bing. Study on determination of selenium in seleni-um-yeast[J]. PTCA Part B: Chemical Analysis, 1999, 35(4): 151-153. (in Chinese) |
| [17] | 葛晓光, 卫功元, 聂敏, 等. 富硒产朊假丝酵母的制备条件研究[J].粮食与饲料工业, 2009(10): 31-33. GE Xiao-guang, WEI Gong-yuan, NIE Min, et al. Studies on the conditions for preparation of selenium enriched with Candida utilis[J]. Cereal and Feed Industry, 2009(10): 31-33.(in Chinese) |
| [18] | 徐秀泉, 许源, 汤建, 等. 响应面法优化金莲花总黄酮的超声提取工艺[J].中国实验方剂学杂志, 2011(14): 35-38. XU Xiu -quan, XU Yuan, TANG Jian, et al. Optimization of ultrasound-assisted extraction of total flavonoids from Trollius chinensis by response surface methodology[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011(14): 35-38.(in Chinese) |
| [19] | 张玉香, 屈慧鸽, 杨润亚, 等. 响应面法优化蓝莓中黄铜的微波提取工艺[J].食品科学, 2010, 31(16): 33-37. ZHANG Yu-xiang, QU Hui-ge, YANG Run-ya, et al. Application of RSM to microwave-assisted extraction optimization of flavanoids from blueberry leaves[J]. Food Science, 2010, 31(16): 33-37.(in Chinese) |
| [20] | 陈里,詹逸舒, 吴永尧.富硒酵母培养条件的优化[J].湖南农业大学学报(自然科学版), 2009, 35(3): 237-241. CHEN Li, ZHAN Yi-shu, WU Yong-yao. Condition optimization in cultivation of selenium-enriched yeast[J]. Journal of Hunan Agricultu ral University(Natural Sciences), 2009, 35(3): 237-241(.in Chinese) |
| [21] | 刘培丽, 王大雁, 朱秀明, 等. 富硒酵母选育及无机硒生物转化发酵条件研究[J]. 蚌埠学院学报, 2012(1): 15-19. LIU Pei-li, WANG Da-yan, ZHU Xiu-ming, et al. Study on breeding and biotransformation of inorganic selenium from yeasts[J]. Journal of Bengbu College, 2012(1): 15-19.(in Chinese) |
| [22] | 王大慧, 杨波, 卫功元, 等. 提高产朊假丝酵母富硒能力的工艺条件研究[J].食品与机械, 2011(6): 245-248. WANG DA-hui, YANG Bo, WEI Gong-yuan, et al. Study on conditions for selenium enrichment improving of Candida utilis[J]. Journal of Food and Machinery, 2011(6): 245-248.(in Chinese) |
| [23] | 牛海涛, 汤燕花, 谢必峰. 制备富硒产朊假丝酵母(Candida utilis) 的条件优化[J].药物生物技术, 2007(2): 123-126. NIU Hai-tao, TANG Yan-hua, XIE Bi-feng. Optimum of the condition for preparing selenium-enriched Candidautilis[J]. Pharmaceutical Biotechnology, 2007(2): 123-126.(in Chinese) |
| [24] | 张顺涛,李肖,左涛,等.高生物量富硒酵母菌的选育[J].中国酿造, 2008(21): 37-40. ZHANG Shun-tao, LI Xiao, ZUO Tao, et al. Breeding of a high-biomass and selenium-enriched yeast strain[J]. China Brewing, 2008(21): 37- 40.(in Chinese) |
| [25] | 牛海涛, 汤燕花. 利用产朊假丝酵母转化无机硒为有机硒的研究[J].饲料工业, 2006(20): 16-18. NIU Hai-tao, TANG Yan-hua. The biotransformation of inorganic seleniumto organic seleniumby Candidautilis[J]. Feed Industry, 2006(20): 16-18.(in Chinese) |
| [26] | 李端,郭利伟,殷红.啤酒酵母富硒发酵条件研究[J]. 江苏农业科学, 2009(6): 362-363. LI Rui, GUO Li-wei, YIN Hong. Study on the fermentation conditions of seleniumenriched cerevisiae fermentum[J]. Jiangsu Agricultural Sci ences, 2009(6): 362-363.(in Chinese) |
| [27] | 刘杰,陈智,李卫旗,等.基于麦汁培养基的富硒酵母培养条件优化[J].食品科学, 2010, 31(9): 206-210. LIU Jie, CHEN Zhi, LI Wei-qi, et al. Optimal condition for seleniumrich yeast cultivation in beerwort media[J]. Food Science, 2010, 31(9): 206-210.(in Chinese) |
| [28] | 王大慧,许宏庆, 汪成富, 等. 酸胁迫在提升富硒/GSH 产朊假丝酵母性能中的作用[J]. 中国生物工程杂志, 2013, 33(11): 81-85. WANG Da-hui, XU Hong-qing, WANG Cheng-fu, et al. The role of acid stress on improved performance of selenium/glutathione enriched Candia utilis[J]. China Biotechnology, 2013, 33(11): 81-85.(in Chinese) |
 2014, Vol. 31
2014, Vol. 31