文章信息
- 耿芳芳, 王慧, 秦伟, 丁保君
- GENG Fang-fang, WANG Hui, QIN Wei, DING Bao-jun
- 基于构建微生物传感器的甲基对硫磷降解菌的分离鉴定及其降解特性研究
- Isolation and Characterization of Methyl Parathion-degrading Bacteria Based on Microbial Sensor Construction
- 农业资源与环境学报, 2014, 31(6): 521-526
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0193
-
文章历史
- 收稿日期:2014-07-25
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003
2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China
有机磷农药(organophosphorus pesticides,OPs)是目前我国使用最广泛的一类农药,占所有农药产量的30%左右[1]。这些化学农药的广泛使用在增加农作物产量的同时,也带来了严重的环境污染问题[2]。甲基对硫磷(methyl parathion,MP)学名O,O-二甲基-O-(4-硝基苯基)硫代磷酸酯,是一种高效、高毒的有机磷杀虫剂,广泛用于水稻及棉花的害虫防治[3, 4]。甲基对硫磷及其主要代谢中间产物对硝基苯酚(p-nitrophenol,PNP)因含有苯环结构,在土壤和水中残留期较长,不仅污染环境,而且对人畜健康造成潜在威胁,因此其在环境中残留的检测及污染环境的修复已引起人们广泛关注[4, 5]。
微生物传感器是由化学、生物、医学、材料、物理等典型的多学科交叉产物,根据检测信号的不同,可分为电流型微生物传感器和电位型微生物传感器[6, 7]。根据生物敏感材料的不同,目前,检测有机磷农药的电化学传感器可分为间接型胆碱酯酶抑制传感器和直接型水解酶传感器。由于所有的有机磷农药和氨基甲酸酯类农药都能对乙酰胆碱酯酶产生抑制作用,因此这种酶抑制型传感器只能测定农药的总量,而不能实现对某一类农药的选择性测定。而基于水解酶或降解细菌的直接型传感器能催化水解某些有机磷农药中的P-O键、P-S键等,产生酚或醇,从而可以用电流或电位作为输出信号来实现某些有机磷农药的选择性测定。
微生物降解有机磷农药的过程中会产生一种有机磷水解酶,该酶能将磷酸酯类有机磷农药水解产生一种中间产物对硝基苯酚,利用对硝基苯酚的电化学活性,在电极表面固定酶等生物活性材料,通过检测对硝基苯酚的氧化还原信号来间接测定有机磷农药。Mulchandani等[8]将大肠杆菌细胞表面表达的有机磷水解酶固定在pH电极表面,实现了取代对硝基苯酚的有机磷酸酯类农药对氧磷、对硫磷和甲基对硫磷的快速检测。Tang等[9]通过在玻碳电极修饰介孔碳材料和细胞表面表达的有机磷水解酶,构建了一种检测硝基酚取代的有机磷酸酯类农药的微生物传感器。但这些方法酶表达过程冗繁,电极修饰复杂,因此,构建简便快捷的有机磷农药微生物传感器具有重要意义。
本研究拟从长期受农药污染的土壤中筛选能够以甲基对硫磷为碳源生长的降解菌,对其降解机理进行初步探索,以期构建基于降解细菌的高选择性甲基对硫磷微生物传感器,实现对环境中有机磷农药残留的准确检测。 1 材料与方法 1.1 样品采集
从山东省烟台市莱山区长期受有机磷农药污染的蔬菜地采集样品,用于降解甲基对硫磷功能菌的分离筛选。采集过程中去除表层土壤,取5~10 cm深土壤样品100 g,4 ℃保存于实验室,用于后续实验分析。 1.2 培养基及主要试剂
无机盐培养基(MSM,g·L-1):NaCl 1.00,NH4NO3 1.00,K2HPO4 1.50,K2HPO4 0.50,MgSO4·7H2O 0.10,pH 7.0。固体培养基再加入20‰的琼脂。99.0% 甲基对硫磷(成都贝斯特试剂有限公司,编号:BW01-09),二氯甲烷(分析纯,国药集团化学试剂有限公司),甲醇(色谱纯,国药集团化学试剂有限公司),基因组DNA提取试剂盒(MoBio Laboratories,Carlsbad,CA,USA),10×Taq缓冲溶液、dNTP、正反向引物(Invitrogen Life Technologies,Carlsbad,CA,USA)。 1.3 方法 1.3.1 MP降解菌的筛选
将10.0 g土样加入MP浓度为50 mg·L-1的无机盐培养基中,以30 ℃、180 r·min-1摇床富集培养7 d MP降解菌。采用稀释涂平板法分离MP降解菌,具体操作如下:取培养液以10%的接种量转接到1‰的生理盐水中,梯度稀释至10-7,分别取10-5、10-6、10-7 3个浓度的菌液100 μL涂平板,7 d 时挑取形态大小不同的菌落在固体培养基上划线分离,得到单菌落。 1.3.2 筛选菌株对 MP 降解率的测定
将筛选出的4株菌在液体培养基上活化后,以10%的接种量接入MP浓度为 50 mg·L-1的无机盐培养基中,以30 ℃、180 r·min-1摇床培养,7 d时取2 mL培养液用于降解率的测定。具体操作如下:用CH2Cl2萃取3次,N2吹干后,用等体积的CH3OH定容,进行HPLC测定,对照组为未接种细菌的培养液。分别计算4株菌的降解率。将4株菌重新接种,分别在0、6、12、24、48、72、96、120、144 h取2 mL培养液,处理方法同上,进行HPLC测定。计算MP降解率,绘制降解曲线。 1.3.3 功能菌的鉴定
菌株DNA的提取及16S rRNA基因的PCR扩增按参考文献[10]进行。用于PCR扩增的正向引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′),反向引物为1492R(5′-TGACTGACTGAGGYTACCTTGTTACG-ACTT-3′);PCR扩增体系(50 μL)组成为:37.8 μL无菌超纯水,5 μL 10×Taq 缓冲溶液,2 μL MgSO4(50 mmol·L-1),1 μL dNTP(2.5 mmol·L-1),正反向引物各 1 μL(50 mmol·L-1),0.2 μL Taq,2 μL 模板。PCR条件为:①97 ℃预变性5 min;②92 ℃变性30 s,③55 ℃退火2 min,④72 ℃延伸90 s(第②到第④步反应30个循环);⑤ 72 ℃延伸30 min。采用1%的琼脂糖凝胶电泳检测扩增产物。测序由上海立菲生物技术公司北京测序部完成,测序结果经BLAST 检索分析后,GenBank上进行同源比对。 1.3.4 降解特性分析
将降解率最高的1株菌接种活化,培养100 h时后取2 mL培养液,用CH2Cl2萃取,等体积的CH3OH溶解,进行LC-MS测定,分析降解产物。色谱部分测定条件为C18反相柱(4.6×250 mm,SunFire),流动相V(乙腈)∶固定相V(水)= 80∶20,流速为1.0 mL·min-1,温度为40 ℃,进样量为20 μL;质谱部分采用三维四极离子阱质量分析器进行结构鉴定分析。取色谱能分开部分的质谱图,并与标准物质的质谱图进行对照,用分子离子峰及其主要的碎片特征峰确定降解产物的结构。 2 结果与讨论 2.1 MP降解菌的分离鉴定及降解率测定
通过稀释涂平板法共筛选到形态不同的4株菌,提取总DNA并进行16S rRNA基因鉴定,测序结果经BLAST 检索分析后,在GenBank 上进行同源比对。同源性比对结果显示,这些菌株分别属于克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)和芽孢杆菌属(Bacillus)(表 1)。将4株菌在含50 mg·L-1 MP的无机盐培养基培养7 d,用 HPLC 测定培养液中MP的残留量,在检测波长273.15 nm处,MP的出峰时间为 4.2 min,利用峰面积计算降解率。
 |
结果显示,所筛选的4株菌培养7 d后,对MP有不同程度的降解,降解率均在78%以上,降解效果最好的菌株MP-6能将MP完全降解,降解率为100%。Pino等[11]筛选得到能同时降解甲基对硫磷和毒死蜱的混合菌落,该菌落在120 h内能将对甲基对硫磷和毒死蜱的降解率分别达到72%和39%。高强等[4]筛选得到蜡状芽孢杆菌Bacillus cereus HS-MP12,该菌能利用甲基对硫磷(MP)和对硝基苯酚(PNP)为唯一碳源、在氮源生长24 h内对甲基对硫磷的降解率为86.8%,该菌代谢的过程中没有中间产物对硝基苯酚的积累。Wang 等[12]从活性污泥中筛选得到本文筛选得到能以甲基对硫磷(MP)和对硝基苯酚(PNP)为唯一碳源生长的农杆菌属Agrobacterium sp. strain Yw12,该菌能将甲基对硫磷(MP)和中间产物对硝基苯酚(PNP)完全降解,同时也能降解辛硫磷、甲胺磷等有机磷农药,有机氮农药莠去津和聚酯类农药溴氰菊酯。本文筛选得到的克雷伯氏菌Klebsiella sp. MP-6和芽孢杆菌Bacillus sp. R2A菌株在24 h内对甲基对硫磷的降解率在85%以上,与Bacillus cereus HS-MP12对甲基对硫磷的降解率相似,随着培养时间延长,菌株MP-6在7 d内对MP 的降解率达到100%。而且克雷伯氏菌Klebsiella sp. MP-6仅降解甲基对硫磷、对氧磷等硝基酚取代的有机磷酸酯类农药,有较好的选择性,因而有利于基于细菌的有机磷农药电位传感系统的构建。 2.2 动态降解率试验结果
将筛选得到的4株降解菌(MP-6,MP-14,MP-18,MP-19)分别接入含50 mg·L-1 MP的无机盐培养基中活化培养。依次在0、6、12、24、48、72、96、120、144 h取样,HPLC法测定MP残留量,用峰面积计算降解率(图 1)。由于诸多非生物因素,如pH值、温度能引起有机磷农药水解[13]。甲基对硫磷在强碱性条件下容易分解,为避免非生物因素的影响,选取不加降解菌,只加农药的无机盐培养基在相同条件下培养作为对照。所选的4株菌对MP 的降解率随着时间变化而变化,前6 h内降解率升高最快,这可能是由于此时的细菌处于生长的对数期,生长较快,因此随着时间延长,降解率升高较快。6 h 以后,降解率随时间延长缓慢升高,直至趋于稳定。这是由于随着时间延长,供氧量不足,使菌的繁殖能力有所下降,而且环境中的营养源减少或菌体自身产生的代谢物可能对其生化降解有抑制作用。而菌株MP-6的降解率始终比其他3株菌高。

|
| 图 1 不同菌株对甲基对硫磷(MP)的动态降解曲线 Figure 1 Degradation of methyl parathion(MP)using different strains |
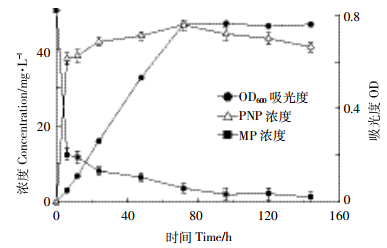
将降解率最高的菌株MP-6以10%的接种量接种到含50 mg·L-1 MP的无机盐培养基中活化培养。分别定时取样,HPLC测定MP和PNP的含量,用峰面积定量,紫外分光光度计测定菌液在600 nm处的吸光度(图 2)。结果显示,接种MP-6后,甲基对硫磷逐渐被降解,前6 h内降解率升高最快,6 h时降解率达75%,随着时间延长,降解率缓慢增加。这是因为细菌在达到对数生长期时,生长最旺盛,菌量增加很快,从而形成的酶量也逐步增加,酶活上升;细菌生长到对数后期,菌量不再增加并有老化、自融趋势,酶活也相应趋于稳定甚至略有下降,从而降解率趋于稳定甚至会有下降。中间产物对硝基苯酚的含量逐渐增加,76 h时对硝基苯酚的浓度达到最高,随着时间延长,对硝基苯酚浓度稍有降低,说明少量的中间产物对硝基苯酚也可被菌株MP-6降解。在降解过程中,OD600的值逐渐升高,最后趋于稳定,表明MP-6以甲基对硫磷及其少量的中间产物对硝基苯酚为碳源生长。Pino 等[14]筛选到能同时降解甲基对硫磷和对硝基苯酚的微生物菌群,该菌群降解甲基对硫磷过程中无对硝基苯酚积累,因此不适于构建基于测定对硝基苯酚信号的甲基对硫磷农药传感器。Liu等[15]筛选到降解积极对硫磷的不动杆菌属Acinetobacter radioresistens USTB-04,但并未对降解过程进行研究。本文筛选到的克雷伯氏菌Klebsiella sp. MP-6降解甲基对硫磷过程中有大量对硝基苯酚积累,这对构建积极对硫磷微生物传感器起到决定作用。
|
| 图 2 MP-6 对甲基对硫磷的降解 Figure 2 Degradation of methyl parathion (MP) by strain MP-6 |
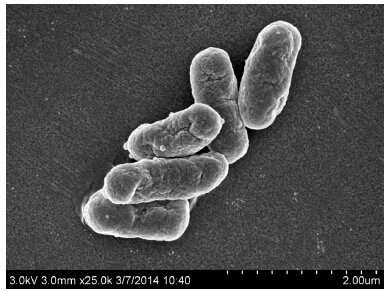
菌株MP-6在无机盐平板上30 ℃培养7 d,形成黄色、圆形、直径2 mm微凸起的菌落,革兰氏染色呈阴性。扫描电镜观察显示,MP-6呈短粗的直杆状,直径0.6 μm,成链状排列(图 3)。16S rRNA基因序列在NCBI上比对结果表明,MP-6菌株与Klebsiella sp. VITCl的相似度达到99%。结合微观形貌、理化性质以及16S rRNA基因序列比对结果,将该菌株鉴定为克雷伯氏菌属(Klebsiella),命名为Klebsiella sp. MP-6。
|
| 图 3 MP-6 扫描电镜图 Figure 3 Scanning electron micrographs of strain MP-6 |
克雷伯氏菌属(Klebsiella)已广泛应用于农药、石油等环境污染物的修复研究。姚瑶等[16]筛选到在含低链烷烃和环烷烃的培养基中生长较好的克雷伯氏菌属Klebsiella sp. DH-9,该菌株降解原油代谢物的发酵液中含有C8~C24的长链脂肪酸和主要的小分子有机酸乙酸。Wang等[17]筛选到克雷伯氏菌属Klebsiella sp. CPK,该菌能将毒死蜱(chlorpyrifos,CP)降解产生3,5,6-三氯吡啶-2-醇(3,5,6-trichloro-2-pyridinol,TCP),并发现对于菌株Klebsiella sp. CPK在毒死蜱(CP)作为唯一碳源的环境下,relA基因的表达对其降解起重要作用。本文是首次关于克雷伯氏菌属(Klebsiella)降解甲基对硫磷的报道。 2.4 降解特性分析
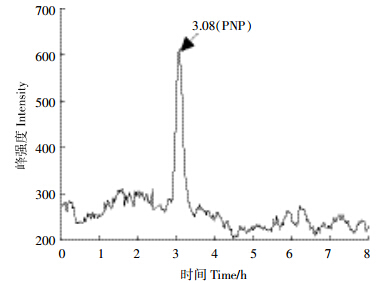
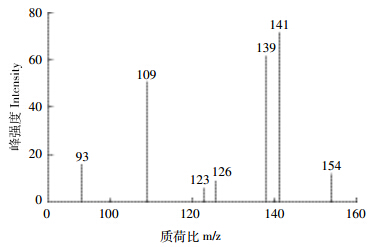
LC-MS结果显示,底物甲基对硫磷(MP) 4.2 min出峰,在降解后的样品中出峰位置几乎找不到峰值,说明甲基对硫磷(MP)大部分被降解,这与HPLC测定结果相吻合。中间产物对硝基苯酚(PNP)在3.08 min出峰。由图 4可以看出,对硝基苯酚(PNP)相对峰度较强,说明在降解过程中,对硝基苯酚大量存在,是主要降解产物。从质谱图上(图 5)分析,m/z 139处的峰是对硝基苯酚的分子离子峰,m/z 123处的峰是分子离子丢掉硝基上的氧后的峰,m/z 109处的峰是分子离子丢掉硝基上NO后的峰,m/z 93处的峰是分子离子丢掉硝基后的峰,m/z 141处的峰是二甲基硫代磷酸的分子离子峰。将m/z 126和m/z 154处的峰与猜测的标准物质的峰形图比对,其分别与1,2,4-苯三酚和4-硝基邻苯二酚的相对应,可能由于峰强度太弱而未能发现除分子离子峰之外的其他特征峰。因此推测仅有少量的对硝基苯酚(PNP)通过产生4-硝基邻苯二酚(4-NC)和1,2,4-苯三酚(1,2,4-BT)进一步代谢。
|
| 图 4 MP-6降解甲基对硫磷(MP)产物的液相色谱图 Figure 4 Chromatogram of metabolites of methyl parathion (MP) degraded by MP-6 |
|
| 图 5 MP-6降解甲基对硫磷(MP)产物的质谱图 Figure 5 Mass spectrum of metabolites of methyl parathion(MP)degraded by MP-6 |
聚合物膜离子选择性电极可以通过指示化学反应实现对底物浓度或反应催化剂活性的间接测定。这类间接电位分析根据信号的产生方式可分为“开-关”模式或“关-开”模式。“关-开”模式下,化学反应的反应物没有电位响应,但是反应生成物能在电极表面产生电位信号[18];反之即“开-关”模式。例如,在铵离子选择性电极表面,尿素无电位响应,但经脲酶催化产生的铵离子能在铵离子选择性电极表面产生明显的电位信号,基于此可以实现对尿素或脲酶的间接电位检测。碱性条件下,甲基对硫磷(MP)在液体膜离子选择性电极表面无电位信号,对硝基苯酚(PNP)能被解离产生氢离子,氢离子从膜相萃取到水相,因此对硝基苯酚(PNP)能在膜表面产生电位响应。菌株MP-6降解甲基对硫磷(MP)的过程中产生大量的对硝基苯酚(PNP),类似间接电位分析过程中的“关-开”模式,可以捕捉甲基对硫磷(MP)被菌株MP-6降解的中间产物对硝基苯酚(PNP),通过测定对硝基苯酚(PNP)在液体膜离子选择性电极表面产生的电位信号来实现对甲基对硫磷(MP)的间接电位测定。基于离子选择性电极的高灵敏度,降解过程中产生少量的对硝基苯酚(PNP)即可在膜电极表面产生电位信号,因此该方法可实现对环境中残留的痕量有机磷农药的快速测定。 3 结论
从长期受农药污染的土壤中筛选分离出4株能以甲基对硫磷为唯一碳源生长的菌株,经16S rRNA 同源性分析,降解率最高的MP-6菌株,鉴定为克雷伯氏菌属(Klebsiella)。在30 ℃、MP浓度50 mg·L-1、接种量10%、pH 7.0 的条件下研究了筛选菌株对甲基对硫磷的降解率,结果表明,菌株MP-6 对甲基对硫磷降解效果良好,7 d内的降解率达100%。试验中发现中间产物对硝基苯酚(PNP)的代谢产物中有4-硝基邻苯二酚(4-NC)和1,2,4-苯三酚(1,2,4-BT),因此推测菌株MP-6 是通过先产生中间产物PNP,再降解产生4-硝基邻苯二酚(4-NC)和1,2,4-苯三酚(1,2,4-BT)的途径进行代谢的,其中对硝基苯酚是主要的代谢产物,这将对基于测定产物对硝基苯酚的电化学信号来构建测定环境中有机磷农药残留的电位型微生物传感器起到决定性的作用。本研究中筛选获得的天然菌株Klebsiella sp. MP-6 满足构建电位型有机磷农药传感器的条件,且有很强的专一性,操作简便且不会造成二次污染,因此在测定环境中有机磷农药残留方面有很好的应用前景。
| [1] | 郑永良, 刘德立, 高 强, 等. 甲胺磷农药降解菌HS-A32的分离鉴定及降解特性[J]. 应用与环境生物学报, 2006, 12(3): 399-403.ZHENG Yong-liang, LIU De-li, GAO Qiang, et al. Isolation and characterization of a bacterium HS-A32 capable of degrading methamidophos[J]. Chinese Jornal of Applied Environmental Biology, 2006, 12(3): 399-403.(in Chinese). |
| [2] | Singh Brajesh K, Walker Allan. Microbial degradation of organophosphorus compounds[J]. Federation of European Microbiological Societies Microbiology Reviews, 2006, 30(3): 428-471. |
| [3] | 许育新, 冯昭中, 陆 朋, 等. 甲基对硫磷降解PF32的分离鉴定及其降解特性研究[J]. 农药学学报, 2009, 11(3): 329-334.XU Yu-xin, FENG Zhao-zhong, LU Peng, et al. Isolation and characterization of capable of degrading parathion-methyl bacterium Stenotrop-homonas sp. PF32[J]. Chinese Journal of Pesticide Science, 2009, 11(3): 329-334.(in Chinese) |
| [4] | 高 强, 邓灵福, 郑永良, 等. 甲基对硫磷降解菌的分离鉴定及降解特性研究[J]. 安全与环境学报, 2007, 7(3): 22-25.GAO Qiang, DENG Ling-fu, ZHENG Yong-liang, et al. Study on isolating and characterizing HS-MP12-a strain capable of degrading methyl parathion[J]. Journal of Safety and Environmet, 2007, 7(3): 22-25.(in Chinese) |
| [5] | Tenbrook P L, Kendall S M, Tjeerdema R S. Toxicokinetics and biotransformation of p-nitrophenol in white sturgeon (Acipenser transmontanus)[J]. Ecotoxicology and Environmental Safety, 2006, 64(3): 362-368. |
| [6] | Bobacka Johan, Ivaska Ari, Lewenstam Andrzej. Potentiometric ion sensors[J]. Chemical Reviews, 2008, 108: 329-351. |
| [7] | Dennison M J, turner A P F. Biosensors for environmental monitoring[J]. Biotechnology Advances, 1995, 13(1): 1-12. |
| [8] | Mulchandani Ashok, Mulchandani Priti, Kaneva Irina, et al. Biosensor for direct determination of organophosphate nerve agents using recombinant Escherichia coli with surface-expressed organophosphorus hydrolase.1. potentiometric microbial electrode[J]. Anayticall Chemistry, 1998, 70: 4140-4145. |
| [9] | Tang Xiang-jiang, Zhang Ting-ting, Liang Bo, et al. Sensitive electrochemical microbial biosensor for p-nitrophenylorganophosphates based on electrode modified with cell surface-displayed organophosphorus hydrolase and ordered mesopore carbons[J]. Biosensors and Bioelectronics, 2014, 60: 137- 142. |
| [10] | Frederick M Ausubel著. 王海林译.精编分子生物学实验指南[M]. 北京: 科学出版社, 2001: 39-43, 587-593.Frederick M Ausubel. Translated by Wang Hai-lin. Short protocols in molecular biology[M]. Beijing: Science Press, 2001: 39-43, 587-593.(in Chinese) |
| [11] | Pino Nacy, Peñuela Gustavo. Simultaneous degradation of the pesticides methyl parathion and chlorpyrifos by an isolated bacterial consortium from a contaminated site[J]. International Biodeterioration & Bio-degradation, 2011, 65: 827-831. |
| [12] | Wang Sheng-hui, Zhang Chen, Yan Yan-chun. Biodegradation of methyl parathion and p-nitrophenol by a newly isolated Agrobacterium sp. strain Yw12[J]. Biodegradation, 2012, 23: 107-116. |
| [13] | 郑天凌, 鄢庆枇, 林良牧, 等. 海洋微生物对甲胺磷农药的降解作用[J]. 台湾海峡, 1999, 18(1): 95-99.ZHENG Tian-ling, YAN Qing-pi, LIN Liang-mu, et al. Study on organic-phosphorus pesticide-decomposing bacteria from marine environment[J]. Journal of Oceanography in Taiwan Strait, 1999, 18(1): 95-99.(in Chnese) |
| [14] | Pino Nacy J, Dominguez Maria C, Penuela Gustavo A. Isolation of a selected microbial consortium capable of degrading methyl parathion and p-nitrophenol from a contaminated soil site[J]. Journal of Environmental Science and Health Part B, 2011, 46: 173-180. |
| [15] | Liu Fang-yao, Hong Ming-zhang, Liu Dan-mei, et al. Biodegradation of methyl parathion by Acinetobacter radioresistens USTB-04[J]. Journal of Environmental Sciences, 2007, 19: 1257-1260. |
| [16] | 姚 瑶, 刘兆普, 郑青松, 等. 胜利油田土壤中石油降解菌分离和鉴定及代谢产物的研究[J]. 南京农业大学学报, 2013, 36(1): 65-71.YAO Yao, LIU Zhao-pu, ZHENG Qing-song, et al. Isolation and identification of oil-degrading bacteria in Shengli oilfield soil and analysis of metabolites[J]. Journal of Nanjing Agricultural University, 2013, 36(1): 65-71.(in Chinese) |
| [17] | Wang Sheng-hui, Zhang Chen, Li Kang, et al. Chlorpyrifos-induced stress response in the chlorpyrifos-degrader Klebsiella sp. CPK[J]. International Biodeterioration & Biodegradation, 2013, 82: 17-23. |
| [18] | Wang Xue-wei, Qin Wei. Reactive intermediates-induced potential responses of a polymeric membrane electrode for ultrasensitive potentiometric biosensing[J]. Chemical Communications, 2012, 48: 4073-4075. |
 2014, Vol. 31
2014, Vol. 31




