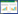文章信息
- 孙扬, 徐应明, 秦旭, 赵立杰
- SUN Yang, XU Ying-ming, QIN Xu, ZHAO Li-jie
- 新型杀菌剂啶氧菌酯在田间黄瓜和土壤中的残留消解动态及残留分析
- Residues and Analysis of Degradation of Novel Fungicide Picoxystrobin in Cucumber and Soil Under Field Conditions
- 农业资源与环境学报, 2014, 31(5): 476-481
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0128
-
文章历史
- 收稿日期:2014-05-13
啶氧菌酯(picoxystrobin)是由先正达公司开发的 一种广谱、内吸性的甲氧基丙烯酸酯类杀菌剂,化学 名称为(E)-3-甲氧基-2-{2-[6-(三氟甲基)-2-吡啶 氧甲基]苯基}丙烯酸甲酯,分子式为C18H16F3NO4[1, 2], 主要用于防治叶面病害如叶枯病、叶锈病、颖枯病、褐 斑病、白粉病等。啶氧菌酯是一种线粒体呼吸抑制剂, 即通过在细胞色素b 和c1 间电子转移抑制线粒体 的呼吸,对14-脱甲基化酶抑制剂、苯甲酰胺类、二羧 酰胺类和苯并咪唑类产生抗性的菌株有效。由于啶氧菌酯具有内吸活性和蒸发活性,施药后有效成分能有 效再分配及充分传递,对作物叶面病菌有很好的治疗 活性[3]。
目前,国内有朱海霞等[4]用流动注射化学发光法 测定环境水样中的啶氧菌酯残留量,段丽芳等[5]用气 相色谱-电子捕获检测器对西瓜中啶氧菌酯的残留 量进行分析检测,王云凤等[6]用液相色谱-质谱法测 定果蔬中8 种甲氧基丙烯酸酯类杀菌剂残留量;国 外也有一些关于啶氧菌酯残留分析方法的报道, Steven 等[7]用气-质和液-质联用仪测定蔬菜和水果 中229 种农药(包括啶氧菌酯)残留,Pilar 等[8]用固相 微萃取前处理方法接合气-质联用仪测定婴儿食品 中甲氧基丙烯酸甲酯类杀菌剂的残留量。上述方法 在前处理、检测限及仪器设备等方面不能满足本文 研究的要求。有关啶氧菌酯在黄瓜和土壤样本中的 残留分析方法及其在土壤和黄瓜中的消解动态和规 律尚未见报道。
本文拟采用田间试验方法,研究250 g·L-1啶氧菌 酯悬浮剂在黄瓜上使用后,啶氧菌酯在黄瓜和土壤中 的消解动态及残留状况,为啶氧菌酯在黄瓜上最大残 留限量标准的制订及250 g·L-1啶氧菌酯悬浮剂在黄 瓜上科学合理地安全使用提供科学依据。 1 材料与方法 1.1 仪器设备
Aglient7890 型气相色谱仪,带氮磷检测器(NPD) (美国安捷伦科技公司);色谱柱:HP-5MS,30 m×320 μm×0.25 μm;Cleanet TPT 净化小柱(天津博纳艾杰尔 科技有限公司);T-25 basic ULTRA-TURRAX 高速植 物组织捣碎机(德国IKA 公司);Heidolph LABORO原 TA4000 型旋转蒸发仪(德国海道尔夫公司);ZHWY- 2102C 型调速多用振荡器(中国上海智诚分析仪器制 造有限公司);SL-302 电子天平(上海民桥精密科学 仪器有限公司);MILLI-Q 超纯水仪(美国Millipore 公司);SHZ-D(III)循环水式真空泵(巩义市予华仪器 有限公司)及抽滤装置等。 1.2 试剂
啶氧菌酯标准品(纯度为99.9%),由杜邦公司提 供;乙腈、甲苯、丙酮、无水硫酸钠、氯化钠均为分析纯。 1.3 田间试验 1.3.1 试验时间
该试验开展的起止时间为2013 年5 月至2013年9月。 1.3.2 气候条件及土壤类型
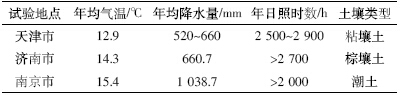
试验点选在天津市西青区、山东省济南市郊区 和江苏省南京市郊区。三地的气候条件及土壤类型 见表 1。
 |
按照《农药登记残留田间试验标准操作规程》进 行田间试验设计[9]。
黄瓜消解动态试验:小区面积20 m2,设3个重 复,施药剂量为900 g·hm-2,在黄瓜长至成果1/3 大 小时施药,对施药黄瓜进行标记。施药后2 h、1 d、 3 d、7 d、14 d、21 d和30 d 时在试验小区内随机采集 标记的黄瓜2 kg,切碎混匀后按四分法留样0.5 kg, 所有样品用塑料袋封装、编号,-20 ℃冰柜低温保存 待测。
土壤消解动态试验:在试验地附近选一10 m2表 面平整、墒情适中的空白地块进行土壤残留消解动态 试验研究,施药剂量为900 g·hm-2,与黄瓜上消解动 态试验同时进行。施药后2 h、1 d、3 d、7 d、14 d、21 d 和30 d以随机多点方式采集土壤(0~10 cm)2 kg,将 土壤样品去除杂物,充分碾磨后过1 mm 筛混匀,按四 分法各留样250 g,所有样品用塑料袋封装、编号,-20 ℃以下低温冰柜保存待测。
最终残留试验设2 个施药剂量,分别为低剂量 600 g·hm-2和高剂量900 g·hm-2,各设3 次和4 次施 药处理,2 次施药间隔为7 d,每处理试验小区面积20 m2,设3个重复。在最后一次施药后1、3 d和5 d在试 验小区内随机采集黄瓜2 kg,切碎,按四分法留样200 g。每小区采土壤(0~15 cm)2 kg,去除杂物后按四分法 留样200 g。所有样品用塑料袋封装、编号,-20 ℃冰柜 低温保存待测。 1.3.4 样品的制备
土壤样品充分混合去掉草根、小石块等一切杂 物,混匀经缩分后取样250 g;黄瓜样品切碎,经混匀 缩分后留样250 g。所有样品存于-20 ℃的冰箱中冻 存待分析。 1.4 分析方法 1.4.1 提取
土壤样品:称取20.0 g样品于磨口带塞三角烧瓶 中,加入5~10 mL水和60 mL 乙腈,静置过夜,振荡1 h。抽滤并用10 mL 乙腈洗涤滤渣,滤液转入500 mL 分液漏斗中,加入氯化钠使滤液水相饱和,取上层乙 腈相并过无水硫酸钠脱水,收集乙腈相于平底烧瓶 中,旋转蒸发浓缩至1~2 mL,氮气吹干,用丙酮定容 至5 mL,待测。
黄瓜样品:称取20.0 g样品于250 mL 烧杯中,加 入60 mL 乙腈,在高速植物组织捣碎机上捣碎匀浆 2~3 min,然后再超声提取10 min,抽滤,滤液转入500 mL分液漏斗中,加入氯化钠使滤液水相饱和,分取上 层乙腈相并过无水硫酸钠脱水,收集乙腈相于平底烧 瓶中,旋转蒸发浓缩至1~2 mL,氮气吹干,用2 mL 乙 腈/甲苯(3/1,V/V)混和液溶解残余物,待净化。 1.4.2 净化
用5 mL 乙腈/甲苯(3/1)预洗Cleanet TPT 柱,将 上述样品浓缩液转移至Cleanet TPT柱后,用2 mL 乙 腈/甲苯(3/1)洗涤样液瓶3 次,并将洗涤液移入柱中, 再用25 mL 乙腈/甲苯(3/1)淋洗小柱,收集上述所有 流出物于平底烧瓶中,在40 ℃水浴中旋转浓缩至近 干,氮气吹干。用丙酮定容至5 mL,待测。 1.4.3 色谱条件
检测器:氮磷检测器(NPD)。色谱柱:HP-5MS, 30 m×0.32 mm×0.25 μm。检测温度:汽化室,240 ℃; 检测器,320 ℃。柱温:100 ℃保持1 min,以8 ℃·min-1 的升温速率至250 ℃,保持0.5 min。气体流速:N2(载 气),3 mL·min-1;H2,3 mL·min-1;Air,120 mL·min-1。相 对保留时间:约16.15 min。 1.4.4 标准工作曲线的绘制
称取0.050 1 g(精确至0.000 1 g)啶氧菌酯标准 品,用丙酮溶解并配制成1 000 mg·L-1 的标准贮备 液,试验时再用丙酮逐级稀释成啶氧菌酯质量浓度分 别为0.01、0.02、0.05、0.1、0.5 mg·L-1 和1.0 mg·L-1的标 准溶液。在选定的气相色谱条件下测定,以标准工作 溶液浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准 工作曲线。 1.4.5 添加回收率与相对标准偏差
分别准确称取20.0 g空白黄瓜和空白土壤,向其 中各添加适量的标准溶液,使啶氧菌酯在黄瓜和土壤 中添加的3 个浓度分别为:0.005、0.05 mg·kg-1 和 0.25 mg·kg-1,按上述前处理方法进行样品的提取和净化,用GC-NPD 测定。 2 结果与讨论 2.1 方法学评价 2.1.1 线性范围
用丙酮配制不同浓度的啶氧菌酯标准溶液0.01、 0.02、0.05、0.1、0.5 mg·L-1 和1.0 mg·L-1,在上述检测 条件下进行分析测定,求出线性回归方程为:y= 136.14x+0.339 5,相关系数r=0.999 9。标准曲线见图 1,色谱图见图 2。
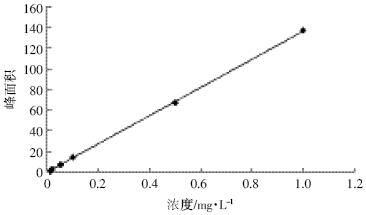
|
| 图 1 啶氧菌酯标准曲线图 Figure 1 Standard curve of picoxystrobin |
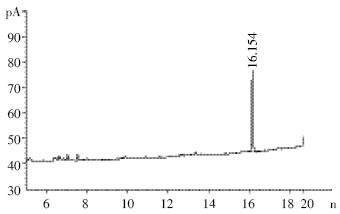
|
| 图 2 啶氧菌酯标准溶液色谱图(1.0 mg·L-1) Figure 2 Standard chromatogram of picoxystrobin(1.0 mg·L-1) |
在上述分析方法检测条件下,以3 倍信噪比计, 仪器对啶氧菌酯的最小检出量(LOD)为3.5×10-11 g; 本方法中,啶氧菌酯在黄瓜和土壤中添加回收的最低 浓度均可达到0.005 mg·kg-1,即啶氧菌酯在黄瓜和土 壤中的最低检出浓度(LOQ)也为0.005 mg·kg-1。啶氧 菌酯在黄瓜和土壤中的添加回收率见表 2。由表 2 可 见,对于2 种实验样品的3 个浓度添加5 个平行样 本,啶氧菌酯在黄瓜和土壤中的添加回收率分别为 68.61豫~113.1豫和78.98豫~122.4豫;变异系数分别为2.08豫~10.5豫和1.06豫~17.2豫,表明所建立方法的准 确度和精密度均较好,符合农药残留分析要求。添加 回收色谱图见图 3。
 |

|
| 图 3 啶氧菌酯气相色谱图 Figure 3 Chromatogram of picoxystrobin using GC |
分别比较了提取剂为乙酸乙酯、乙腈、丙酮的提 取效果。结果表明:除乙酸乙酯提取效率低于70%外, 其余均大于80%。虽然乙腈价格较高且对人体的危 害要强于丙酮和甲醇[10],含丙酮的提取剂虽然提取效 率较高,但杂质相对也较多,会给样品净化增加难度,在目标峰位置存在较大干扰,不能满足残留分析要 求。故最终选择乙腈作为提取剂。 2.2.2 净化方法
Cleanet TPT 柱填料是由石墨化炭等3 种材料按 照一定比例分层填装而成的分析茶叶中农药残留的 专用柱,先用5 mL 乙腈/甲苯(3/1)预洗,再用25 mL 乙腈/甲苯(3/1)淋洗小柱,能去除黄瓜中大部分色素、 糖分等杂质,净化效果理想。
从图 3可以看出,样品经过提取、净化后,啶氧菌 酯在保留时间左右无杂质干扰,说明净化效果较好,气相色谱的测定条件选择恰当。 2.3 啶氧菌酯在黄瓜和土壤中的消解动态
啶氧菌酯在黄瓜和土壤中的消解动态结果见表 3。结果表明:啶氧菌酯在天津、山东和江苏三地田间 试验的黄瓜中的消解率分别为95.45%、97.50%和 93.75%;土壤中的消解率分别为83.77%、89.51%和 78.12%。说明啶氧菌酯在黄瓜和土壤中能够得到较 快的消解,但是消解率存在差异,这与试验地的气候 条件、土壤类型等因素有关。此外值得注意的是,三地 黄瓜中啶氧菌酯的残留量在施药后3 d 均有较大的 下降,这可能是由于施药期间黄瓜质量和体积迅速增 长,其生长稀释因素在降低黄瓜中农药残留量方面也 起着重要的作用。在土壤动态试验中,出现后期采集 的土壤中啶氧菌酯的残留量比前期的高。这可能是由 于施药初期农药大都分布在土壤的表层(<1 cm),采 样时易出现误差,装袋时与包装袋的接触也会导致农 药的附着。而经过1~3 d农药在土壤中的沉降,农药 的分布也更趋于均匀,取样混样过程中农药的损失也 会大大减小。另外田间环境复杂,很多尚不清楚的因 素也可能导致土壤消解动态试验的数据异常。但整个 试验进程中农药的降解趋势还是很明显的。
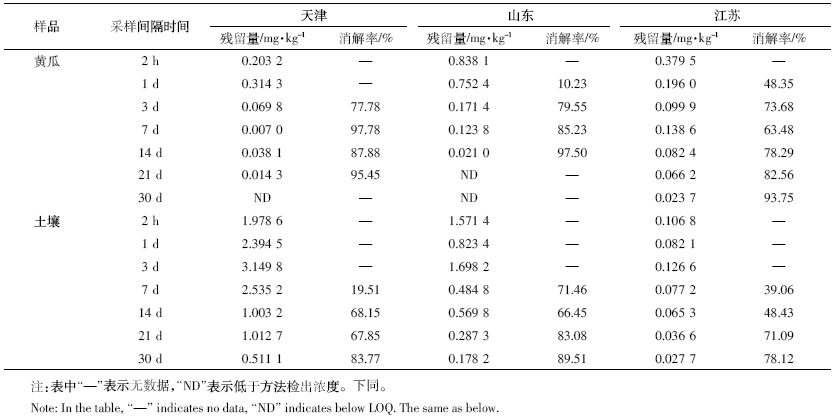
对啶氧菌酯在黄瓜和土壤中的残留消解数据进 行回归处理,结果见表 4。由表 4 可见,啶氧菌酯在黄 瓜和土壤中的残留消解动态均符合一级动力学反应模型,啶氧菌酯在黄瓜和土壤中的残留消解半衰期分 别为2.70~9.76 d和10.3~14.9 d。说明啶氧菌酯在黄 瓜和土壤中均属于易降解农药(T1/2<30 d)。
250 g·L-1 啶氧菌酯悬浮剂在黄瓜上的施药剂量 分别为低剂量600 g·hm-2 和高剂量900 g·hm-2,在黄 瓜生长到1/3 成果大小时开始第一次施药,各设3 次 和4次施药处理,2次施药间隔为7 d。距最后一次施 药1、3 d和5 d每小区随机采集黄瓜样品和土壤样品 进行残留测定。结果表明,距黄瓜最后一次施药5 d 时,啶氧菌酯在黄瓜和土壤中的最高残留量分别为 0.013 6 mg·kg-1和0.790 8 mg·kg-1。
我国和国际食品法典委员会(CAC)暂无啶氧菌 酯在黄瓜中的最大残留限量(MRL)的规定,欧盟2008年9 月规定啶氧菌酯在黄瓜中的最大残留限量0.05 mg·kg-1,暂以此规定为依据,250 g·L-1 啶氧菌酯悬浮 剂在黄瓜上的施药剂量分别为低剂量600 g·hm-2 和 高剂量900 g·hm-2,在黄瓜生长到1/3 成果大小时开 始第一次施药,各设3 次和4 次施药处理,2 次施药 间隔为7 d,距最后一次施药5 d时,黄瓜中啶氧菌酯 的残留量是安全的。 3 结论
(1)建立了采用GC-NPD测定黄瓜和土壤中啶氧 菌酯残留量的分析方法。方法操作简便,准确性及灵 敏度满足农药残留检测的要求。所使用的仪器设备均 为常规设备和试剂,适用性强,适合于大部分农药残 留检测实验室进行啶氧菌酯残留的检测。
(2)啶氧菌酯在黄瓜和土壤中的残留消解半衰期 分别为2.70~9.76 d和10.3~14.9 d。啶氧菌酯在黄瓜和 土壤中的残留消解半衰期存在一定的差异,这与在三 地施药后天气条件、土壤类型及理化性质等因素有关。
(3)以推荐施药剂量600 g·hm-2 和1.5 倍推荐施 药剂量900 g·hm-2,在黄瓜生长到1/3 成果大小时开 始第一次施药,各设3 次和4 次施药处理,2 次施药 间隔为7 d,距最后一次施药5 d时,啶氧菌酯在黄瓜 中的最高残留量低于欧盟2008 年9 月规定的啶氧菌 酯在黄瓜中的最大残留限量0.05 mg·kg-1(我国没有 相关的残留限量数据),由此表明,在该试验条件下, 啶氧菌酯在黄瓜中的残留是安全的。
| [1] | Tomlin C D S. The pesticide manual 13th ed[M]. British Crop ProtectionCouncil, 2003: 787. |
| [2] | 刘长令,李正名.Strobin 类杀菌剂的创制经纬[J].农药,2003 (3):43-46.LIU Chang-ling, LI Zheng-ming. Strobin fungicides create theodolite[J]. Agochemicals, 2003 (3): 43-46. (in Chinese) |
| [3] | 刘长令. Strobilurin 类杀菌剂[J]. 世界农药, 2002 (2): 16-19.LIUChang-ling.Strobilurinfungicides[J].WorldPesticides,2002 (2):16-19. (in Chinese) |
| [4] | 朱海霞, 杨新安, 张王兵, 等. 流动注射化学发光法测定啶氧菌酯[J].安徽工业大学学报: 自然科学版, 2011, 28 (4): 384-386, 391.ZHU Hai-xia, YANG Xin-an, ZHANG Wang-bing, et al. Determinationof picoxystrobin with the flow injection chemiluminescence method[J].Jof Anhui University of Technology: Natural Science, 2011, 28 (4): 384-386, 391. (in Chinese) |
| [5] | 段丽芳, 简 秋, 朴秀英, 等. 西瓜和土壤中啶氧菌酯残留分析方法[J]. 农药科学与管理, 2012, 33 (12): 38-40.DUAN Li-fang, JIAN Qiu, PIAO Xiu-ying, et al. Determination of pi-coxystrobinresiduesinwatermelonandsoil[J].Pesticide Science and Ad-ministration, 2012, 33 (12): 38-40. (in Chinese) |
| [6] | 王云凤, 葛宝坤, 高建会, 等. 液相色谱-质谱法测定果蔬中 8 种甲氧基丙烯酸酯类杀菌剂残留量[J]. 食品研究与开发, 2009, 30 (4):130-133.WANG Yun-feng, GE Bao-kun, GAO Jian-hui, et al. Determination of8 strobilurins in fruits and vegetables by liquid chromatography-massspectrometer[J].FoodResearchand Development, 2009, 30 (4): 130-133.(in Chinese) |
| [7] | Steven J Lehotay, Andr佴 de Kok, Maurice Hiemstra, et al. Validation of afast and easy method for the determination of residues from 229 pesti-cides in fruits and vegetables using gas and liquid chromatography andmass spectrometric detection[J]. Journal of AOAC International, 2005, 88(2): 595-614. |
| [8] | Pilar Vinas, Natalia Campillo, Nelson Mart-nez-Castillo, et al. Methoddevelopment and validation for strobilurin fungicides in baby foods bysolid-phase microextraction gas chromatography-mass spectrometry[J].Journal of Chromatography A, 2009, 1216(1): 140-146. |
| [9] | 农业部农药检定所. 农药登记残留田间试验标准操作规程[M]. 北京:中国标准出版社, 2007: 3-10, 123-127.Institute for the Control of Agrochemicals. Standard operating proce-dures on the pesticide registration residue field trials[M]. Beijing: ChinaStandard Press, 2007: 3-10, 123-127. (in Chinese) |
| [10] | 秦 旭, 孙 扬, 徐应明, 等. 噻呋酰胺在马铃薯和土壤中检测方法及残留动态研究[J]. 农业资源与环境学报, 2013, 30 (6): 83-86.QIN Xu, SUN Yang, XU Ying-ming, et al. Residue determination anddegradation of thifluzamide in potato and soil[J]. Journal of AgriculturalResources and Environment, 2013, 30 (6): 83-86.(in Chinese) |
 2014, Vol. 31
2014, Vol. 31