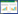文章信息
- 宫福强, 包姣灵, 王迎春, 吕晓宁, 孙梦雪, 李清波
- GONG Fu-qiang, BAO Jiao-ling, WANG Ying-chun, LV Xiao-ning, SUN Meng-xue, LI Qing-bo
- 高脂肪样品中PCBs和OCPs分离方法研究
- A Method for Separating PCBs and OCPs in Biota Samples
- 农业资源与环境学报, 2014, 31(5): 461-469
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0163
-
文章历史
- 收稿日期:2014-06-23
2. 大连海事大学环境科学与工程学院,辽宁 大连 116026
2. Department of Environmental Science and Engineering,Dalian Mar- itime University,Dalian 116026,China
多氯联苯(polychlorinated biphenyls,PCBs)是联 苯苯环上的氢被氯取代而形成的,对生物体有积蓄性 毒害作用的一类持久性有机污染物。有机氯农药 (organochlorine pesticide,OCPs)是一类人工合成的杀 虫广谱、毒性较强、残效期长的化学杀虫剂。二者均为 国际上关注的持久性有机污染物(POPs),都具有高 毒性、半挥发性和亲脂性和生物累积性等特点,因此 易被脂肪组织吸收。POPs通过食物链传递,可在浮游 生物、鱼类、哺乳类动物,以及处于食物链顶端的人类 体内富集,浓度可以达到环境背景浓度的1 万倍[1]。 POPs 对生物体具有致癌、致畸、致突变的“三致效 应”,严重影响了生态平衡和人类的生命安全[2, 3, 4]。近年 来,大气中持久性有机污染物的分析研究工作受到 世界各国的重视,相关的文献报道较多[5, 6, 7, 8]。我国针对 POPs 在大气中分布特征的研究起步相对较晚,且相 对较少。高脂肪食品PCBs 和OCPs 的污染直接影响 了海产品安全从而危及人类健康,因此,高脂肪含量 样品PCBs 和OCPs 的快速检测方法一直受到广泛的 关注。
现阶段技术条件下对高脂肪含量样品预处理过 程中净化阶段主要有固相萃取(SPE),凝胶渗透色谱 (GPC)和层析色谱分离法3 种常用方法。固相萃取 (SPE)过程可分为吸附和洗脱两个部分。在吸附过程 中,目标物质被选择性地吸附在吸附床上进行了富 集。该方法存在个别组分定量回收不全,分析结果不 够稳定,相对标准偏差不稳定的缺点[9],不能用于萃取 沸点高于溶剂脱附温度的不完全挥发性物质或非挥 发性物质,应用受到一定限制等缺点[10]。凝胶渗透色 谱(GPC)的核心是一根化学惰性的中空小球填充而成的柱子,样品随流动相流经填料时,大分子物质由 于无法进入小球的微孔而导致流经行程比小分子的 短,先于流出,分子最小的最后流出。GPC对于PCBs、 OCPs等小分子物质的分离效果一般,且系统的设备 体积较大,设备成本较高,使用运行成本也较高,难以 大范围推广。层析色谱分离法,利用层析色谱分离柱 中填料物质吸附待测目标物质,去除杂质,而后使用 洗脱液洗脱分离柱,将待测目标物质洗脱出,从而实 现从提取液中分离净化出待测目标物的目的。柱层析 法虽具有较好的回收率和净化效果,但对于其中一些 成分的净化效果不够理想,如有机氯农药(OCPs)中 带有一定极性的甲氧氯和δ-六六六,回收率会变差, 常规改善的途径是加大洗脱剂的用量,或适当增加洗 脱剂的极性强度,造成溶剂用量大,分离时间长等缺 点[11]。对于高脂肪含量样品,基质复杂,组织样品中含 有色素类物质,需要开发对多数动物组织样品同时有 很好的分离效果、使用溶剂量少、分离周期短的分离 净化方法。
本研究开发的层析色谱分离柱的填料,适用于分 离高脂肪含量样品中PCBs 或OCPs 的方法。采用不 同吸附性质的混合填料,使高脂肪含量样品中的非 目标物质吸附于分离柱填料上,使目标物透过分离 柱,实现目标物与非目标物(杂质)分离的目的,从而 快速、准确地分离高脂肪样品中PCBs 和OCPs 混合 物,为分离高脂肪含量样品中PCBs 或OCPs 提供方 法依据。 1 材料与方法 1.1 材料 1.1.1 仪器设备
超声仪(KQ-500DE),旋转蒸发仪(EYELA SB- 2000,上海爱郎仪器有限公司),氮吹仪(EYELA MG- 2200),气相色谱(GC-ECD 5890N,美国Agilent), DB35-MS 色谱柱(J&W Scientific 30 m×0.25 mm×0.25 μm),色谱分离仪(CHRO-400,赛茨科技大连有限 公司)。 1.1.2 试剂
石油醚、丙酮、正己烷、二氯甲烷等(均为色谱 纯),硅胶(200~300 目),浓硫酸改性硅胶(100~200 目)、无水硫酸钠、中性氧化铝(100~200 目)、佛罗里 硅土(60~100 目)。 1.1.3 标品
21种多氯联苯(PCBs)(Accustandard),22 种有机 氯(OCPs)(Accustandard)。 1.1.4 填料
硅胶-弗罗里硅土(Florisil)混合物30%~35%、浓 硫酸改性硅胶50%~60%和无水硫酸钠10%~15%组 成;其中硅胶-弗罗里硅土混合物中硅胶与弗罗里硅 土的质量比为1:1,浓硫酸改性硅胶中浓硫酸与硅胶 的质量比为45:55。在上述填料中物质需分别经预处 理活化后再按配比混合均匀或用于改性。 1.1.5 样品采集
本研究调查了脊索动物门鱼类样品4 种(小黄鱼 Pseudosciaena polyactis、黑鱼 Channidae、鳙鱼 Aristichthys nobilis、箭头鱼 Callionymus beniteguri);样品 采集地点包括辽东半岛海域的营口、旅顺、庄河和锦 州4个港口,样品采集后用自封袋密封,冷冻保存,直 至分析。 1.1.6 仪器分析条件的确定
进样口温度240℃;检测器温度:300℃;升温程 序:80℃不保持,以24 ℃·min-1升高到200℃保持1 min,再以5 ℃·min-1 升高到280℃保持13 min;不分 流进样;载气为高纯氮气,恒流方式1 mL·min-1。 1.2 方法 1.2.1 鱼脂肪组织中PCBs和OCPs提取方法
称取小黄鱼脂肪组织样品(样品实验前经冷冻干 燥处理)分为实验组1 和实验组2,实验组1 设8 个 平行试验,实验组2 设4 个平行试验。各实验组分别 加入5 g鱼脂肪组织于三角烧瓶中,其中实验组1 的 三角烧瓶中再加入浓度为100 μg·L-1的PCBs或OCPs 混标溶液1 mL。实验组1 和实验组2 的三角烧瓶中 分别加入丙酮/石油醚(V1/V2=1:1)20 mL,在25℃、超 声波提取15 min 后收集提取液,将提取液通过放有 无水硫酸钠的漏斗过滤,收集于三角烧瓶中。再用少 量丙酮/石油醚(V1/V2=1:1)溶液冲洗漏斗中无水硫酸 钠,重复上述提取过程3 次,合并所有提取液。将提取 液在60℃水浴中旋转蒸发浓缩至1 mL 左右,得待测 样品。 1.2.2 鱼脂肪组织中PCBs和OCPs净化方法 1.2.2.1 仪器方法
仪器方法即采用自主研发的四通道色谱净化仪, 工作系统处于密闭状态,可以同时净化4 个样品[12]。 净化溶剂置于2 L棕色试剂瓶中,瓶口密封,防止溶 剂挥发。仪器可产生恒定的正压力,将固定体积的溶 剂通过导液管压入色谱分离净化柱中。色谱净化柱为 长22.7 cm,直径10 mm的玻璃柱,经安装口固定在仪 器内部,上端与导液管相连,下端通过直径为1 mm 的小孔与收集瓶相连。净化过程中,仪器真空泵产生 恒定负压状态,使固定体积的净化溶剂以恒定速率通 过色谱净化柱进入收集瓶,快速净化、洗脱目标污染 物[13, 14, 15]。
具体操作规程如下:将3 g硅胶-弗罗里硅土混 合物、5 g浓硫酸改性硅胶、1 g无水硫酸钠,依次填装 于垂直放置的赛茨四通道色谱分离仪分离柱(分离 柱内径为10 mm,长度为230 mm,末端放有筛板防止 填料漏出)中,其在分离柱中分别形成下层、中间层和 上层。干法装柱,装柱时将填料自然放置于分离柱中 即可,不需压实。装柱后,负载填料的床直径/床高为 1:16。分离柱上端单次加入2 mL 正己烷-二氯甲烷 (100:0),在洗脱压力75 kpa下洗脱,洗脱时间为47 s, 反复洗脱6~8 次,使分离柱达到平衡。
待分离柱平衡后向分离柱上端缓慢添加PCBs 或OCPs混标溶液1 mL,用正己烷-二氯甲烷体积比 为100:0 的混合溶液洗脱,洗脱压力为75 kpa,每次 洗脱时间为70 s,每次加2 mL的洗脱液,共收集8 次 洗脱液共计16 mL于同一个收集管中;将16 mL 洗脱 液在60℃水浴中旋转蒸发浓缩至1 mL 左右,用氮气 吹干,再加入1 mL 正己烷溶解后再次用氮气浓缩,反 复3次后用正己烷定容至1 mL。
分离鱼脂肪组织中PCBs混合物和OCPs 混合物 样品则将提取后得到的各实验组的待测样品分别全 部添加至平衡后的分离柱上端,用以上方法分离。 1.2.2.2 常规方法
常规方法即采用柱层析法,分离方法参见1.2.2.1, 其中分离过程为将分离柱垂直夹在铁架台上分离。 1.2.3 测定
将得到的待测样品溶液用气相色谱仪(GC-ECD) 测定,并计算PCBs混标和OCPs 混标溶液中各成分 的回收率。 1.3 回收率和相对标准偏差计算方法 1.3.1 填料加标回收率和相对标准偏差计算方法
加标回收率计算方法如式(1):


相对标准偏差(RSD)计算方法如式(3):

未加标鱼样中目标物色谱峰面积平均值=

回收率=(加标鱼样中目标物色谱峰面积-未加标 鱼样中目标物色谱峰面积平均值)/标准样品中目标 物色谱峰面积×100%
STD计算方法同式(2),RSD计算方法同式(3)。 2 结果与分析 2.1 PCBs和OCPs常规法 2.1.1 鱼脂肪组织中PCBs混合物的分离
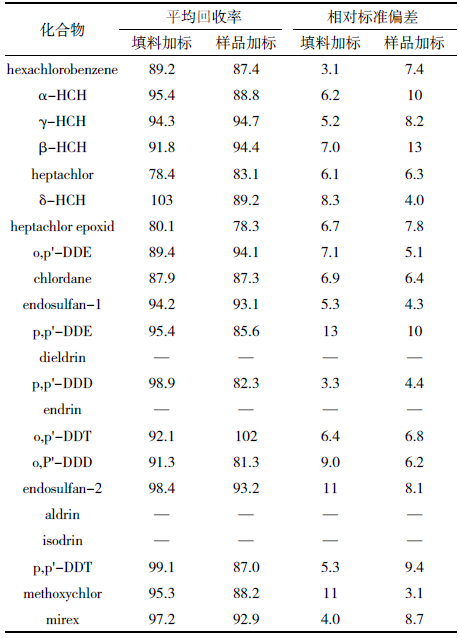
从表 1可知,填料在不使用色谱分离仪的条件下, 21 种PCBs 回收率在81.3%~104%之间,RSD 小于 8.1%。符合US-EPA(Method3550,3500b,3500c,3535a, 3600c,3620b 等)标准及中国国标(GB/T 9695.10— 2008,GB/T 5009.19—2008,GB/T 5009.190—2006 等) 要求,能够实现对鱼脂肪组织中PCBs 的分离净化和 杂质(脂肪)起到净化作用,尤其能对脂肪起到消除作 用,重现性良好,填料不使用色谱分离的情况下仍能 获得良好的回收率,但是较仪器条件下略低。重现性 稳定,可以对鱼类组织等高脂肪含量样品中PCBs 的 分离净化。
 |
采用本填料的分离柱在不使用色谱分离仪的条 件下分离22种OCPs化合物,其中18种OCPs化合物 回收率良好,aldrin、isodrin、dieldrin 和endrin 4种物质 受浓硫酸磺化作用损失严重,回收率较低,不能实现分 离目的(表 2)。填料能够对其中18种物质起到良好的 分离净化效果,回收率在70.3%~104%之间,RSD值小 于6.2%,符合US-EPA(Method3550,3500b,3500c, 3535a,3600c,3620b 等) 标准及中国国标(GB/T 9695.10—2008,GB/T 5009.19—2008,GB/T 9675—1998等)。分离柱性质稳定,重现性良好,可以用于鱼 脂肪组织等高脂肪含量样品中OCPs的分离净化。
 |
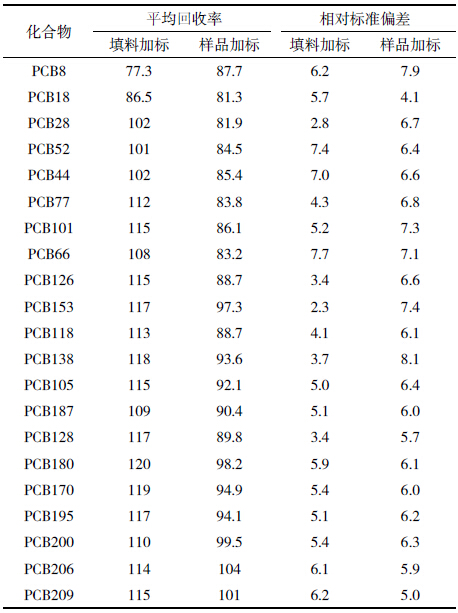
从表 3可知,采用该填料的分离柱分离以上21种PCBs化合物,能够得到良好的分离净化效果,回收率 在96.4%~119%之间,RSD值小于8.3%,符合USEPA( Method3550,3500b,3500c,3535a,3600c,3620b 等) 标准及中国国标(GB/T 9695.10-2008,GB/T 5009.19-2008,GB/T 9675-1998 等)。分离柱性质稳 定,重现性良好,可以用于含PCBs样品的分离净化。
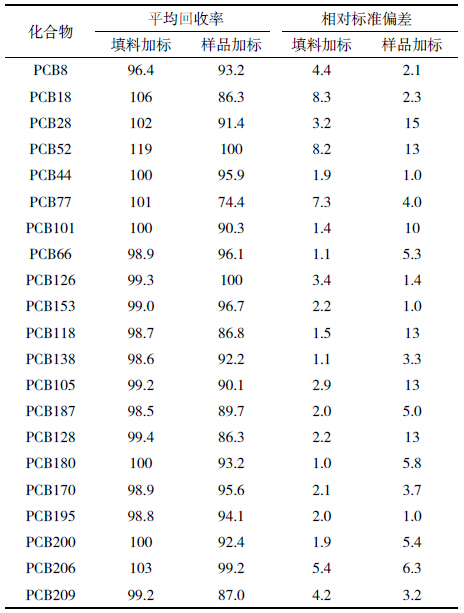 |
从表 3可知,采用本研究填料的分离柱分离鱼脂 肪组织中21 种PCBs 化合物,能够得到良好的分离 净化效果,回收率在74.4%~100%之间,RSD值小于 15%,符合US-EPA(Method3550,3500b,3500c,3535a, 3600c,3620b 等)标准及中国国标(GB/T 9695.10— 2008,GB/T 5009.19—2008,GB/T 9675—1998 等)。分 离柱能够对鱼脂肪组织中PCBs 起到分离净化作用, 并且能够排除鱼脂肪组织中其他物质(脂肪)的干扰 作用,实现对PCBs 化合物的针对性净化分离,重现 性良好,可以用于鱼脂肪组织等高脂肪含量样品中 PCBs的分离净化。PCBs标准物质和鱼脂肪样品气相 色谱图如图 1、图 2所示。
|
| 图 1 PCBs标准样品图谱 Figure 1 Standard spectrogram of PCBs |
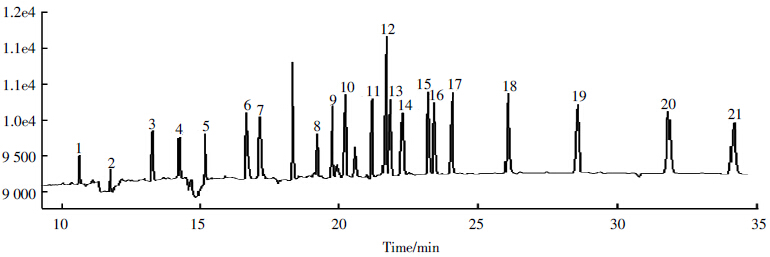
|
| 图 2 PCBs鱼脂肪组织样品图谱 Figure 2 PCBs fat tissue samples spectrogram |
从表 4 可知,采用本研究填料的分离柱分离22 种OCPs 化合物,其中18 种OCPs 化合物回收率良 好,aldrin、isodrin、dieldrin 和endrin 4种物质受浓硫 酸磺化作用损失严重,回收率较低,不能实现分离目 的。填料能够对其中18 种物质起到良好的分离净化 效果,回收率在78.4%~103%之间,RSD值小于11%, 符合US-EPA(Method3550,3500b,3500c,3535a, 3600c,3620b 等)标准及中国国标(GB/T 9695.10— 2008,GB/T 5009.19—2008,GB/T 9675—1998等)。分 离柱性质稳定,重现性良好,可以用于鱼类组织等高 脂肪含量样品中OCPs的分离净化。
 |
从表 4 可知,采用本研究填料的分离柱分离22 种OCPs 化合物,其中18 种OCPs 化合物回收率良 好,aldrin、isodrin、dieldrin 和endrin 4种物质受浓硫 酸磺化作用损失严重,回收率较低。填料能够对其中 18 种物质起到良好的分离净化效果,回收率在78.3%~102%之间,RSD值小于13% ,符合US -EPA (酝ethod-3550,3500b,3500c,3535a,3600c,3620b 等) 标准及中国国标(GB/T 9695.10—2008,GB/T 5009.19—2008,GB/T 9675—1998 等),分离柱性质稳 定,重现性良好,可以用于鱼类组织等高脂肪含量样 品中OCPs 的分离净化。OCPs 标准物质和鱼脂肪样 品气相色谱图如图 3、图 4所示。
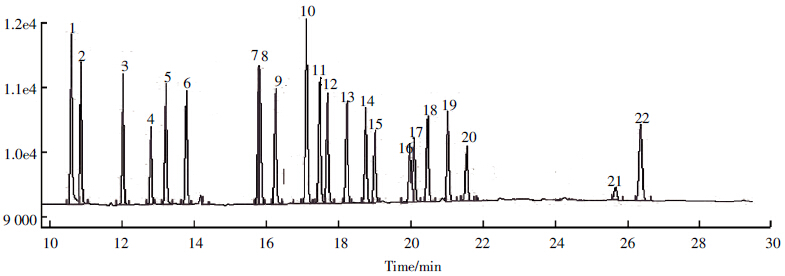
|
| 图 3 OCPs标准样品图谱 Figure 3 OCPs standard spectrogram |

|
| 图 4 OCPs鱼脂肪组织样品图谱 Figure 4 OCPs fat tissue samples spectrogram |
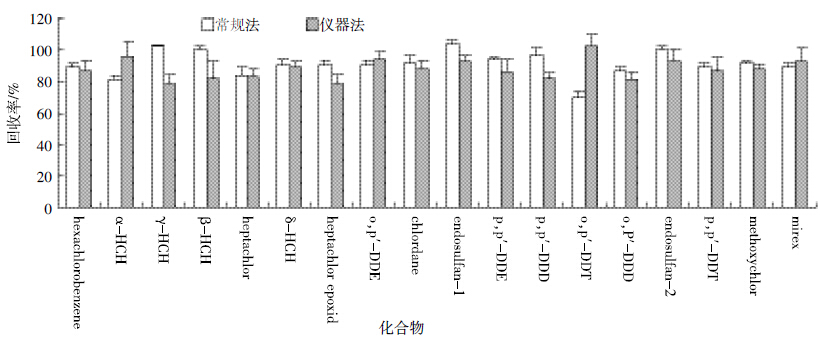
选用常规法、仪器法分别对鱼类样品进行净化 (图 5),结果显示,四通道色谱分离仪净化法相较于 层析柱法,明显缩短了单个样品平均净化时间,且消 耗溶剂的体积最少,回收率也更高(表 5)。且采用本 方法洗脱液对分离柱进行洗脱,将目标物有选择性地洗脱出。同时,酸性改性硅胶可以对样品中的脂肪碳 化消除干扰,弗罗里硅土对样品中色素进行吸附,排 除干扰,实现了分离柱填料对高脂肪样品中PCBs 或 OCPs的高选择性分离净化,减少了对干扰物洗脱这 一阶段而直接对目标物进行洗脱,提高分离效果和回 收率。使用发明的填料及流动相,常规方法下21 种 PCBs 的基质加标回收率在81.3%~104%之间,仪器 法21 种PCBs 的基质加标回收率在74.4%~100%之 间。仪器法分离PCBs回收率较常规法更稳定。

|
| 图 5 不同方法下PCBs的回收率 Figure 5 The recovery rate of PCBs under different methods |
选用常规法、仪器法分别对鱼类样品进行净化 (图 6),结果显示,常规法OCPs的基质加标回收率在 70.3%~104%之间,仪器法OCPs 的基质加标回收率 在78.3%~102%之间。仪器法分离OCPs较常规法缩 短了净化时间,减少了消耗溶剂和收集的洗脱液体 积,且回收率更高。
|
| 图 6 不同方法下OCPs的回收率 Figure 6 The recovery rate of OCPs under different methods |
由表 6 可见,使用该填料,仪器方法检测辽东半 岛海域鱼脂肪组织,其中21 种PCBs 共检出17 种, 检出率较高,其中小黄鱼和黑鱼为PCB187 残留量最 高,分别为40.53、44.37 μg·kg-1;鳙鱼PCB180 残留量 最高,为10.73 μg·kg-1;箭头鱼PCB8 残留量最高,为 3.63 μg·kg-1。结果表明该填料能够对其中21 种OCPs 化合物起到良好的分离净化效果,可用于鱼脂肪组织 PCBs残留量的检测。
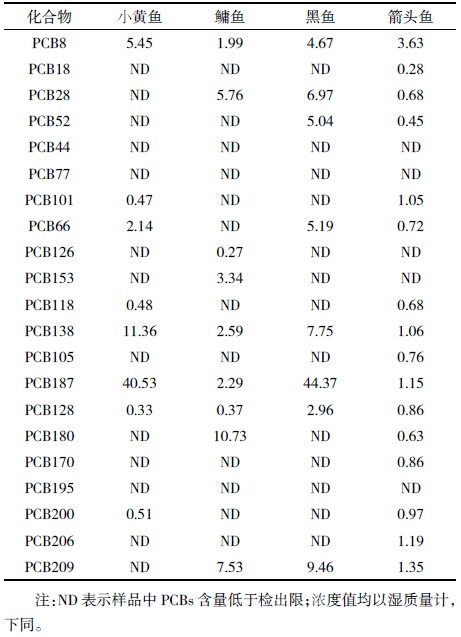 |
由表 7 可见,使用该填料,仪器方法检测辽东半 岛海域鱼脂肪组织,其中22 种OCPs 共检出14 种, 检出率较高,其中小黄鱼p,p'-DDD 残留量最高,为 67.04 μg·kg-1;鳙鱼、黑鱼、箭头鱼均为δ-HCH 残留 量最高,分别为90.79、174.62、45.58 μg·kg-1。结果表 明该填料能够对其中22 种OCPs 化合物起到良好 的分离净化效果,可用于鱼脂肪组织OCPs残留量的 检测。
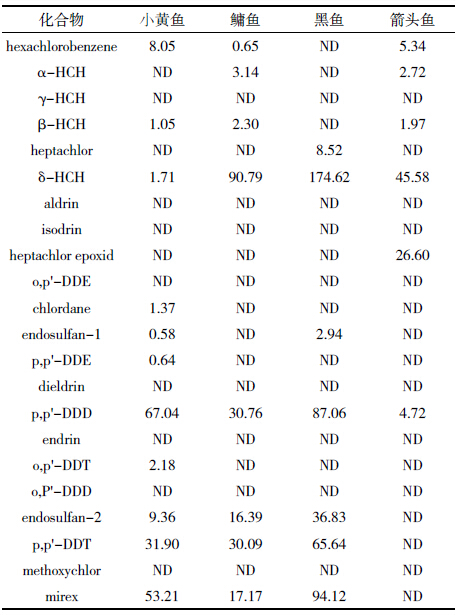 |
本研究在美国EPA 方法和现有的PCBs 和OCPs检测方法的基础上,开发了用于分离PCBs 或OCPs 的填料,并采用柱层析法和赛茨四通道色谱分离仪法 进行层析色谱分离,分离方法具有高效、快速、工艺简 单、成本低的特点,符合EPA 有关方法回收率和相对 标准偏差的限定要求。对于动物组织中的21种PCBs 或18 种OCPs 均有很好的分离效果和回收率,其成 分范围覆盖了目前动物样品中常见的大部分PCBs 和OCPs 化合物。PCBs 化合物柱回收率可达96.4%~ 119%,对鱼脂肪组织加标回收率可达74.4%~100%; OCPs 化合物柱回收率可达78.4%~103%,对鱼脂肪 组织加标回收率可达78.3%~102%。结果表明该填料 可用于分离PCBs 或OCPs。本研究的方法适用于多 种高脂肪含量样品中PCBs 和OCPs 化合物的分离与 检测。
| [1] | 汪 雨. 土壤和水中有机氯农药的分析方法研究[D].长春: 吉林农业大学, 2006.WANG Yu. Method for analysis of organochlorine pesticides in soil andwater[D]. Changchun: Jilin Agricultural University, 2006. (in Chinese) |
| [2] | 李燕群, 张 渝, 钱 蜀, 等. 全二维气相色谱-质谱法定性分析土壤中有机氯农药、 酞酸酯和多氯联苯[J]援 分析试验室, 2013 (2):109-113.LI Yan-qun, ZHANG Yu, QIAN Shu, et al. Comprehensive two-dimen-sional gas chromatography-mass spectrometry qualitative analysis oforganochlorine pesticides, phthalates and polychlorinated biphenyls insoil comprehensive two-dimensional gas chromatography[J]. Analysis ofthe Test Chamber, 2013 (2): 109-113. (in Chinese) |
| [3] | 刘 祥, 崔 进, 佟丽丽, 等. 食品印刷包装材料中多氯联苯的气相色谱-串联质谱法测定及其基质效应探讨[J]援 分析试验室, 2014 (1):30-34.LIU Xiang, CUI Jin, TONG Li-li, et al. Determination by gas chromatog-raphy tandem mass spectrometry and discussion of matrix effects ofpolychlorinated biphenyls in food's printing and packaging materials[J].Analysis of the Test Chamber, 2014 (1): 30-34. (in Chinese) |
| [4] | 李丽君, 王 娜, 王海娇, 等. 索氏提取-气质联用同时测定土壤中 7种多氯联苯[J]. 分析试验室, 2009 (S2): 4-7.LI Li-jun, WANG Na, WANG Hai-jiao, et al援 Determination of 7 poly-chlorinated biphenyls in soil through the method of soxhlet extractionand GC-MS[J]. Analysis of the Test Chamber, 2009 (S2): 4-7 (in Chi-nese) |
| [5] | Jaward F M, Farrar N J, Harner T, et al. Passive air sampling of PCBs,PBDEs, and organochlorine pesticides across Europe[J]. Environ SciTechnol, 2004, 38 (1): 34-41. |
| [6] | H ayakawa K, Taka tsuki H, Watanabe I, et al. Polybrominated diphenylethers (PBDEs), polybrominated dibenzo-p-dioxins/dibenzofurans(PBDD/Fs) and monobromo -polychlorinated dibenzo -p -dioxins/dibenzofurans (MoBPXDD/Fs)in the atmosphere and bulk depositionin Kyoto, Japan[J]. Chemosphere, 2004, 57 (5): 343-356. |
| [7] | Shen L, Wania F, Lei Y D, et al. Polychlorinated biphenyls and poly-brominated diphenyl ethers in the North American atmosphere[J]. Envi-ronmental Pollution, 2006, 144 (2): 434-444. |
| [8] | Cleverly D, Ferrario J, Byrne C, et al. A general indication of the con-temporary background levels of PCDDs, PCDFs and coplanar PCBs inthe ambient air over rural and remote areas of the United States[J]. Env-iron Sci Technol, 2007, 41 (5): 1537-1544. |
| [9] | 姚子伟, 赵冬梅, 马新东, 等.海水中痕量有机污染物分析前处理技术研究进展[J].海洋环境科学, 2011 (3): 447-450.YAO Zi-wei, ZHAO Dong-mei, MA Xin-dong, et al.Progress in thepretreatment technique of trace organic pollutants in seawater[J]. TheMarine Environment and Science, 2011 (3): 447-450.(in Chinese) |
| [10] | 曹 菱, 王焰新. 环境有机污染物检测的前处理技术的进展[J]. 实验技术与管理, 2009 (3): 228-230.CAO Ling, WANG Yan-xin. Progress in the pretreatment technique forthe detection of organic pollutants in the environment[J]. ExperimentalTechnology and Management, 2009 (3): 228-230. (in Chinese) |
| [11] | 董 亮, 王秀琴, 张烃, 等. 环境介质中有机污染物分析前处理方法概述[J]. 现代科学仪器, 2010 (5): 120-125.DONGLiang,WANGXiu-qin, ZHANGTing, et al. Pretreatment methodof analysis of organic pollutants in environmental media[J]. Modern Sci-entific Instruments, 2010 (5): 120-125. (in Chinese) |
| [12] | 李清波,骆永明援四通道色谱分析仪[P].2004200542365.2006-08-16.LI Qing-bo, LUO Yong-ming. Four channel chromatographic separa-tion instrument[P]. 2004200542365. 2006-08-16. (in Chinese) |
| [13] | Li Q B, Wang X Y, Song J, et al. Seasonal and diurnal variation in con-centrations of gaseous and particulate phase endosulfan[J]. Atmospher-ic Environment, 2012, 61: 620-626. |
| [14] | 隋 红, 吴 鹏, 宋 静, 等援 土壤样品中低浓度滴滴涕分析方法的前处理研究[N]. 分析测试学报, 2013 (11): 1369-1373.SUI Hong, WU Peng, SONG Jing, et al.Study on the pretreatmentanalysis method of low concentration of DDT in soil sample[J]. Journalof Instrumental Analysis, 2013 (11): 1369-1373.(in Chinese) |
| [15] | Field J A, Sierra-Alvarez R. Microbial transformation and degradationof polychlorinated biphenyls review[J]. Environmental Pollution, 2008,155 (1): 1-12. |
 2014, Vol. 31
2014, Vol. 31