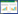文章信息
- 田爽, 田方方, 王晓萍
- TIAN Shuang, TIAN Fang-fang, WANG Xiao-ping
- 4株苯磺隆降解菌的分离鉴定及其生长特性
- Isolation, Identification and Growth Characteristics of Four Tribenuron-methyl Degrading Bacterias
- 农业资源与环境学报, 2014, 31(5): 437-445
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0153
-
文章历史
- 收稿日期:2014-06-06
苯磺隆(Tribenuron-methyl),又名麦乐乐、苯黄隆、巨星(杜邦)、亿力、阔叶净、麦磺隆等,是20 世纪80 年代由美国杜邦公司开发的一种内吸传导型磺酰脲类麦田除草剂[1, 2, 3, 4],主要用于防除各种一年生阔叶杂草,对播娘蒿、荠菜、碎米荠菜、麦家公、藜、反枝苋等效果较好,对地肤、繁缕、蓼、猪殃殃等也有一定的防除效果,对田蓟、卷茎蓼、田旋花、泽漆等效果不显著,对野燕麦、看麦娘、雀麦、节节麦等禾本科杂草没有效果[5, 6]。苯磺隆在我国长江、黄河和淮河流域有着广泛的使用范围。苯磺隆的大量使用,给土壤、水体、生物及大气等诸多环境因子造成大量污染,影响农业生产和生态平衡[7, 8, 9]。因此,解决苯磺隆的残留问题对改善除草剂对作物的药害,修复受除草剂污染的土地有重要的理论意义和实际价值。
在生态系统中,作为分解者的微生物,代谢类型多样,适应环境的能力极强,能利用各种人工合成的农药作为碳、氮源生长,并将其完全降解成无机物。微生物降解技术安全、快速、费用低廉,大量研究已经证明微生物对农药的降解是一种行之有效的修复方法,对农业生产及环境保护具有极其重要的现实和理论意义。
目前,国内外关于苯磺隆的研究主要集中在田间药效、残留分析方法研究及其对植物生理特性的影响等方面[7, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18]。对能够降解苯磺隆的菌种的分离、鉴定和生长特性的研究目前还很少[19, 20, 21]。Zhang[20]筛选出一株能够降解苯磺隆的降解菌,经其初步鉴定为假单胞菌(Pseudomonas sp.),可以在5 d 内降解200 mg·L-1的苯磺隆,降解效率达到80%。王惟帅等[21]筛选出一株能够降解苯磺隆的降解菌,并对其生长特性进行研究。就所查资料,尚未发现国外在苯磺隆降解菌方面的研究报道。
本研究以山东地区长期施用苯磺隆除草剂的麦田土壤为试验材料,分离筛选出对苯磺隆有降解活性的菌株,并通过形态学特征、生理生化特性和16SrDNA序列分析进行分类鉴定,并研究了降解菌的生长特性,以期为苯磺隆微生物降解的深入研究和苯磺隆降解菌的产业化利用提供理论依据。 1 材料与方法 1.1 实验材料 1.1.1 供试土壤
山东省菏泽单县长年(至少4 年)施用苯磺隆的农田土壤,取土表及以下5~15 cm 的耕层土壤,过40目筛备用。 1.1.2 培养基
无机盐培养基(MSM,g·L-1):2.0(NH4)2SO4,0.2MgSO4·7H2O,0.5 NaH2PO4,0.1 CaCl2,0.5 K2HPO4,pH7.0。LB 培养基(g·L-1):10.0 蛋白胨,5.0 酵母粉,5.0NaCl,pH 7.0~7.2。 1.1.3 农药
10%可湿性粉剂(安徽金泰农药化工有限公司)。 1.1.4 主要试剂
胶回收试剂盒(博大泰克公司)、卡那霉素(Kan)、氨苄青霉素(Amp)、链霉素(Str)、四环素(Tet)、红霉素(Ery)、庆大霉素(Gen)和氯霉素(Dhl)。 1.1.5 主要仪器
pH 计(Beckman,美国)、紫外分光光度计(U2008,日本)、低温冷冻离心机(BeckmanAllegra 21R,美国)、PCR 扩增仪(PTC-100,MJRearch,美国)。 1.2 苯磺隆降解菌株的富集与分离纯化
取10 g备用土壤放入装有100 mL 无菌生理盐水的250 mL 三角瓶中,加入适量的玻璃珠,摇床振荡约1 min,使样品与水充分混合,将细胞分散,形成均匀的菌悬液。以10%的接种量接到含100 mg·L-1苯磺隆的100 mL 无机盐培养基中,置于30 ℃、150 r·min-1的恒温摇床中振荡培养7 d。每周移种1次,以接种量10%接入到新鲜的无机盐培养基溶液中,苯磺隆浓度以100 mg·L-1的梯度递增,至培养基中苯磺隆浓度达到500 mg·L-1。将最终所得的降解菌溶液用无菌水稀释成10倍,取0.1 mL涂布到牛肉膏蛋白胨培养基上,置于35℃培养箱中培养2 d,待生长茂盛后挑取单菌落,在培养基上反复多次划线分离、纯化。经初筛、复筛和纯化后,将分离的降解菌接种于LB 斜面培养基上,编号,置于4 ℃条件下冷藏保存备用。 1.3 苯磺隆降解菌的鉴定 1.3.1 降解菌的形态观察及生理生化鉴定
用平板涂布法将富集和纯化后的苯磺隆降解菌接种,在恒温培养箱中30 ℃培养12~16 h后用电子显微镜观察菌体形态。生理生化鉴定方法参见文献[22]。 1.3.2 降解菌的分子鉴定
采用CTAB法提取降解菌总DNA,16S rDNA引物设计参见文献[23]。F8/20:5'-AGA GTT TGA TCC TGGCTC AG-3';F1541/20:5'-AAG GAG GTG ATC CAGCCG CA-3'。
扩增反应体系为:10×Buffer(Mg2+)5 μL,dNTPs(2 mmol·L-1)3 μL,引物(20 μmol·L-1)各1 μL,菌体DNA(约50mg·L-1)1 μL,Taq DNA聚合酶(5U·μL-1)0.5 μL,加ddH2O 至50 μL。PCR 反应条件: 95 ℃5 min,94 ℃30s,52℃30s,72℃90s,30个循环,72℃10min。扩增产物在4 ℃中保存。
将PCR 扩增产物送于上海生工公司进行测序,将测序结果进入GenBank 数据库进行相似性分析。并与GenBank 中的相近序列在Clustal W程序包中进行多重序列匹配排列分析,最后形成一个多重序列匹配排列阵,用MEGA 4.0 程序包中的Neighbor-Joining法构建系统进化树,计算模型为Kimura2-parameter,计算次数为1000 次。 1.4 菌株降解苯磺隆的生长因素研究
将菌株接种在50 mL LB 液体培养基(pH7.0)中,之后在温度为30 ℃,转速为150 r·min-1的恒温摇床中振荡培养18~24 h(OD600=0.30),再按5%(V/V)的量接种于无机盐培养基中,初始pH 为7.0,初始苯磺隆浓度为50 mg·L-1,温度为30 ℃,150 r·min-1恒温摇床振荡培养,分别进行以下几组处理测定生长量的变化,每种因素设3 个重复试验,同时设接种灭活的菌株为对照组,24 h后取样测定菌株生长量变化。
设温度分别为20、25、30、35、40、45 ℃;用NaOH或HCl 调节初始pH 值分别至4.0、5.0、6.0、7.0、7.5、8.0、9.0、10.0;设接种量分别为5%、10%、15%、20%、25%;设苯磺隆初始浓度分别为10、50、100、200、300、400、500、600 mg·L-1;设培养基体积分别为25、50、75、100、150、200 mL;设氮源分别为NH4NO3、NH4Cl、(NH4)2SO4、NaNO3;设碳源分别为葡萄糖、蔗糖和乳糖;设Mg2+浓度分别为100、200、300、400、500 mg·L-1;设NaCl浓度分别为5、10、20、30、50、100、150、200 g·L-1;设抗生素分别为卡那霉素、四环素、庆大霉素、链霉素、氯霉素、氨苄青霉素、红霉素。 2 结果与分析 2.1 降解菌株的分离和生理生化鉴定
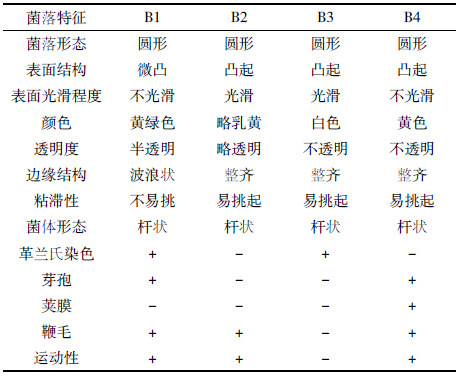
从长期受农药苯磺隆污染的土壤中通过采用富集培养分离技术得到4 株能够降解农药苯磺隆的细菌,分别将其命名为B1、B2、B3和B4。其形态学鉴定结果和生理生化实验结果见表 1和表 2。
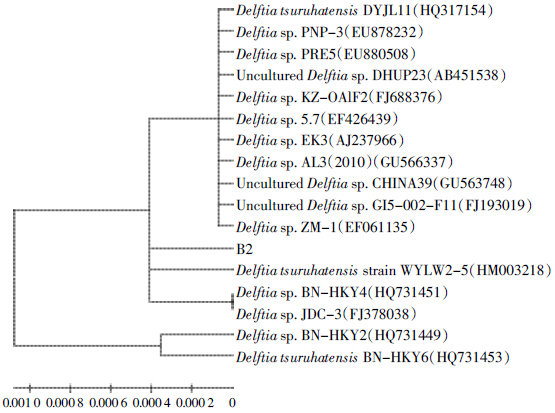
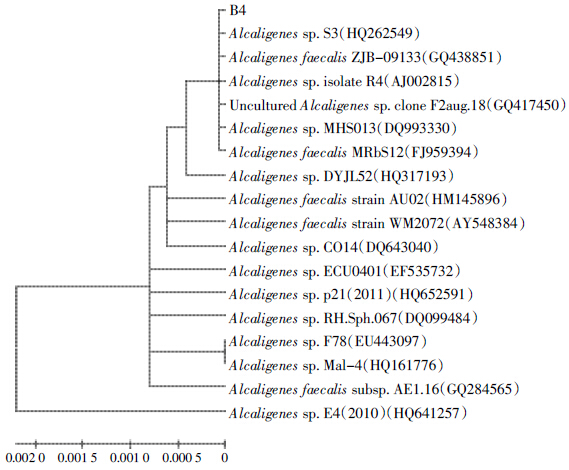
分别以B1、B2、B3 和B4 的基因组DNA 为模板,以细菌16S rDNA 为通用引物进行PCR 扩增,得到长度约为1.5 kb的扩增产物。将其与GenBank上的其他序列用Blast 软件进行同源性分析比对,结果表明菌株B1 与Pseudomonas aeruginosa NO5 的16S rDNA 序列的同源性高达100%,B2 与多株戴尔福特菌属(Delftia sp.)细菌的16S rDNA 序列同源性达99%,B3与多株微杆菌属(Microbacterium sp.)细菌的16S rDNA序列同源性达99%,B4 与Alcaligenes sp. MHS013 的16S rDNA 序列同源性高达100%。将所得序列应用MEGA 4.0 软件采用近邻法构建系统发育树,如图 1~图 4所示。再结合形态学特征分析和生理生化反应特性的结果,分别将这4株菌株初步鉴定为铜绿假单胞菌(P.aeruginasa)、戴尔福特菌(Delftia sp.)、微杆菌(Microbacterium sp.)、产碱杆菌(Alcaligenes sp.)。

|
| 图 1 B1 的系统发育树 Figure 1 Pictures of phylogenetic tree of strain B1 |
|
| 图 2 B2 的系统发育树 Figure 2 Pictures of phylogenetic tree of strain B2 |

|
| 图 3 B3 的系统发育树 Figure 3 Pictures of phylogenetic tree of strain B3 |
|
| 图 4 B4 的系统发育树 Figure 4 Pictures of phylogenetic tree of strain B4 |
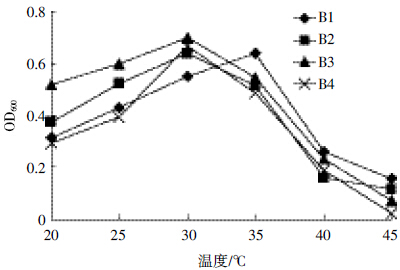
结果如图 5 所示,降解菌株B1 在35℃时生长情况最好,OD600 值明显高于其他几个设定温度,达到0.640,其后随温度增加而迅速降低。降解菌株B2、B3和B4在20~40 益的范围内均可生长;在20~30 益时,降解菌株B2、B3 和B4 的生长量OD600值随温度升高而增加;30 益时OD600达到最大,分别达到0.638、0.699和0.668,其后OD600值随温度升高而降低。4 株降解菌均不能在较高温度下生长,它们最适的生长温度范围在25~35 ℃之间,其中降解菌株B2、B3 和B4 生长的最适温度为30 ℃,菌株B1 则为35 ℃。
|
| 图 5 温度对菌株B1、B2、B3和B4 生长情况的影响 Figure 5 Effects of different temperature on growth of strain B1,B2,B3 and B4 |
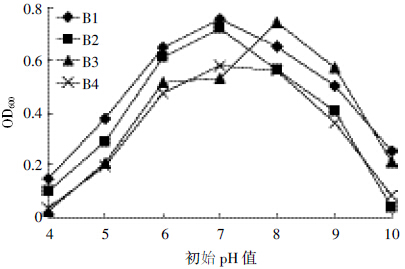
结果如图 6 所示,pH 7.0 时,降解菌株B1、B2 和B4生长情况最好;当pH小于7.0 或大于7.0 时,降解菌株生长量即OD600的值均下降。相比较来说在B1、B2和B4三株降解菌中,降解菌株B1具有良好的pH值适应性,可在较广泛的pH 值范围内生活。降解菌株B3 在pH 8.0 时生长最好,菌体生长量即OD600达到0.743,当pH小于8.0或大于8.0时,菌体生长量均下降。
|
| 图 6 初始pH 值对菌株B1、B2、B3 和B4 生长情况的影响 Figure 6 Effects of different initial pH on growth of strain B1,B2,B3 and B4 |
结果如图 7 所示,在一定范围内,提高接种量可以加快生长速率,缩短延滞期。在营养充足的条件下,降解菌株B1 和B3 接种量在15%(V/V)时,细菌生长活力明显增强。在5%~15%范围内,接种量越大降解菌株B1 和B3 的生长量越大,成正相关。菌株B2 和B4在接种量为10%时,OD600值均达到最大。

|
| 图 7 接种量对菌株B1、B2、B3 和B4 生长情况的影响 Figure 7 Effect of inoculum concentration on growth of strain B1,B2,B3 and B4 |
结果如图 8 所示,降解菌株B1、B2 和B4 在苯磺隆浓度10~200 mg·L-1的范围内,OD600值随浓度增加而增大;在200 mg·L-1时降解菌株B1、B2 和B4 的生长最佳,OD600值达到0.780、0.761 和0.708;当苯磺隆浓度大于200 mg·L-1 时,OD600 值随浓度增加反而减小。菌株B3 在10耀100 mg·L-1之间随浓度增加而升高;在100 mg·L-1苯磺隆条件下生长情况最好,OD600值达到最大0.758;其后随着苯磺隆浓度的增加OD600值降低。4株降解菌均对600 mg·L-1浓度的苯磺隆不耐受。
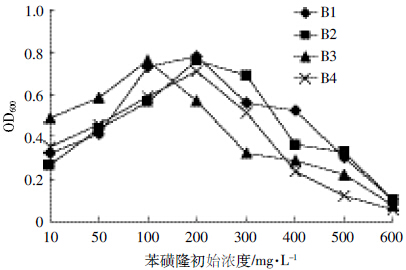
|
| 图 8 苯磺隆初始浓度对菌株B1、B2、B3和B4生长情况的影响 Figure 8 Effects of initial tribenuron-methyl concentration on growth of strain B1,B2,B3 and B4 |
结果如图 9 所示,在250 mL 的三角锥瓶中装入 25~150 mL 的无机盐液体培养后,4 株菌均可以正常 生长;在25~75 mL 范围内降解菌株生长呈上升趋势, 并且4 株降解菌在装液量为75 mL(3/10 体积)时生 长最好,降解菌株B1、B2、B3 和B4 的OD600值分别达 到0.739、0.774、0.831和0.709;当装液体积大于75 mL 时,随着培养液体积的增大OD600 值降低。这可能是 由于装液量达到一定之后,装液量的继续增加会使培 养液中的溶解氧含量降低,降解菌株生长所需氧气供 应不充分,菌体需氧量不充足,从而造成生长缓慢。
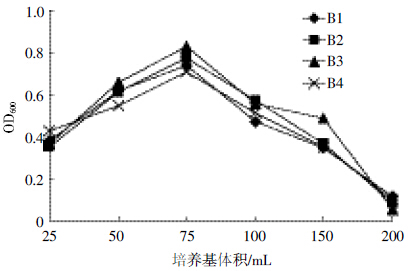
|
| 图 9 培养基体积对菌株B1、B2、B3 和B4 生长情况的影响 Figure 9 Effects of medium volume on growth of strain B1,B2,B3 and B4 |
结果如图 10 所示,降解菌株B1、B2、B3 和B4 在以100 mg·L-1 的NaNO3、NH4NO3、NH4Cl 和(NH4)2SO4为唯一氮源的培养基中均可以生长,菌株的生长情况因氮源不同而不同。从图 10 中可以明显看出,以相同浓度硝酸铵为唯一氮源时,4 株降解菌的生长情况均处于最好状态,降解菌株的OD600值明显比用其他几种氮源培养该降解菌株时的OD600值高。
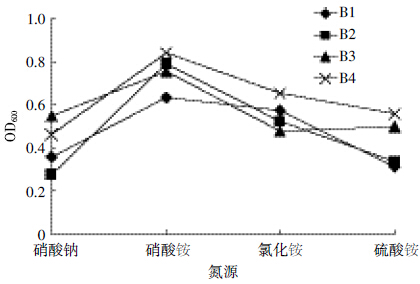
|
| 图 10 不同氮源对菌株B1、B2、B3 和B4 生长情况的影响 Figure 10 Effects of different nitrogen sources on growth of strain B1,B2,B3 and B4 |
结果如图 11 所示,在含有50 mg·L-1苯磺隆的无机盐液体培养基中,另加入100 mg·L-1葡萄糖、蔗糖与乳糖的外加碳源,结果证明外加碳源均能对4 株降解菌株的生长起促进作用。3 种外加碳源相比较来说,葡萄糖对4 株降解菌的生长促进情况最好,OD600值分别为0.850、0.739、0.911和0.817。在供试的3 种碳源中,4 株降解菌均对葡萄糖的利用效果最好。
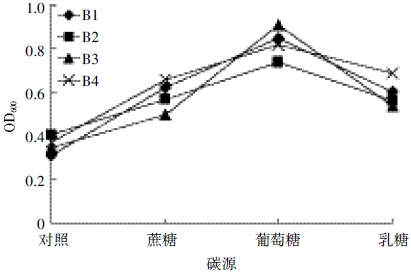
|
| 图 11 不同碳源对菌株B1、B2、B3 和B4 生长情况的影响 Figure 11 Effects of different carbon sources on growth of strain B1,B2,B3 and B4 |
结果如图 12 所示,在一定范围内的Mg2+浓度对降解菌株B1、B2、B3 和B4 生长均有一定的促进作用,菌体生长量随Mg2+的浓度变化而变化。降解菌株B1、B3 和B4 在Mg2+浓度为50~200 mg·L-1 的范围内,生长量随Mg2+浓度增加而增多,在Mg2+浓度达到200 mg·L-1 时,降解菌B1、B3 和B4 的OD600 值达到最大值;当Mg2+浓度继续增加时降解菌株B1、B3 和B4的生长量呈下降趋势。降解菌株B2 在Mg2+浓度为100 mg·L-1的条件下,菌体生长情况最好。此后,菌体的生长量随着Mg2+浓度的升高而降低。由此可见,Mg2+浓度在一定范围内的确对苯磺隆降解菌株的生长起到了促进作用,但当浓度超过一定范围之后反而会减少菌体的生长量。
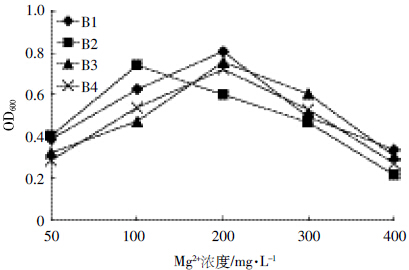
|
| 图 12 Mg2+浓度对菌株B1、B2、B3 和B4 生长情况的影响 Figure 12 Effects of Mg2+ concentration on growth of strain B1,B2,B3 and B4 |
结果如图 13所示,外加NaCl对降解菌株B1、B2、B3和B4菌体生长有一定程度的影响。随着NaCl 浓度的增加,降解菌B1和B4最适盐度出现在20 g·L-1,降解菌株B1 和B4 的生长量达到最大值,分别为0.653 和0.720,其后随着NaCl 浓度的升高生长量逐渐减少;降解菌B2 在5耀30 g·L-1范围内生长量均保持较高水平且变化不大,在30 g·L-1后生长量逐渐减少;降解菌B3 在5耀50 g·L-1 范围内,OD600值随浓度升高而变大,50 g·L-1 为B3 菌株的最适盐浓度。当NaCl 浓度达到200 g·L-1 时降解菌株B1、B2、B3 和B4几乎失活。
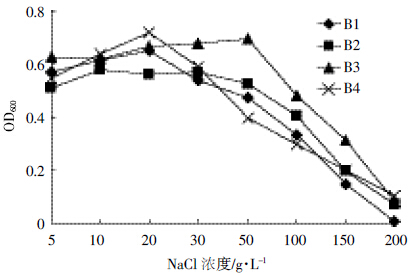
|
| 图 13 不同NaCl浓度对菌株B1、B2、B3 和B4 生长的影响 Figure 13 Effects of different NaCl concentration on growth of strain B1,B2,B3 and B4 |
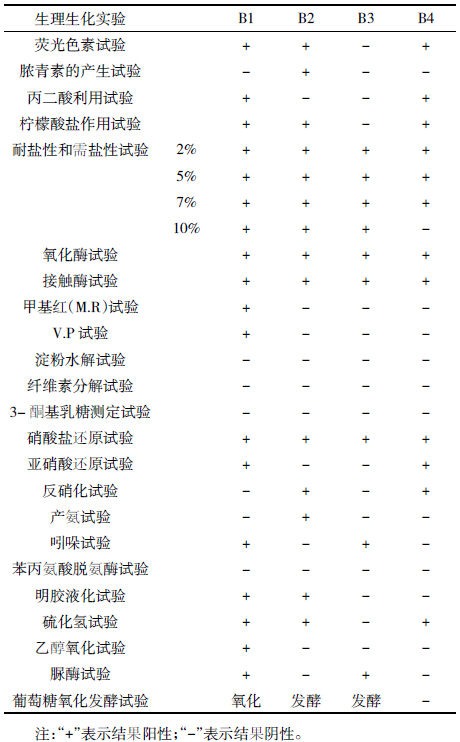
结果如表 3 所示,B1、B2 和B4 这3 株降解菌在氨苄青霉素的平板培养基中都可以正常生长,且长势较好;只有降解菌株B3 不产生抗性。在卡那霉素培养基中,B1 降解菌不能生长,其他3 株降解菌株均能正常生长。在四环素培养基上,降解菌株B2 不产生抗性,但抑菌圈很小。在庆大霉素培养集中,只有降解菌株B3 不产生抗性,其他3 株降解菌均能正常生长。在链霉素培养基中,4株降解菌均能正常生长。在氯霉素培养基中,只有B1 不产生抗性,其余3 株降解菌均能够正常生长。在红霉素培养基中,B3 菌不能生长,其余3 株降解菌正常生长。整体看来各降解菌株均有较好的抗生素抗性,这可能有利于日后的基因工程实验操作。
目前,除草剂污染是影响我国范围最大的有机污染之一,严重影响土壤的可持续利用和人类的健康生活。在除草剂市场上,苯磺隆、绿麦隆和氯磺隆这3 种农药占据了大部分市场。随着生物技术的迅猛发展,应用微生物进行生物修复已成为环境修复的重要内容之一,是土壤污染治理研究领域的一个热点。
本文从长期受苯磺隆污染的土壤中分离出4 株能够降解苯磺隆的菌株,分别对这4 株菌株进行了形态、生理生化特性研究和16S rDNA 分析,将B1 鉴定为铜绿假单胞菌(P.aeruginosa),B2 为戴尔福特菌(Delftia sp.),B3 为微杆菌(Microbacterium sp.),B4 为产碱杆菌(Alcaligenes sp.)。对于能够降解苯磺隆的铜绿假单胞菌属、戴尔福特菌属、微杆菌属、产碱杆菌属降解菌的报道尚属于首次,这对扩大苯磺隆降解菌资源库和开展农田修复实验具有一定的意义。王惟帅等[21]虽筛选出一株能够降解苯磺隆的降解菌,但并未对其进行形态、生理生化特性研究和16S rDNA分析。Zhang[20]筛选出一株能够降解苯磺隆的假单胞菌(Pseudomonas sp.),但并未对该菌株的最适生长条件进行研究。本文还通过研究温度、pH 值、接种量、农药浓度、培养基体积、碳源、氮源等不同影响因子对菌株生长状况的影响来确定菌株的最适生长条件。
由于苯磺隆为一种新型的磺酰脲类除草剂,相关研究资料还不是很多,而且麦田生态系统具有一定的复杂性、多样性及不稳定性,加上课题研究时间有限,使目前研究还存在有很多不足和遗憾之处。传统的菌株培养及筛选方法并不能得到全部的降解目标污染物的微生物,本实验所筛选出的苯磺隆降解菌,是在特定培养条件下的结果,未必是实际土壤环境中的优势菌株。今后可以在菌株培养和筛选、降解酶的鉴定以及降解基因的定位等方面作进一步研究和探讨,以便更深入地了解苯磺隆污染下土壤微生物的生态效应及其毒性机理,全面揭示并调控微生物降解目标污染物的机制,为开发除草剂污染土壤的生物修复技术提供依据。 4 结论
(1)从长期施用苯磺隆的土壤中分离出4 株降解菌B1、B2、B3 和B4,根据菌株的形态和生理生化特性及16S rDNA 分析,初步鉴定分别为铜绿假单胞菌(P.aeruginosa)、戴尔福特菌(Delftia sp.)、微杆菌(Microbacterium sp.)、产碱杆菌(Alcaligenes sp.)。
(2)四株降解菌的最佳生长条件为30~35℃,pH7.0~8.0,接种量10%~15%(V/V),苯磺隆浓度为100~200 mg·L-1,培养基体积为75 mL,氮源为硝酸铵,碳源为葡萄糖,Mg2+浓度100~200 mg·L-1,NaCl浓度为20~50 g·L-1。在实验的抗生素中,4株降解菌均有抗性。
| [1] | 吴志凤.麦田除草剂苯磺隆应用研究[J]. 安徽农业科学, 2007, 35 (14):4246, 4280.WU Zhi-feng. Catcher application of herbicide tribenuron[J]. Journal ofAnhui Agricultural Sciences, 2007, 35 (14): 4246, 4280. (in Chinese) |
| [2] | 李会芹,李 鹏, 刘凤英. 除草剂苯磺隆的研制[J]. 精细与专用化学品,2007, 15 (13): 23-24.LI Hui-qin, LI Peng, LIU Feng-ying. Study on the herbicide tribe-nuron-methyl[J]. Fine and Specialty Chemicals, 2007, 15 (13): 23-24.(in Chinese) |
| [3] | 王天赋, 柳 梅. 苯磺隆的高效液相色谱分析[J]. 农化新世纪, 2005(5): 32.WANG Tian-fu, LIU Mei. Tribenuron HPLC analysis[J]. AgrochemicalNew Century, 2005 (5): 32. (in Chinese) |
| [4] | 唐 韵. 除草剂的结构类型与靶标类型[J]. 农药市场信息, 2005 (17):16.TANG Yun. Herbicides structure type and target type[J]. Pesticide Mar-ket News, 2005 (17): 16.(in Chinese) |
| [5] | 袁卉馥, 牛瑞明. 75%苯磺隆 WG 在筱麦田间除草效果[J]. 农药, 2009,48 (3): 218-220.YUAN Hui-fu, NIU Rui-ming. Experiment of tribenuron-methyle 75%WG forcontrolling weeds in the naked oats field[J]. Agrochemicals, 2009,48 (3): 218-220.(in Chinese) |
| [6] | 张敏恒. 磺酰脲类除草剂的发展现状、 市场与未来趋势[J]. 农药,2010, 49 (4): 235- 240.ZHANG Min-heng. The development situation, market and trend of sul-fonylurea herbicides[J]. Agrochemicals, 2010, 49 (4): 235- 240.(in Chi-nese) |
| [7] | Blair A M, Martin T D. A review of the activity, fate and mode of actionof sulfonylurea herbicides[J]. Pestic Science, 1988, 22: 195-219. |
| [8] | 张 蓉, 岳永德, 花日茂, 等. 磺酰脲类除草剂在环境中的转归和影响[J]. 安徽农业科学, 2003, 31 (6): 1007-1009.ZHANG Rong, YUE Yong-de, HUA Ri-mao, et al. The outcome andimpact of sulfonylurea herbicides in environment[J]. Journal of AnhuiAgricultural Sciences, 2003, 31 (6): 1007-1009. (in Chinese) |
| [9] | Bhattacharjee A K, Dmueja P. Light-induced transformation of trihen-umn-methyl on glass soil and plant surface[J]. Journal of EnvironmentalScience and Health Part B-Pesticides Food Contaminants and Agricul-tural Wastes, 2002, 37 (2): 131. |
| [10] | 郎印海, 蒋 新, 赵其国, 等. 磺酰脲除草剂在土壤中的环境行为研究进展[J]. 应用生态学报, 2002, 13 (9): 1187-1190.LANG Yin-hai, JIANG Xin, ZHAO Qi-guo, et al. Advances in re-searches of environmental behavior of sulfonylurea herbicides in soil[J]. Chinese Journal of Applied Ecology, 2002, 13 (9): 1187-1190.(in Chinese) |
| [11] | Susanne K, Husein A A. Enzyme activities in agricultural soils fumi-gated with methyl bromide alternatives[J]. Soil Biology and Biochem-istry, 2004, 36: 1625-1635. |
| [12] | 江改青. 小麦和土壤中苯磺隆与氯氟吡氧乙酸残留分析方法及消解动态研究[D]. 合肥: 安徽农业大学, 2009: 4-5, 7-8.JIANG Gai-qing. Studies on analytical methods and dynamics of tribe-nuron-methyl and fluroxypyr residues in wheat and soil[D]. Hefei: An-hui Agricultural University, 2009: 4-5, 7-8.(in Chinese) |
| [13] | 杜慧玲, 吴济南, 王丽玲, 等. 苯磺隆对土壤酶活性的影响[J]. 核农学报, 2010, 24 (3): 585-588.DU Hui-ling, WU Ji-nan, WANG Li-ling, et al. Effect of tribenuron-methyl application on activity of soil enzyme[J]. Acta Agriculturae Nu-cleatae Sinica, 2010, 24 (3): 585-588. (in Chinese) |
| [14] | Andersen S M, Hertz P B, Holst T, et al. Mineralisation studies of14 C-labelled metsulfuron-methyl, tribenuronmmethyl, chlorsulfuron andthifensulfuron one Danish soil and groundwater sediment profile [J].Chemosphere, 2001, 45: 775-782. |
| [15] | 杨春璐, 孙铁珩, 和文祥. 农药对土壤脲酶活性的影响[J]. 应用生态学报, 2006, 17 (7): 1354-1356.YANG Chun-lu, SUN Tie-heng, HE Wen-xiang. Effects of pesticideson soil urease activity[J]. Chinese Journal of Applied Ecology, 2006, 17(7): 1354-1356. (in Chinese) |
| [16] | 仇宏伟, 胡继业, 周革菲. 磺酰脲类除草剂在土壤及植物中行为综述[J]. 莱阳农学院学报, 2000, 17 (2): 132-138.QIU Hong-wei, HU Ji-ye, ZHOU Ge-fei. Sulfonylurea herbicides insoil and plant behavior review[J]. Journal of Laiyang Agricultural Col-lege, 2000, 17 (2): 132-138. (in Chinese) |
| [17] | 白 翎, 王 玫, 宫静宏. 毛细管气相色谱法测定农产品中氟草烟残留量[J]. 色谱, 2003, 21 (3): 288-290.BAI Ling, WANG Mei, GONG Jing-hong. Determination of fluroxypyrresidue in farm produce by capillary gas chromatography[J]. ChineseJournal of Chromatography, 2003, 21 (3): 288-290. (in Chinese) |
| [18] | Muhamad H B, Ai T Y, Sahid I B. Determination of the herbicide flurox-ypyr in oil matrices[J]. Journal of Environmental Science and HealthPart B-Pesticides Food Contaminants and Agricultural Wastes, 2008,43 (2): 134-140. |
| [19] | Wang Nan-Xi, Tang Qiang, Wang Ya-Nan, et al. Biodegradation oftribenuron methyl that is mediated by microbial acidohydrolysis atcell-soil interface[J]. Chemosphere, 2012, 86: 1098-1105. |
| [20] | Zhang Jun-Jie. Co-metabolic degradation of tribenuron methyl, a sul-fonylurea herbicide, by Pseudomonas sp. Strain NyZ42[J]. InternationalBiodeterioration and Biodegradation, 2013, 76: 36-40. |
| [21] | 王惟帅, 吴济南, 张天宝, 等. 苯磺隆降解菌生长条件研究[J]. 山西农业科学, 2012, 40 (8): 862-865.WANG Wei-shuai, WU Ji-nan, ZHANG Tian-bao, et al. Study ongrowth conditions of tribenuron-methyl degradation strain[J]. Journal ofShanxiAgriculturalSciences,2012,40 (8):862-865.(in Chinese) |
| [22] | 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001:370-410.DONG Xiu -zhu, CAI Miao -ying. Systematic identification book ofcommonlyclinical pathogenic bacteria[M]. Beijing: Science Press, 2001:370-410. (in Chinese) |
| [23] | William D, Hiorns, Batbara A Methe. Bacterial diversity in Adirondackmountain lakes as revealed by 16S rRNA gene sequences[J]. AppliedEnvironment Microbiology, 1997, 63: 2957-2960. |
 2014, Vol. 31
2014, Vol. 31