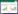文章信息
- 郭玉香, 刘金彪
- GUO Yu-xiang, LIU Jin-biao
- 小麦田土壤中炔草酯GC-ECD检测方法研究及残留行为特征
- Detection Method and Residual Behavior of Clodinafop-propargyl by GC-ECD in Wheat Soil
- 农业资源与环境学报, 2014, 31(4): 388-392
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0079
-
文章历史
- 收稿日期:2014-04-01
炔草酯是由瑞士先正达公司研发的芳氧基苯氧 丙酸类除草剂,化学名称为R-2-[4-(5-氯-3-氟-2- 氧基吡啶)-苯氧基]-丙酸丙炔酯,主要用于小麦田杂 草防治。国内外已经报道了有关炔草酯的残留分析方 法,其中主要采用液相色谱法[1, 2, 3, 4, 5],气相色谱测定方法 报道较少。高效液相色谱法(HPLC)最常用的检测器 为紫外检测器(UVD),检测灵敏度不如气相色谱检测 器。液质联用技术在农药多残留检测方法中的应用瓶 颈是需要高质量的样品预处理技术,且所用仪器价格 昂贵,难以满足一般实验室的要求。气相色谱-电子捕 获检测器(GC-ECD)检测有机氯农药和含卤素的拟 除虫菊酯类农药时,灵敏度高、成本低,但在炔草酯残 留测定中尚未有相关报道。
本文建立了气相色谱-电子捕获检测器(GC-ECD) 检测小麦田土壤中炔草酯含量的分析方法,在满足高 回收率和重复性的前提下,将其运用到2 年两地麦田 的田间试验土壤,测定其中炔草酯的残留,并研究了 土壤中炔草酯的降解规律,旨在为该农药环境风险性 评价提供科学依据。 1 材料与方法 1.1 试验材料
炔草酯标准品(德国Dr.Ehrenstorfer GmbH公司),纯度97.0%,供试农药为15%炔草酯可湿性粉剂(南 京华洲药业有限公司提供),主要试剂为:正己烷(色 谱纯)、丙酮(色谱纯、分析纯)、无水氯化钠(分析纯)、 乙腈(分析纯)、水为超纯水。主要仪器为:气相色谱仪 (Agilent-6890N,配有电子捕获检测器)、旋转蒸发器 (RE-52AA)、回旋式振荡器(欧诺-QE-1)、万分之一电 子天平(ER-182 A)、MILLI-Q 超纯水仪(美国Millipore 公司)、Eppendorf移液枪:100~1000滋L,500~5 000 滋L, 1~10 mL。
供试田间试验土壤样品取自山东青岛和湖南长 沙两地小麦试验田。山东青岛土壤为砂性棕壤,土壤 pH 值为6.4,有机质含量1.79%,中等肥力;湖南长沙 土壤为水稻土,pH 值为5.9,有机质含量为1.03%,肥 力适中。按照《农药残留试验准则》各选1 块30 m2的 地块,单独施药,制剂量0.067 5 g·m-2,施药后1 h、1、 3、7、14、21、30、45、60、80 d采样,另设清水空白对照。 土壤样品的采集:随机取点5耀10 个,采用土钻采集0耀 15 cm 的土壤1耀2 kg,除去土壤中的碎石、杂草和植 物根茎等杂物,混匀后采用四分法留样300 g,装入密 封塑料袋中,粘好标签,贮存于-20 益冰柜中待测,实 验前,土壤样品过2 mm筛备用。 1.2 试验方法 1.2.1 样品前处理
称取20.0 g土壤样品置于250 mL三角瓶中,加入 10 mL 水和50 mL 乙腈,静置过夜,振荡提取1 h,再 加5 g NaCl 振荡10 min,静置,用量筒量取上层溶液 25 mL。在旋转蒸发仪上(50 ℃)减压浓缩至近干,用 色谱纯丙酮/正己烷(2:8,V/V)定容至2.5 mL,待GCECD 检测。 1.2.2 色谱检测条件
检测器:GC-ECD;色谱柱:HP-5MS(30m×0.25 mm× 0.25 μm);检测条件:进样口温度260 ℃,检测器温度 300 ℃,柱温程序升温:初始温度60 ℃,以20 ℃·min-1 升至200 ℃,再以5 ℃·min-1升至260 ℃;载气流速:2 mL·min-1;进样量:10 μL。 1.2.3 标准曲线绘制
采用外标法定量,用分析天平准确称取0.010 0 g 炔草酯标准品,用丙酮:正己烷(2:8,V/V)溶解定容至 100 mL,再用丙酮:正己烷(2:8,V/V)依次稀释至10.0、 5.0、2.0、1.0、0.5、0.1、0.05、0.01 mg·L-1,得到炔草酯系 列浓度标准工作溶液(现配现用),按1.2.2 节条件进 行测定,重复3次。以进样浓度为横坐标、色谱峰面积 为纵坐标绘制标准曲线。 1.2.4 残留量计算
样品的残留量R(mg·kg-1)计算公式如下:
R=[标样质量浓度(mg·L-1)伊提取液体积(mL)伊定 容体积(mL)伊样品峰面积]/[样品质量(g)伊分取体积 (mL)伊标样峰面积] 1.2.5 添加回收率与最小检出限
称取空白土壤20.0 g,添加炔草酯标准溶液,得 到土壤炔草酯理论残留浓度分别为0.01、0.1 mg·kg-1 和0.5 mg·kg-1,并按上述1.2.1、1.2.2 节提取检测方法 分析测定样品添加回收浓度,每个处理重复5 次,并 计算相应的添加回收率。同时,以3 倍基线噪音(S/N= 3)作为炔草酯的最小检出限。 1.2.6 田间试验设计
参照《农药残留试验准则》(NY/T 788—2004), 于2010 年和2011 年分别在山东青岛和湖南长沙两 地开展炔草酯在麦田土壤中的残留消解动态试验。 2 结果与讨论 2.1 提取溶剂的选择
比较了常用的4 种不同提取溶剂对土壤中炔草 酯的提取效率。结果表明:由于二氯甲烷和乙酸乙酯 水溶性不好,乙腈比二氯甲烷和乙酸乙酯提取效率要 高;而和丙酮相比,乙腈对炔草酯的提取效率和丙酮 相差不大,但丙酮不易盐析。因此,选择乙腈作为提取 溶剂。 2.2 提取方式的选择
比较了常用的超声和震荡2 种提取方法的提取 效率,发现超声3 min 以下炔草酯残留提取效率比振 荡20 min低,超声大于3 min,提取效率增加但检测干 扰杂质峰增多。当振荡时长分别为20、40、60、80 min 和100 min 时,发现20~60 min时间内,随着时间的增 加,提取效率增大,且杂质变化不大;振荡时长60~ 100 min内,随着时间的增加,提取效率不再增加,但检 测杂质峰增多。因此,选择振荡60 min作为提取方式。 2.3 色谱条件的选择
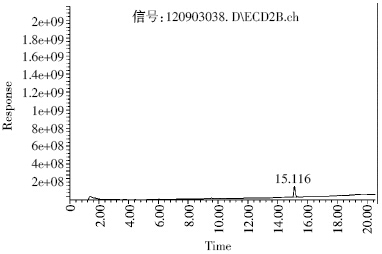
在实验过程中分别选择阅月-1701、HP-5MS 和 HP-WAS 3种色谱柱进行分析检测,结果表明:采用 HP-5MS(30 m×0.25 mm×0.25 μm)柱分析时,炔草酯 测定值灵敏稳定,在进行实际样品测定时与杂质峰 分离较好,故选择HP-5MS(30 m×0.25 mm×0.25 μm) 作为测定色谱柱。实验改变不同色谱柱进样温度,发 现初始温度60 ℃,以20 ℃·min-1 升至200 ℃,再以5 ℃·min-1升至260 ℃,柱温程序升温,检测器温度300益,炔草酯的保留时间为15.2 min 左右,与相邻的杂 质峰分离比较完全,而且在进行实际样品分析时杂质 干扰也较少,定量较为准确。
因此选定仪器条件为:HP-5MS 色谱柱(30 m× 0.25 mm×0.25 μm),进样口温度260 ℃,检测器温度 300 ℃,柱温程序升温(初始温度60 ℃,以20 ℃·min-1 升至200 ℃,再以5 ℃·min-1 升至260 ℃),载气流速 为2 mL·min-1。进样量为10 μL。保留时间约15.2 min 左右。 2.4 检测方法的可行性
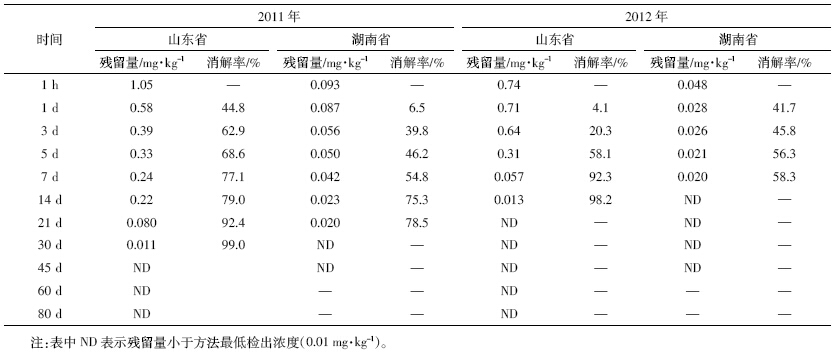
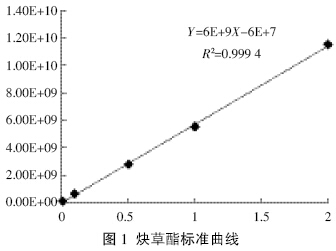
分别用炔草酯标准溶液0.01、0.1、0.5、1.0 mg·L-1 和2.0 mg·L-1按1.2.3 节方法绘制标准曲线。溶液浓 度(X)为横坐标,峰面积(Y)为纵坐标,在0.01~2.0 mg·L-1浓度范围内,线性方程为:Y=6E+9X-6E+7,相 关系数为R2=0.999 4。表明炔草酯质量浓度与色谱峰 面积呈良好的线性关系,可以满足定量分析的要求。 炔草酯标准曲线见图 1,标准品色谱图见图 2。
|
| 图 1 炔草酯标准曲线 Figure 1 The standard curve of clodinafop-propargyl |
|
| 图 2 炔草酯标准气相色谱图 Figure 2 The GC-ECD chromatogram of reference standard |
称取20.0 g 土壤空白样品,按照1.2.5 节方法加 入炔草酯标样,对样品进行提取检测,计算加标回收 率,由表 1 可知炔草酯在土壤中加标回收率为 72.43%~98.80%,相应的变异系数为2.66%~7.64%。 根据我国农业行业标准《农药残留试验准则》(NY/T788—2004),本试验的添加回收率和变异系数符合小 麦和土壤中炔草酯残留分析的要求。
 |
由图 2、图 3 可知,炔草酯的相对保留时间为 15.1 min 左右,各样品中目标峰情况基本一致,目标 化合物和杂质得到了良好的分离,色谱检测结果表 明,炔草酯在小麦和土壤中的最低检出浓度为0.01 mg·kg-1。该方法的准确度和精密度均符合农药残留 检测的要求。
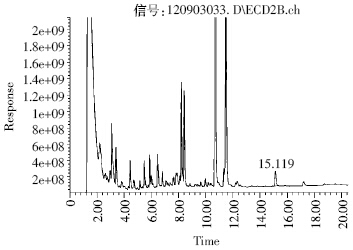
|
| 图 3 土壤添加样品(0.50 mg·kg-1)气相色谱图 Figure 3 The GC-ECD chromatogram of clodinafop-propargyl in soil |
从表 2可以看出,2011 年和2012 年施药1 h后, 炔草酯在山东麦田土壤中原始沉积量分别为1.05 mg·kg-1和0.74 mg·kg-1,在湖南麦田土壤中的原始沉 积量分别为0.093 mg·kg-1和0.048 mg·kg-1。炔草酯在 土壤中初始消解速率较慢,5 d时消解率均接近或超 过50%,30 d后消解率超过99%。另外,由于试验地 的气候条件、土壤类型等因素,导致炔草酯在山东小麦田土壤中原始沉积量要高于湖南。
试验结果表明:土壤中炔草酯残留量随时间延 长而逐渐降低,施药后时间与土壤的残留量呈指数 关系,消解动态曲线(图 4)符合一级动力学模型C= C0e-Kt,式中C为施药t时的农药浓度,t为施药后的 天数,两地2 年的消解动态回归方程分别如下:
山东:
C11=0.7144 e-0.329t (R2= 0.9516) 半衰期(t1/2)= 2.74
C12=0.895 2 e-0.357t (R2= 0.951 6) 半衰期(t1/2)= 2.76
湖南:
C11=2.945 1 e-0.573t (R2= 0.951 6) 半衰期(t1/2)= 3.96
C12=1.769 5 e-0.588t (R2= 0.951 6) 半衰期(t1/2)= 3.60
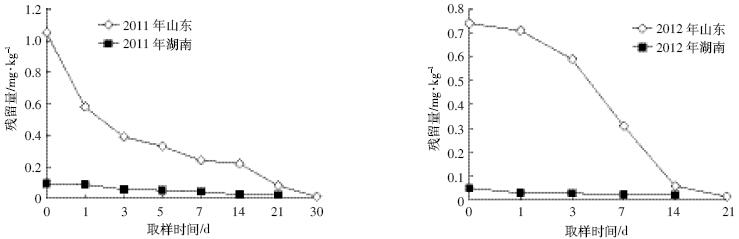
|
| 图 4 炔草酯在小麦田土壤中的消解曲线 Figure 4 The residue degradation dynamics clodinafop-propargyl in soil |
炔草酯在山东和湖南两地2 年土壤中的理论半 衰期分别为2.74~2.76 d和3.60~3.96 d。试验结果显 示,在整个试验过程中,炔草酯在土壤中的消解曲线 均呈递减趋势,说明炔草酯属于易降解农药。 3 结论
论文采用GC-ECD 分析检测土壤中的炔草酯残 留,样品前处理快速、简便,分析速率快,对目标化合 物和杂质有良好的分离能力,检测结果准确、可靠、成 本低,相对于较昂贵的液相色谱检测器和其苛刻的检 测条件而言,气相色谱电子捕获检测器费用相对廉 价,易在常规实验室普及,具有其他方法无法比拟的优越性。
炔草酯在2 年两地土壤中30 d 消解率均超过 99%,理论半衰期为2.74~3.96 d。整个试验过程,炔草 酯在土壤中的消解曲线均呈递减趋势。
| [1] | 马新生, 吴慧明, 尚子帅, 等. 炔草酯在麦田土壤中的消解动态[J]. 浙江农业科学, 2012(5): 733-736. MA Xin-sheng, WU Hui-ming, SHANG Zi-shuai, et al. Degradationdynamics of clodinafop-propargyl in wheat soil[J]. Journal of ZhejiangA gricultural Sciences, 2012(5): 733-736.(in Chinese) |
| [2] | 郭永泽, 邵 辉, 张玉婷, 等援 哉孕蕴悦/酝杂/酝杂 法测定小麦中炔草酯及其代谢物残留量[J]. 农药, 2010, 49(2): 122-124. GUO Yong-ze, SHAO Hui, ZHANG Yu-ting, et al. Determination ofclodinafop-propargyl and its metabolite in wheat by UPLC/MS/MS [J]. A grochemicals, 2010, 49(2): 122-124.(in Chinese) |
| [3] | Roy S, Singh S. Liquid chromatographic method for the micro-quantitative determination of clodinafop in soil, wheat and phalaris minor[J].J Chromatog A, 2005, 1065(2): 199-206. |
| [4] | 段劲生, 王 梅, 孙明娜, 等. 高效液相色谱法测定小麦和土壤中炔草酯及其代谢物炔草酸的残留量[J]. 农药学学报, 2013, 15(1): 33-36. DUAN Jin-sheng, WANG Mei, SUN Ming-na, et al. Determination ofclodinafop-propargyl and its metabolite in wheat and soil by high performance liquid chromatography[J]. Chinese Journal ofPesticide Science,2013, 15(1): 33-36.(in Chinese) |
| [5] | 蔡晓明, 何红梅, 丁亚慧, 等. 炔草酯土表光解、土壤厌氧降解和水-沉积物系统降解特性[J]. 农药, 2011, 50(9): 677-679. CAI Xiao-ming, HE Hong-mei, DING Ya-hui, et al. Environmentalfates including soil surface photolysis, anaerobic soil degradation, andwater-sediment degradation of clodinafop-propargyl[J]. A grochemicals,2011, 50(9): 677-679.(in Chinese) |
 2014, Vol. 31
2014, Vol. 31