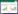文章信息
- 李欣, 徐钰, 江丽华, 贺洪军, 谭月强, 刘兆辉
- LI Xin, XU Yu, JIANG Li-hua, HE Hong-jun, TAN Yue-qiang, LIU Zhao-hui
- 不同调控措施下温室土壤微生物多样性变化及其对黄瓜产量和品质的影响
- Effects of Different Control Measures on Cucumber Yield, Quality and Soil Microbial Diversity Under Green house Cultivation
- 农业资源与环境学报, 2014, 31(4): 349-354
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0054
-
文章历史
- 收稿日期:2014-03-18
2. 山东省农业科学院农业资源与环境研究所 山东 济南 250100;
3. 农业部山东耕地保育科学观测实验站 山东 寿光 262700
2. Institute of Agricultural Resources and Environment, Shandong A cademy of Agricultural Sciences, Jinan 250100, China;
3. Scientific Observation Lab for Preservation of Cultivate Land in Shandong Province,Ministry of Agriculture, Shouguang 262700, China
设施蔬菜是发展现代农业的重要标志之一,是我 国近年来发展较快、效益较好、对农民增收和农业增 效贡献较大的农业产业。据统计资料显示,截止到 2010年底,我国设施蔬菜种植面积约达466.7 万hm2, 为世界上设施蔬菜面积最大的国家。然而,在水肥高 投入、高产出生产模式下,设施蔬菜栽培产生一系列 环境问题,尤其是土壤质量下降,主要表现为土壤盐 渍化[1]、硝酸盐积累[2]和微生物区系破坏[3],进而导致蔬 菜产量降低、品质变劣。
土壤微生物群落及其多样性能够敏感地反映土 壤环境质量的变化,其特征可作为生物指标指示土壤 质量、评价土壤肥力[4]。目前,研究土壤微生物多样性 的方法很多。其中Biolog 法自Garland 等[5]将其首次 用于描述微生物的群落功能特征以来,就因其快速、 简便、无需分离培养纯微生物即可获得大量土壤微生 物群落结构和功能多样性方面的信息等特点而被广 泛应用。主要用于比较不同土壤类型[6]、同类土壤不同 植物物种[7]、不同管理策略下的农业土壤[8, 9, 10]、不同植 被根际[11]和污染土壤[12]的微生物特征,但在设施菜地 土壤微生物研究中的应用报道较少。
为此,本试验以我国最大设施蔬菜基地———寿光 的日光温室土壤为研究对象,采用Biolog 检测法探讨 秸秆还田和滴灌2 种调控措施对设施黄瓜土壤微生 物群落结构特征的影响,旨在综合评价不同调控措施 对土壤微生物的影响,以及与黄瓜产量和品质的关 系;通过合理的灌溉和施肥,创造良好的设施土壤生 态环境,为实现设施土壤的可持续利用和蔬菜的高产 优质提供科学依据。 1 材料与方法 1.1 试验设计
试验设在山东省寿光市稻田镇河沟村(N 36°50′ 28.3″,E 118°56′7.8″)的一个日光温室,土壤类型为褐 土。基础土样(0~20 cm)的pH 值为7.63,盐分为 0.187%,有机质18.95 g·kg-1,全氮1.259 g·kg-1,速效 磷和速效钾含量分别为210.40、498.72 mg·kg-1。试验 于2011年2月22日移栽,2011年7月12日拉秧;以 “世纪星”黄瓜品种为种植作物,一年两茬,行距60 cm, 株距25 cm。
试验设4个处理,分别为(1)空白(CK),不施任何 肥料;(2)习惯施肥(CF),施肥量、时间及方式完全按 照农民习惯生产方式进行,基施有机肥(有机质50%, N-P2O5-K2O为2.9%-2.62%-0.42%)308.6 kg·667 m-2, 追肥(商品冲施肥)12 次,化肥N、P2O5、K2O 分别投入 52.7、59.7 kg·667 m-2 和52.9 kg·667 m-2,灌溉(沟灌) 19 次,灌溉量为826 m3·667 m-2;(3)秸秆还田(RS), 在处理(2)基础上施用腐熟小麦秸秆调节土壤C/N比, 用量为500 kg·667 m-2(烘干重);(4)膜下滴灌(DI),施 肥量、时间及次数等同于处理(2),施肥及灌溉方式通 过滴灌完成,整个生长季灌溉量为382.7 m3·667 m-2。 所有处理的其他田间管理措施均一致,每处理均3 次 重复,随机区组设计,试验小区面积21.6 m2。 1.2 样品采集和测定
本试验于2011年7月12日黄瓜拉秧前采集土壤 样品,每小区采集5 点0~20 cm 耕层土壤,除去石砾 和植物残体等杂物,混合制样,过2 mm 筛后,拣去可 见有机物,放入4 益冰箱内保存,并尽快进行Biolog 分析。
Biolog 测定基于文献[5]的方法并稍有变动,具体 操作步骤如下:(1)将称取相当于25 g烘干土的新鲜 土样加入内有250 mL 无菌水的三角瓶中,加无菌棉 花塞;(2)往复式震荡机上200 r·min-1下振荡20 min; (3)静置片刻后,按逐步稀释法,依次稀释为10-2、10-3 梯度液,用8 道加样枪吸取150 μL 10-3稀释液接种 微平板;(4)在(25±1)℃下培养168 h,每12 h用Biolog 读数仪(Biolog,Hayward,USA)在590 nm 下读数。
黄瓜分次采收,累积计产;并于盛瓜期(5 月4 日) 取样分析果实品质,紫外分光光度法测硝酸盐含量, 2,6-二氯靛酚滴定法测维生素C(Vc)含量,斐林比色 法测可溶性糖含量。 1.3 数据处理和分析
微生物对碳源的利用采用微平板每孔颜色平均 变化率(Average well color development,AWCD)描述, 物种丰富度指数(Shannon index,H)、均匀度指数(Substrate evenness,E)、优势度指数(Simpson's dominance, Ds)、碳源利用丰富度指数(Substrate richness,S)表示 土壤微生物碳源利用的多样性,公式参考文献[9]中的 方法。
试验数据为3 次重复的平均值;采用SAS 软件 Duncan's 新复极差法进行多重比较及差异显著性分 析。 2 结果与分析 2.1 不同调控措施土壤微生物群落多样性的变化 2.1.1 平均颜色变化率的差异
微生物培养开始后,每隔12 h测定AWCD值,得到AWCD随时间的动态变化图(图 1)。结果显示,不 同处理土壤微生物群落反应速度有所不同,说明群落 能利用单一碳源的微生物数量和种类不同。接种培养 后,土壤微生物经过24 h的滞后期,逐渐适应Biolog 微平板基质环境,随后进入对数增长期直至72 h,然 后生长减缓逐渐稳定。

|
| 图 1 土壤微生物群落AWCD随培养时间的变化 Figure 1 AWCD changeswithincubationtimeofdifferenttreatments |
培养期间,不施肥处理AWCD最低,微生物培养 72 h各处理AWCD在0.494~0.881之间;与CF 处理 相比,RS 处理AWCD显著增加,是CF 的1.3 倍;DI 处理AWCD略低,但差异不显著。表明施肥有利于提 高微生物的代谢活性,习惯施肥模式基础上添加秸秆 调节土壤C/N 比,土壤微生物利用碳源的能力及代谢 活性进一步提高。 2.1.2 土壤微生物多样性指数的差异
物种丰富度指数、均匀度指数、优势度指数和碳 源利用丰富度指数是表征群落多样性的常用指数。根 据对吸光度变化曲线的分析发现72 h前后的吸光度 数据能够很大程度上反映不同微生物群落的代谢特 性差异,因此采用反应72 h的数据用于微生物代谢 特性的分析。
如表 1所示,除CK 外,CF处理物种丰富度指数、 均匀度指数、优势度指数和碳源利用丰富度指数最 低,表明农民习惯施肥模式下过量的肥料投入造成微 生物功能降低,需要进行土壤培育。与CF处理相比, RS 和DI 处理土壤微生物群落物种丰富度指数和碳 源利用丰富度指数显著增加,表明秸秆还田和滴灌措 施的应用有利于提高土壤微生物多样性。
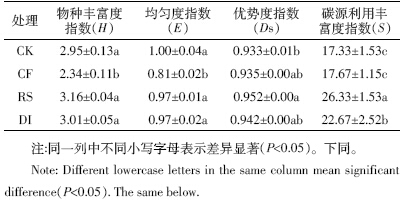
主成分分析是处理数学降维的一种方法,将多个 变量通过线性变换以选出较少个数重要变量。主成分 个数的提取原则是相对应特征值大于1 的前m个主 成分。根据此原则,共提取出了8 个主成分,累计贡献 率达93.06%。其中第1主成分(PC1)贡献率是33.9%, 权重最大;第2 主成分(PC2)贡献率是14.22%;第3~ 8 主成分贡献率分别是12.01%、9.36%、7.72%、 6.93%、5.34%和3.56%,因第3~8主成分贡献率较小, 所以本文只解释第1 主成分和第2 主成分(图 2)。不 同处理在PC 轴上出现了明显的分布差异。RS 处理 分布在PC1 轴的正方向上,平均得分系数为5.21; 其他处理全部分布在PC1 轴的负方向上,得分系数 在-3.26~-0.18之间。在PC2轴上,CK分布在负方向 上,RS处理在正负方向上都有分布。
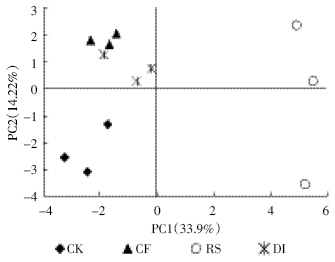
|
| 图 2 不同处理土壤微生物碳源利用主成分分析 Figure 2 Principal components analysis for carbon utilization of soil microbial communities in different treatments |
对微生物碳源利用的主成分进行方差分析(表 2) 可知,不同处理在PC1 和PC2 上的得分系数出现显著差异(P<0.05)。RS 处理在PC1 轴上的得分显著高 于其他处理,由于第2主成分的贡献率(14.22%)远远 小于第1 主成分(33.9%),因此第1 主成分解释了大 部分的变异,对综合得分的影响也主要取决于第1 主 成分。各处理综合得分也以RS 最高,其次是DI 处 理,且差异显著。
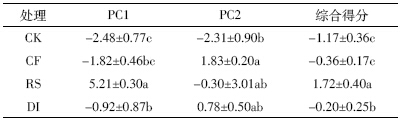
对黄瓜产量进行分析表明(表 3),不施肥处理黄 瓜产量最低,为3 325.32 kg·667 m-2;施肥能显著提高 黄瓜产量,是不施肥处理的2.8 倍左右。与CF处理相 比,RS 处理下黄瓜产量略增产0.69%,DI 处理减产 0.84%,但差异均未达显著水平。对黄瓜盛瓜期品质 进行分析表明,施肥可显著提高果实可溶性糖含量和 Vc含量,但CF、RS、DI 三处理之间差异不显著。
土壤微生物群落多样性指数与黄瓜产量、品质的 相关性分析结果(表 4)表明,优势度指数和碳源利用 丰富度指数与产量、可溶性糖、Vc 呈正相关,均匀度 指数与黄瓜产量品质呈负相关。其中碳源利用丰富度 指数与黄瓜果实Vc 含量相关性最高,为0.692,达到 极显著水平。
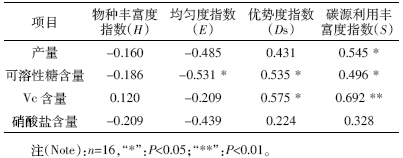 |
Biolog 方法是基于微生物群落对碳源的利用度 来描述微生物功能的动态变化。本文利用Biolog方法 研究不同调控措施对日光温室土壤微生物群落结构 及功能多样性的影响,结果表明,反映土壤微生物代谢活性大小的AWCD值随培养时间的延长而升高, 符合一般微生物利用基质的规律,即存在明显的适应 期、对数增长期、稳定期等阶段[9]。AWCD值越高,土 壤中微生物群落代谢活性也就越高[13]。本研究表明, 施肥能够提高土壤微生物的代谢活性;通过秸秆还田 调节土壤C/N 措施,土壤微生物的代谢活性显著提 高。土壤微生物活性是反映土壤生态系统功能的重要 指标,土壤微生物活性高,土壤生态系统稳定性和缓 冲容量大,功能增强,因而土壤对外来胁迫所引起的 生态系统波动的恢复能力就会提高[14]。
从表征微生物群落多样性的几个常用指数来看, 除不施肥处理外,习惯施肥模式下土壤微生物多样性 指数最低,过量的肥料投入造成土壤微生物功能降 低,生态环境恶化。而秸秆还田调节C/N 措施下物种 丰富度指数、均匀度指数和碳源利用丰富度指数显著 增加,表明土壤微生物多样性显著提高,这是由于小 麦秸秆含有大量碳水化合物以及氮、磷、钾等营养元 素,具有改善土壤理化性质[15]、补充土壤水分、激发微 生物活性等作用[16]。土壤碳库是保持土壤微生物多样 性的关键[17],秸秆中含有大量易分解、易被微生物利 用的有机物质,添加这类物质有利于促进土壤微生物 增殖[18]。滴灌措施的应用能够保持良好的土壤结构[15], 也能提高土壤微生物多样性。
主成分分析解释了不同处理土壤微生物碳源利 用是否存在差异[19]。通过主成分分析表明,不同的施 肥措施下土壤微生物对碳源的利用能力不同,第1 主 成分解释了大部分的变异,秸秆还田处理分布于第1 主成分正方向,而其他处理分布在第1 主成分负方向 上,表明秸秆还田处理下土壤微生物群落代谢特征发 生改变。土壤有机物质含量和组成的变化可能是影响 不同处理土壤微生物碳源代谢特征的重要原因之一, 秸秆还田处理通过添加含有大量碳水化合物的有机 物质后,土壤中有机物质的含量和组成发生改变,尤其是氨基糖和单糖等物质的含量显著提高,土壤微生 物可利用的碳源趋于稳定[20]。
黄瓜的产量和品质受水肥管理影响较大。本研究 结果表明,施用肥料可以显著提高黄瓜产量,改善黄 瓜品质。但与当地习惯施肥模式相比,秸秆还田和滴 灌措施的应用并没有引起黄瓜显著增产,可溶性糖含 量、Vc 含量和硝酸盐等品质指标也没有显著变化,具 体原因有待于继续研究。黄瓜产量、可溶性糖含量和 Vc 含量与土壤微生物群落优势度指数和碳源利用丰 富度指数呈正相关,表明合理的水肥配合能促进土壤 微生物的生长繁殖,增加土壤微生物群落多样性,进 而促进高产、优质的黄瓜生产。 4 结论
不同处理平均颜色变化率呈现出以下变化规律: 秸秆还田>农民习惯施肥>膜下滴灌>不施肥;显著性 分析表明,施肥能够提高土壤微生物的代谢活性;通 过秸秆还田调节土壤C/N 措施使土壤微生物的代谢 活性显著提高。不同处理的土壤微生物物种丰富度指 数和均匀度指数均以习惯施肥模式最低;通过秸秆还 田调控土壤C/N 和滴灌措施对习惯施肥模式进行改 进,微生物多样性指数显著提高。不同处理土壤微生 物碳源代谢特征发生分异,秸秆还田处理分布于第1 主成分正方向,得分系数在4.91~5.50 之间;其他处理 分布在第1 主成分负方向,得分系数在-3.26~-0.18 之间。
与习惯施肥相比,秸秆还田和膜下滴灌处理黄瓜 产量和品质均无显著变化。微生物多样性指数中优势 度指数和碳源利用丰富度指数与黄瓜产量、果实可溶 性糖和Vc含量成正相关。
通过秸秆还田和膜下滴灌2 种措施均有助于改 善土壤微生态环境,尤以前者效果最佳。
| [1] | 余海英, 李廷轩, 周健民,等. 设施土壤盐分的累积、迁移及离子组成变化特征[J]. 植物营养与肥料学报, 2007, 13(4): 642-650. YU Hai-ying, LI Ting-xuan, ZHOU Jian-min, et al. Salt accumulation,translocation and ion composition in greenhouse soil profiles[J]. PlantNutrition and Fertilizer Science, 2007, 13(4): 642-650.(in Chinese) |
| [2] | 黄得志, 任晓燕,吴明丽,等. 设施栽培对土壤环境质量的影响[J]. 甘肃农业大学学报, 2011, 46(3): 70-73. HUANG De-zhi, REN Xiao-yan, WU Ming-li, et al. Influence of installation cultivation on soil environmental quality[J]. Journal of GansuA gricultural University, 2011, 46(3): 70-73.(in Chinese) |
| [3] | 张乃明, 董 艳. 施肥与设施栽培措施对土壤微生物区系的影响[J]. 生态环境, 2004, 13(1): 61-62. ZHANG Nai-ming, DONG Yan. Effects of fertilization and protectedsoil planting on soil microflora[J]. Ecology and Environment, 2004, 13(1): 61-62.(in Chinese) |
| [4] | Steenwertha K L, Jacksona L E, Caldero F J, et al. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California[J]. Soil Biology and Biochemistry, 2002,34(11): 1599-1611. |
| [5] | Garland J L, Mills A. Classification and characterization of heterotrophicmicrobial communities on the basis of patterns of community-level solecarbon-source utilization[J]. A pplied and Environmental Microbiology,1991, 57(8): 2351-2359. |
| [6] | 王晓玥, 蒋瑀霁, 隋跃宇,等. 田间条件下小麦和玉米秸秆腐解过程中微生物群落的变化——Biolog 分析 [J]. 土壤学报, 2012, 49(5):1003-1011. WANG Xiao-yue, JIANG Yu-ji, SUI Yue-yu, et al. Changes of microbial communities during decomposition of wheat and maize straw: analysis by Biolog[J]. A cta Pedologica Sinica, 2012, 49(5): 1003-1011.(inChinese) |
| [7] | 郑 华, 欧阳志云, 王效科,等. 不同森林恢复类型对土壤微生物群落的影响[J]. 应用生态学报, 2004, 15(11): 2019-2024. ZHENG Hua, OUYANG Zhi-yun, WANG Xiao-ke, et al. Effects of forest restoration patterns on soil microbial communities[J].Chinese JournalofA pplied Ecology, 2004, 15(11): 2019-2024.(in Chinese) |
| [8] | 侯晓杰, 汪景宽, 李世朋 . 不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响[J]. 生态学报, 2007, 27(2): 655-661. HOU Xiao-jie, WANG Jing-kuan, LI Shi-peng. Effects of different fertilization and plastic-mulching on functional diversity of soil microbialcommunity[J]. A cta Ecologica Sinica, 2007, 27(2): 655-661.(in Chinese) |
| [9] | 时 鹏, 高 强, 王淑平,等. 玉米连作及其施肥对土壤微生物群落功能多样性的影响[J]. 生态学报, 2010, 30(22): 6173-6182. SHI Peng, GAO Qiang, WANG Shu-ping, et al. Effects of continuouscropping of corn and fertilization on soil microbial community functionaldiversity[J]. A cta Ecologica Sinica, 2010, 30(22): 6173-6182.(in Chinese) |
| [10] | 杨宇虹, 陈冬梅, 晋 艳, 等. 不同肥料种类对连作烟草根际土壤微生物功能多样性的影响[J]. 作物学报, 2011, 37(1): 105-111. YANG Yu-hong, CHEN Dong-mei, JIN Yan, et al. Effects of differentfertilizers on functional diversities of microbial flora in rhizospheric soilof monoculture tobacco[J]. A cta A gronomica Sinica, 2011, 37(1): 105-111.(in Chinese) |
| [11] | 张海涵, 唐 明, 陈 辉, 等. 黄土高 5 种造林树种菌根根际土壤微生物群落多样性研究[J]. 北京林业大学学报, 2008, 30(3): 85-90. ZHANG Hai-han, TANG Ming, CHEN Hui, et al. Diversity of soil microbial communities in the mycorrhizosphere of five afforestation treespecies in the loess plateau[J]. Journal of Beijing Forestry University,2008, 30(3): 85-90.(in Chinese) |
| [12] | 杨永华, 姚 健, 华晓梅. 农药污染对土壤微生物群落功能多样性的影响[J]. 微生物学杂志, 2000, 20(2): 23-25. YANG Yong-hua, YAO Jian, HUA Xiao-mei. Effect of pesticide pollution against funcition microbial dicersity in soil[J]. Journal of Microbiology, 2000, 20(2): 23-25.(in Chinese) |
| [13] | Konopka A, Oliver L, Turco R F. The use of carbon substrate utilizationpatterns in environmental and ecological microbiology[J]. Microbial Ecology, 1998, 35(2): 103-115. |
| [14] | O'Flahery S. Comparison of phenotypic, functional and genetic diversity of bacterial communities in soils[C]//Ress R M, Campell B C, et al. Sustainable management of organic matter. Wallingford: CABI Publishing, 2001, 370-376. |
| [15] | 李 欣,徐 钰, 江丽华,等. 不同调控措施对设施蔬菜土壤理化性质的影响[J]. 山东师范大学学报: 自 然科学版, 2012, 27(1): 92-96. LI Xin, XU Yu, JIANG Li-hua, et al. Effect of different control measueres on soil physicochemical properties under greenhouse cultivation[J]. Journal of Shandong Normal University: Natural Science, 2012, 27(1): 92-96.(in Chinese) |
| [16] | Debosza K, Peter H R, Pedersena A R. Temporal variations in microbial biomass C and cellulolytic enzyme activity in arable soils: effects oforganic matter input[J]. A pplied Soil Ecology, 1999, 13(3): 209-218. |
| [17] | Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327: 1008-1010. |
| [18] | Degens B P, Schippera L A, Sparlinga G P, et al. Decreases in organicreserves in soils can reduce the catabolic diversity of soil microbialcommunities[J]. Soil Biology and Biochemistry, 2000, 32(2): 189-196. |
| [19] | Mubarak A R, Rosenani A B. Soil organic matter fractions in humidtropics as influenced by application of crop residues[J]. Communications in Soil Science and Plant A nalysis, 2003, 34(7/8): 933-943. |
| [20] | 罗希茜, 郝晓辉, 陈 涛, 等. 长期不同施肥对稻田 土壤微生物群落功能多样性的影响[J]. 生态学报, 2009, 29(2): 740-748. LUO Xi-qian, HAO Xiao-hui, CHEN Tao, et al. Effects of long-termdifferent fertilization on microbial community functional diversity inpaddy soil[J]. A cta Ecologica Sinica, 2009, 29(2): 740-748.(in Chinese) |
 2014, Vol. 31
2014, Vol. 31