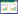文章信息
- 陈媛, 王立, 马放, 姜晓峰, 董静
- CHEN Yuan, WANG Li, MA Fang, JIANG Xiao-feng, DONG Jing
- 丛枝菌根真菌对鸢尾的促进作用研究
- Role of Arbuscular Mycorrhizal Fungi on Iris
- 农业资源与环境学报, 2014, 31(3): 265-272
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0051
-
文章历史
- 收稿日期:2014-03-17
丛枝菌根真菌(arbuscular mycorrhiza fungi)简称AMF,是一类比较古老的土著真菌,广泛存在于自然界的各类生态环境中,并能够与地球上绝大多数的植物形成菌根[1],这一共生体系的构建可以有效提高植物抗病、抗盐、抗重金属、抗寒,促进植物生长发育,增强植物对氮磷的吸收[2, 3, 4, 5, 6]。近年来由于环境问题日益突出,江流、湖泊、浅海水域生态系统等富营养化已成为全球性研究热点。植物修复技术不仅能够快速吸附水体和沉积物中的营养物质,分泌产生他感物质抑制水体中有害藻类的生长[7],同时对水体生态系统的物理、化学及生物学特性也有很大程度的影响[8],因此,高等水生植物对水体净化起着十分重要的作用,被广泛应用于富营养化水体修复[9, 10, 11, 12, 13]。
鸢尾(Iris)为水陆两栖植物,适应性强,喜光耐半阴,耐寒喜水湿[14]。1842 年Nageli 在观察鸢尾时发现了AM,随后亦有学者对AMF侵染鸢尾科植物的菌根结构类型及AM 真菌分布进行研究,结果表明:鸢尾科植物为P型菌根,以此为宿主植物的真菌主要有聚生球囊霉、幼套球囊霉和摩西球囊霉等[15]。对于具有水体净化功效的水生植物而言,鸢尾兼具水体净化与观赏价值,将其应用于景观水体生态修复的实际工程中,净化水体的同时还可以美化环境[10, 11, 12]。菌根技术与植物吸附相结合可以有效缓解人工湿地中植物生长周期过长,单一植物对富营养化水体氮磷吸收有限及多种植物搭配种植造成生态位竞争等问题。因而,菌根-植物耦合的复合生物净化系统可以广泛适用于景观水体的生态修复,成为污染水体生态修复新的研究方向。本文通过对不同丛枝菌根真菌与鸢尾耦合生态系统的构建,重点从共生体系的生长情况、土壤的理化性质及植物光合作用方面综合评价菌剂对鸢尾的促进作用,进而为AMF与植物耦合的生态体系在水体修复实际工程的应用提供理论依据。 1 材料与方法 1.1 供试材料与试验地点
供试菌剂:供试 AMF 为广适菌种———摩西球囊 霉(G. mosseae)和根内球囊霉(G. intraradices)
供试植物:选用景观植物黄花鸢尾(Iris),种子来 自北京林洁天禾生态花卉中心。种子用水浸泡直至鸢 尾种子全部沉入水底时,30 ℃保湿催芽,挑选芽长基 本一致的鸢尾种子30 粒均匀地撒在4.0 kg 基质中, 表面覆基质约2 cm每日早晚浇水2 次,每次4 L,待 鸢尾幼苗长至3 叶期时移苗进行试验。
供试基质:以土壤、沙、蛭石(2:5:3)混合配制的营 养土为栽培基质。
盆栽试验:盆钵长45 cm,宽16 cm,高20 cm。移 栽试验样本前有0.1%的高锰酸钾溶液浸泡30 min, 晾干后加入基质。
试验地点:试验在哈尔滨工业大学城市水资源与 水环境国家重点实验室进行。 1.2 试验设计
试验设置3 个处理:处理1 为空白基质,处理2 为空白基质加根内球囊霉,处理3 为空白基质加摩西 球囊霉,其中处理2 和处理3 各加50 g菌剂,每个处 理设3个重复。空白基质在压力(0.15 MPa)、温度 (121 ℃)条件下蒸汽灭菌2 h。 1.3 调查项目及测定方法
植株高度(cm):用软尺测量,从盆钵上表面到鸢尾生长点的长度。
总生物量:鸢尾地下根部洗净沙土并用滤纸吸干 根部表面后与地上部分105℃杀青5 min 后80 益烘 干至恒重,称量得地上、地下生物量,两部分生物量之 和为植物总生物量。
土壤样品pH值的测定采用电位法。
土壤样品有机质含量的测定采用重铬酸钾容量 法测定。
土壤样品及植物C、N 含量的测定采用元素分析 仪测定。
土壤样品及植物P含量的测定:经微波消解仪消 解完全后,使用等离子体原子发射光谱仪测定。 土壤的理化性质测定参照参考文献[16]。
植物光合作用参数和土壤的呼吸速率采用便携 式光合仪测定[17]。 1.4 分析与统计方法
鸢尾对氮、磷吸收率的计算公式为:

鸢尾光合曲线的绘制:以光合有效辐射PAR 为 横轴,PN为纵轴绘制光合作用光响应曲线,依据 Bassman 等[18]方法拟合:



计算暗呼吸速率(Rd):

采用EXCEL 2003 和SPSS 17.0 软件对所有数据 进行统计分析,采用单因素方差分析(one-way ANOVA)比较不同数据组间的差异。 2 结果与讨论 2.1 植物的生长指标
如图 1所示,接种摩西球囊霉和根内球囊霉都显著(P<0.05)促进了鸢尾的株高和生物量。其中植物的 株高、总生物量和地上/地下部分生物量的大小排列 顺序为:摩西球囊霉高于根内球囊霉,空白植物最低, 由此可以看出:摩西球囊霉对鸢尾生长的促进作用要 高于根内球囊霉,且菌剂对植物地下根系部分的促生 作用更为显著(P<0.05)。AMF 对鸢尾产生促生作用 主要是因为:与空白鸢尾根系相比,AMF 与鸢尾构建 共生体系可以利用其庞大的菌丝网络延伸到根系无 法达到的区域去吸收土壤中的营养物质,扩大了营养 元素的吸收面积,增强了根系对营养物质的吸收利 用,进而提高了植物的新陈代谢促进了植物的生长。 研究发现菌根真菌通过改变宿主植物根细胞的渗透 性及提高酶活性而加强宿主植物对营养物质的吸 收,同时其外延菌丝也能从土壤中吸收一部分矿质养 分[19]。AM 真菌不仅可以在宿主植物和土壤之间形成 一个具有养分转运功能的菌丝网,还可以在宿主植物 群体间甚至宿主植物和其他植物之间形成菌丝桥,从 而加强植物对营养物质的吸收利用[20]。早有研究发现 在同种或不同种植物间存在菌丝桥,同时菌丝桥可以 将濒死根系内的磷大量输向活根系[19]。Maud Fillion 等[21]研究发现由AMF 和宿主植物构建的共生体系主 要直接影响宿主植物对磷的吸收,进而通过提高植物 的生物量来增强植物对污染物的修复功效。
|
| 图 1 3种处理下植物株高(a)和生物量(b)的比较 Figure 1 Plant growth(a)and biomass(b)under three kinds of treatments |
由土壤的各项理化性质指标可以看出不同的 AMF与植物所构建的共生体系对土壤的理化性质都 有不同程度的影响。由图 2 所示,AMF与鸢尾建立的 共生体系提高了土壤的呼吸速率同时降低了土壤的 pH值、有机质含量和碳氮比,其中摩西球囊霉对土壤 呼吸速率、有机质含量及碳氮比的影响更显著(P< 0.05)。土壤呼吸所释放的二氧化碳量主要来源于土 壤中微生物、土壤动物、植物根际的呼吸作用以及土 壤生化反应方面。在土壤呼吸过程中,其释放量是土 壤生物强弱的综合指标,土壤的呼吸速率直接影响着 植物的生长代谢,不同AMF加速了土壤的呼吸速率, 增强了土壤微生物的活性,进而促进了植物对水分和 矿物质的吸收效率,降低植物的叶片温度,对植物的 生长更有益[22]。共生体系的建立降低了土壤的pH值, 其原因主要是在植物的生长过程中会分泌出一些维 持植物自身生长的根际分泌物如有机酸等,AMF 与 鸢尾构建的共生体系加快了有机酸等一类物质的分 泌,进而降低了土壤的pH 值。土壤的pH 值是影响 AMF生长的一个重要因子,能够直接影响孢子发芽 和菌丝的生长。而pH 值过高或是过低都不利于菌根 的发育。由图 2可以看出:2种AMF都使土壤的pH值 有了不同程度的降低,但是差异并不显著(P>0.05), 由此可见,不同AMF对植物造成的影响并非是通过 改变土壤的pH值来实现的。AMF与鸢尾构建的生态 体系提高了土壤的呼吸速率,促进了植物的新陈代 谢,因而根系活动更旺盛,最终加速了植物对土壤中 水分、有机质和有机碳的利用。

|
| 图 2 不同处理下土壤的理化性质 Figure 2 The nature of the soil under different treatments |
如图 3所示,由AMF与鸢尾构建的生物系统促进了植物对土壤中氮磷元素的吸收转化利用,与无菌剂侵染的空白植物相比,摩西球囊霉与鸢尾的耦合体系对氮元素的吸收率提高71.75%,磷元素的吸收率提高8.36%;而根内球囊霉作用的鸢尾对氮元素的吸收率提高42.55%,磷元素的吸收率提高9.5%。不同菌剂对鸢尾吸收氮磷元素的促进作用存在明显差异,对于氮元素在植物体内的积累量摩西球囊霉的促进作用要好于根内球囊霉,而根内球囊霉对磷元素在植物体内的促进效果要优于摩西球囊霉,这与氮磷元素在土壤中的迁移转化规律一致,接种摩西球囊霉的土壤中氮元素的积累量要小于接种根内球囊霉的土壤,而磷元素的积累量却大于根内球囊霉的,由此可见,AMF能够促进植物对氮磷元素的吸收,进而促进植物的生长发育,提高植物的生物量。Christensen K K等[23]发现在低营养浓度的湖泊中,AMF 共生体系促进水生植物对营养物质的吸收,并且植物体内的N、P含量明显高于非侵染植物。与空白植物的根系相比,丛丝菌根真菌根外菌丝能够吸收土壤中无机态的铵根离子、硝酸根离子[24],通过一定的途径转化为精氨酸,向根内菌丝输送,最终分解为氨氮向宿主植物运输。相对于硝酸盐而言,菌丝对铵盐的吸收能力更强[25]。而磷元素的去除主要是通过植物的吸收作用和基质的吸附作用,其中植物吸收占小部分,基质吸附占大部分。

|
| 图 3 氮磷在不同处理下迁移转化 Figure 3 Migration and transformation of nitrogen and phosphorusunder under different treatments |
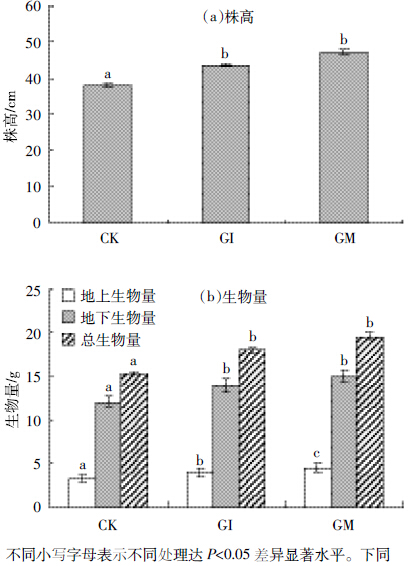
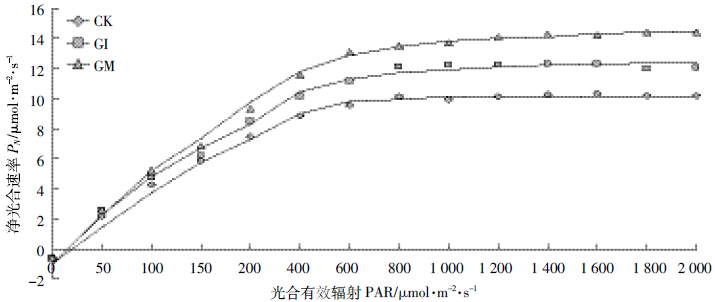
光合作用是影响鸢尾生长的最主要因素,通过对 光合作用参数的测定可以直接评价不同AMF 对鸢尾 生长状况的影响,本研究对不同处理下生长初期的鸢 尾光合作用情况进行了测定,结果见图 4~图 8。根据 经验公式对鸢尾在不同处理下随光照强度的变化对 净光合速率进行拟合,拟合参数列于表 1 中。
|
| 图 4 自然CO2浓度条件下不同处理鸢尾的光响应曲线 Figure 4 Iris light response curves under different treatments |
|
| 图 5 不同处理下鸢尾蒸腾速率的光响应曲线 Figure 5 Iris transpiration rate of light response curves under different treatments |
|
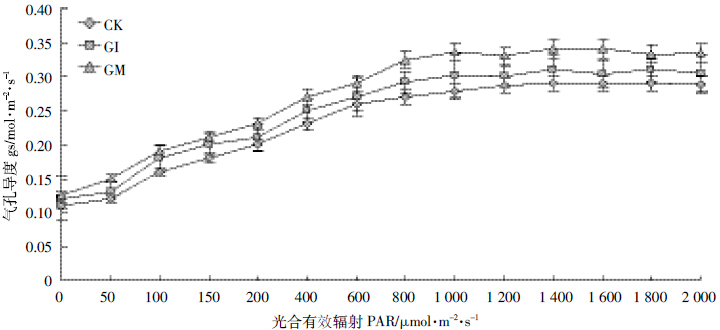
| 图 6 不同处理下鸢尾气孔导度的光响应曲线 Figure 6 Iris stomatal conductance of light response curves under different treatments |
|
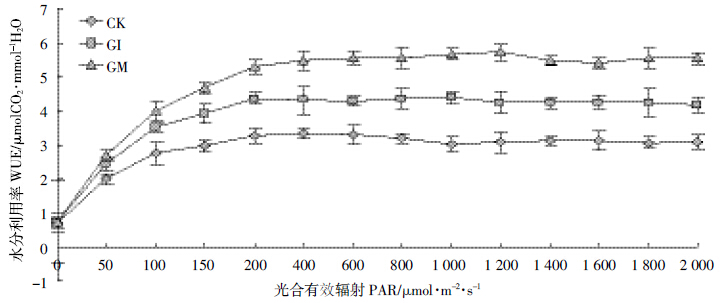
| 图 7 不同处理下鸢尾水分利用率的光响应曲线 Figure 7 Iris water use efficiency of light response curves under different treatments |
|
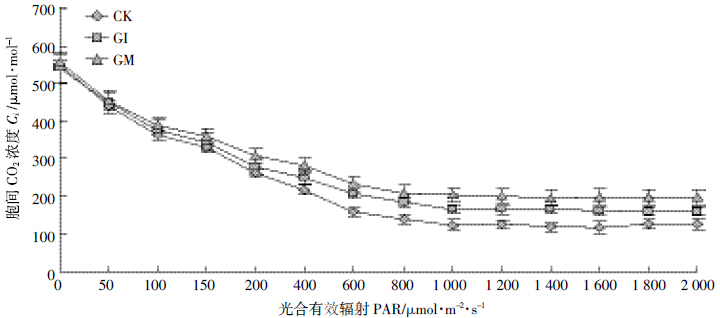
| 图 8 不同处理下鸢尾胞间CO2浓度的光响应曲线 Figure 8 Light response of intercellular CO2 concentration under different processing conditions of Iris |
 |
如图 4 所示,AMF 显著提高了鸢尾的净光合速率,随着光合有效辐射的增强,不同处理下的鸢尾净光合速率PN呈现起初加速而后趋于稳定的饱和指数规律,其中摩西球囊霉对鸢尾的促进作用高于根内球囊霉。由光响应曲线拟合的特征参数得知:AMF提高了鸢尾的α值,也就是说,AMF与鸢尾构建的耦合体系增强了鸢尾捕光以及对弱光利用的能力,在不改变植物呼吸消耗下,最大净光合速率明显高于空白植物,其中摩西球囊霉对鸢尾的促进作用要好于根内球囊霉。与此同时,AMF不同程度地降低了植物的光饱和点和光补偿点,自然状态下耦合体系更易达到光饱和状态,其中,摩西球囊霉对鸢尾光饱和点的影响较为明显而根内球囊霉对鸢尾光补偿点的影响更为显著。
如图 5~图 8 所示,随着光合有效辐射的增强,不同处理的鸢尾蒸腾速率E、水分利用率WUE、气孔导度gs 均同净光合速率PN呈现类似的增长规律,而胞间CO2 浓度Ci 则随着有效光辐射的加强而递减,降低趋势为先加速后趋于稳定的倒饱和指数函数形式。其中,AMF显著提高了鸢尾的水分利用率、净光合速率、胞间CO2浓度、气孔导度且差异显著(P<0.05)。同时,AMF 降低了鸢尾的蒸腾速率,其中摩西球囊霉对鸢尾光合作用的调节要好于根内球囊霉,但差异不显著(P>0.05)。水资源的利用是对光合作用生产和蒸腾作用消耗之间不断权衡的结果,也是反映植物对资源利用策略的有效生理指标,不同光合碳同化途径植物具有不同的资源利用对策。其中C3 植物最优WUE的获得是通过尽可能提高PN,而C4 植物则是通过降低E 来完成的[17],因而AMF 与植物耦合系统最优水资源利用率的获得路径如同C4植物。气孔作为植物与外界接触的最直接的路径,时刻权衡着植物水分的散失以及光合养料的获得,与未侵染菌剂的空白植物相比,AMF 与植物构建耦合体系随着光辐射的加强而逐渐增加气孔开启的导度,同时加强逐渐趋于饱和的气孔导度,在共生体系中AMF主要通过调节其气孔导度来调控植物净光合速率与蒸腾速率之间的平衡以及胞间CO2的释放,最终获得植物的最优水资源利用率,也就是说,AMF 通过调节植物的光合作用进而促进了植物的生长发育。 3 结论
丛枝菌根真菌对鸢尾的株高、总生物量、地上/地 下生物量具有不同程度的促进作用。其中摩西球囊霉 对鸢尾的调节作用要好于根内球囊霉。
丛枝菌根真菌对鸢尾的促进作用主要通过地上 及地下两部分共同调节植物的生长:共生体系地下部 分主要依靠庞大的菌丝网络吸收土壤中的营养物质, 其中摩西球囊霉对氮元素在植物体内的吸收促进要 好于根内球囊霉,而根内球囊霉对磷元素在植物体内 的促进效果要优于摩西球囊霉,同时土壤的氮磷含量 也发生了相应改变;地上部分主要通过开启鸢尾的气 孔导度来调控植物净光合速率与蒸腾速率之间的平 衡,进而获得鸢尾的最优水资源利用率,最终促进了 植物的生长发育,其中摩西球囊霉对鸢尾光合作用的 促进作用好于根内球囊霉。
| [1] | 王立, 贾文奇, 马放, 等. 菌根技术在环境修复领域中的应用及展望[J]. 生态环境学报, 2010, 19(2): 487-493. WANG Li, JIA Wen-qi, MA Fang, et al. Perspective of mycorrhizal tech-nology application for environmental remediation[J]. Ecology and Envi-ronmental Sciences, 2010, 19(2): 487-493.(in Chinese) |
| [2] | 张淑娟, 王立, 马放, 等. 丛枝菌根(AM) 对水稻生长促进及化肥减量研究[J]. 哈尔滨工业大学学报, 2010, 42(6): 958-962. ZHANG Shu-juan, WANG Li, MA Fang, et al. Application of arbuscular mycorrhiza on promoting the growth of rice and reducing the usage of chemical fertilizer[J]. Journal of Harbin Institute of Technology, 2010, 42(6): 958-962.(in Chinese) |
| [3] | 李敏, 陈琳, 肖燕, 等. 丛枝真菌对互花米草和芦苇氮磷吸收的影响[J]. 生态学报, 2009, 29(7): 3960-3969. LI Min, CHEN Lin, XIAO Yan, et al. Effects of arbuscularmycorrhiza on absorption of nitrogen and phosphorus of Spartina alternif lora and Phragm ites australis[J]. Acta Ecologica Sinica, 2009, 29(7): 3960-3969.(in Chinese) |
| [4] | 郭修武, 李坤, 郭印山, 等. 丛枝菌根真菌对连作土壤中葡萄生长及根系分泌特性的影响[J]. 沈阳农业大学学报, 2009, 40(4): 392-395. GUO Xiu-wu, LI Kun, GUO Yin-shan, et al. Effect of arbuscular mycor-rhizal fungi(AMF)strains on growth and root exudation characteristics of grapevine[J]. Journal of Shenyang Agricultural University, 2009, 40(4): 392-395.(in Chinese) |
| [5] | Atul-Nayyar A, Hamel C, Hanson K, et al. The arbuscular mycorrhizal symbiosis links N mineralization to plant demand[J]. Mycorrhiza, 2009, 19: 239-246. |
| [6] | 朱红惠, 龙良坤, 羊宋贞, 等. AM 真菌对青枯菌和根际细菌群落结构的影响[J]. 菌物学报, 2005, 4(1): 137-142. ZHU Hong-hui, LONG Liang-kun, YANG Song-zhen, et al. Influence of AM fungus on Ralstonia Solanacearum population and bacterial com-munity structure in rhizosphere[J]. Mycosystema, 2005, 4(1): 137-142.(in Chinese) |
| [7] | Crum S J H, Van Kammen-Polman A M M, Leistra C. Sorption of nine pesticides to three aquatic macrophytes[J]. Archives of Environmental Contamination and Toxicology, 1999, 37(3): 310-316. |
| [8] | Benndorf J. Posibilities and limits for controlling eutrophication by biomanipulation[J]. Int Revue ges Hydrobiol, 1995, 80(4): 519-534. |
| [9] | 王军霞, 张亚娟, 刘存岐, 等. 水生植物在富营养化湖泊生物修复中的作用[J]. 安徽农业科学, 2011, 39(10): 6055-6057, 6110. WANGJun-xia, ZHANGYa-juan,LIUCun-qi, et al. Function of aquatic plants in bioremediation of eutrophic lakes[J]. Journal of Anhui Agri Sci, 2011, 39(10): 6055-6057, 6110.(in Chinese) |
| [10] | 王金丽, 颜秀勤, 宁冰, 等. 浮岛植物净化水质效果研究[J]. 环境科学与技术, 2011, 34(10): 14-18. WANG Jin-li, YAN Xiu-qin, NING Bing, et al. Effect of floating island plant on water purification[J]. Environmental Science & Technology, 2011, 34(10): 14-18.(in Chinese) |
| [11] | 李涛, 周律. 湿地植物对污水中氮、磷去除效果的试验研究[J]. 环境工程, 2009, 27(4): 25-28. LI Tao, ZHOU L俟. Characteristics of several plants for removing nitro-gen and phosphorus from wastewater in constructed wetland[J]. Environ-mental Engineering, 2009, 27(4): 25-28.(in Chinese) |
| [12] | 芦建国, 韩冠苒. 3 种鸢尾属植物对富营养化水体的净化作用[J]. 中国农学通报, 2010, 26(12): 194-196. LU Jian-guo, HAN Guan-ran. Purification efficiency of 3 species of genus iris for europhic water[J]. Chinese Agricultural Science Bulletin,2010, 26(12): 194-196.(in Chinese) |
| [13] | 孙瑞莲, 张建, 王文兴. 8 种挺水植物对污染水体的净化效果比较[J]. 山东大学学报: 理学版, 2009, 44(1): 12-17. SUN Rui-lian, ZHANG Jian, WANG Wen-xing. Effect on polluted waterpurification by eight emergent plants[J]. Journal of ShandongUni-versity: Natural Science, 2009, 44(1): 12-17.(in Chinese) |
| [14] | 马牧-,王兰,孙红文. 黄花鸢尾对富营养化水体净化的试验研究[J]. 农业环境科学学报, 2006,25(2) : 448-452. MA Mu-yuan, WANG Lan, SUN Hong-wen. Purification of eutrophi-cated water by iris Pseudoacorus[J].Journal of Agro-Environment Sci-ence, 2006, 25(2) : 448-452.(in chinese) |
| [15] | 张峰峰. 甘肃盐碱土植物菌根真菌资源与耐盐性研究[D]. 杨凌: 西北农林科技大学, 2007. ZHANG Feng-feng. Saline soil in Gansu province and salt resistance of plant mycorrhizal fungi resources research[D]. Yangling: Northwest A-griculture and Forestry University, 2007.(in Chinese) |
| [16] | 张淑娟. 丛枝菌根在水稻清洁生产中的应用研究[D]. 哈尔滨: 哈尔滨工业大学, 2010. ZHANG Shu-juan. Application of arbuscular mycorrhizae on cleaner production of rice[D]. Harbin: Harbin Institute of Technology, 2010.(in Chinese) |
| [17] | 王立. 松嫩草地优势禾草生理生态的适应特性及其对模拟气候变化的响应[D]. 长春:东北师范大学, 2006. WANG Li. Ecophysiology adaptation of dominant grasses and their re-sponse to simulated climatic changes in the Songnen grassland of China [D]. Changchun: Northeast Normal University, 2006.(in Chinese) |
| [18] | Bassman J, Zwrer J C. Gas exchange characteristics of Populus tri-chocarpa, Populus deltoids and Populs trichocarpa×P.deltoids clone[J]. Tree Physiology, 1991(8): 145-149. |
| [19] | Koide R T, Mosse B. A history of research on arbuscular mycorrhiza[J]. Mycorrhiza, 2004, 14: 145-163. |
| [20] | 张俊伶, 李晓林, 杨志福. VA 菌根菌丝桥及其生态意义 [J]. 世界农业, 1996, 11: 37-40. ZHANG Jun-ling, LI Xiao-lin, YANG Zhi-fu. VA mycorrhizal hyphae bridge and its ecological significance[J]. World Agriculture, 1996, 11: 37-40.(in Chinese) |
| [21] | Maud Fillion, Jacques Brisson, Werther Guidi. Increasing phosphorus removal in willow and poplar vegetation filters using arbuscular mycor-rhizal fungi[J]. Ecological Engineering,2011, 37: 199-205. |
| [22] | 石兆勇, 张晓锋, 王发园. 菌根真菌对土壤呼吸的影响[J]. 生态环境学报, 2010, 19(1): 233-238. SHI Zhao-yong, ZHANG Xiao-feng, WANG Fa-yuan. Influence of my-corrhizal fungi on soil respiration[J]. Ecology and Environmental Sci-ences, 2010, 19(1): 233-238.(in Chinese) |
| [23] | Christensen K K, Jensen H S, Andersen F φ. Interferences between root plaqueformation and phosphorus availability for isoetids insedi-ment of oligotrophic lakes[J]. Biogeochemistry, 1998, 43: 107-128. |
| [24] | 彭麟, 刘子芳, 肖文雄, 等. 丛植菌根真菌(AMF) 提高人工湿地去污能力及运行稳定性的潜力分析[J]. 农业环境科学学报, 2012, 31(10): 1869-1878. PENG Lin, LIU Zi-fang, XIAO Wen-xiong, et al. The potential of ar-buscular mycorrhizal fungi(AMF)to improve decontamination capa-bility and operational stability of constructed wetland[J]. Journal of Agro-Environment Science, 2012, 31(10): 1869-1878.(in Chinese) |
| [25] | 李侠, 张俊伶. 丛枝菌根根外菌丝对铵态氮和硝态氮吸收能力的比较[J]. 植物营养与肥料学报, 2009, 15(3): 683-689. LI Xia, ZHANG Jun-ling. Uptake of ammonium and nitrate by external hyphae of arbuscular mycorrhizal fungi[J]. Plant Nutrition and Fertilizer Science, 2009, 15(3): 683-689.(in Chinese) |
 2014, Vol. 31
2014, Vol. 31