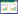文章信息
- 朱文英, 唐景春
- ZHU Wen-ying, TANG Jing-chun
- 小麦秸秆生物炭对石油烃污染土壤的修复作用
- Remediation of Wheat-Straw-Biochar on Petroleum-Polluted Soil
- 农业资源与环境学报, 2014, 31(3): 259-264
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0013
-
文章历史
- 收稿日期:2014-01-13
2.环境污染过程与基准教育部重点实验室, 天津 300071;
3.天津市生态环境修复与污染防治重点实验室, 天津 300071
2.Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education, Tianjin 300071, China;
3.Tianjin Key Laboratory of Environmental Remediation and Pollution Control, Tianjin 300071, China
生物炭是各种生物质材料如木材、农业废弃物(稻草、坚果壳、米壳、甘蔗渣),动物粪肥和下水道污泥[1]等在缺氧条件下高温慢裂解后得到物质,其富含碳,疏松多孔,有着从纳米到中孔的结构和高的表面积[2]。很多研究表明生物炭在碳封存和减少温室气体的排放[3]方面起着很大作用,此外生物炭还可以提高土壤肥力[4]和作物产量,是一种有效的土壤改良剂。另外,越来越多的研究表明,生物炭可以作为环境中污染物的经济、有效的吸附剂[5],它可以应用于水生态系统中营养元素的吸附来避免藻类爆发,也可以吸附水和土壤中的重金属[6],还能控制环境有机污染物的归趋和毒性[7]。Gomez-Eyles 等[8]研究了生物炭对PAH和潜在有毒元素的生物可利用性,结果表明生物炭对PAH 的总量、生物可利用的(可通过环糊精萃取的)量都有降低,总量从449 mg·kg-1减少至306 mg·kg-1,生物可利用的量从276 mg·kg-1 减少至182 mg·kg-1。Kong 等[5]用大豆秆制备的生物炭对水溶液中的菲进行修复,当菲的初始浓度为1 mg·L-1 时,去除率可达99.5%。
目前很多关于生物炭性质的研究都集中在不同 的原材料[9]和不同的裂解温度[10]对其性质的影响,而 且裂解时间也长短不一。本实验在同一裂解温度下裂 解不同的时间制备了小麦秸秆生物炭,考察裂解时间 的长短对其性质的影响,并选择一种生物炭用于石油 污染土壤的实验室修复研究,旨在研究小麦秸秆生物 炭对土壤中石油烃及其组分的去除作用,为进一步的 机理研究和场地试验提供依据。 1 材料与方法 1.1 生物炭的制备及表征
从山东某农田采集小麦秸秆,清洗后烘干,剪成 1 cm 长的小段,称取一定质量的秸秆放于带盖的坩 埚中。密闭好的坩埚放于马弗炉中,在300℃下缺氧 裂解3、6、8 h(分别记为WBC-3,WBC-6,WBC-8)。冷 却至室温后取出,称重。制备好的生物炭放于研钵中 研磨,过60目筛。储存备用。
生物炭的产率通过裂解前后的质量计算:产率 (%)=生物炭质量/小麦秸秆质量伊100%,pH 值根据 GB/T 12496.7—1999《木质活性炭试验方法-pH 值的 测定》测定,灰分测定方法按照GB/T 12496.3—1999 《木质活性炭试验方法灰分含量的测定》,C、H、N 元 素用元素分析仪(EA3000,北京利曼科技有限公司) 测定,表面形态用扫描电镜(S-3500,日本日立公司) 测定。 1.2 石油污染的土壤采集及处理
石油污染的土壤采集自天津大港油田,地理坐标 为38°44′49″N,117°33′55″E。采集来的土壤一部分过 20 目筛添加生物炭后直接培养,另一部分风干、磨 碎、过20 目筛,用于基本性质分析。供试土壤的基本 性质见表 1。
将制备好的300℃、6 h生物炭按照5%的重量比 加入到土壤中,搅拌均匀后放入培养箱内培养,以不 加生物炭的土壤为对照,在同样条件下培养,培养温 度25℃,每日光照时间为9:00—19:00,每日加水保 持一定湿度并翻搅补充氧气,在培养的第14、28 d取 样,风干磨碎,过筛后测土壤中的TPH及其组分。 1.4 总石油烃(TPH)含量分析
总石油烃的含量用超声提取-重量法测定。称取 5.00 g风干土样于50 mL 离心管中,加20 mL 二氯甲 烷混合均匀,在功率为60W下超声萃取15 min,4 000 r·min-1离心10 min,将上清液倒入已恒重的烧瓶中, 重复以上步骤萃取3 次,将全部上清液54℃旋转蒸 发至干,称重。前后重量差即为总石油烃的重量。 1.5 饱和烃、芳香烃分析
超声萃取、旋转蒸发后的总石油烃用正己烷溶 解,层析柱分离。玻璃层析柱规格为10 mm伊100 mm, 填充物在马弗炉内活化后湿法装柱,压实,从下到上 依次为活性硅胶12 cm、活性氧化铝6 cm、无水硫酸钠 1 cm。分别用20 mL正己烷洗脱饱和烃、50 mL二氯甲 烷/正己烷(体积比为1:1)洗脱芳香烃。重量法分析。 1.6 PAH的GC-MS分析
洗脱出的芳香烃旋转蒸发至干后用色谱纯正己 烷溶解,气相色谱-质谱分析。PAH 混合标品购买于 Sigma-Aldrich Co. Ltd,16 种PAHs 通过装有Thermo Scientific TRACE TR-5MS的气相柱子(30 m×0.25 mm, 0.25 μm 膜厚度),氦载气流速保持在1 mL·min-1。 PAH的测定程序如下:70℃ 1 min,10℃·min-1的速度 上升至260 ℃保持4 min,后5℃·min-1上升至300℃ 并保持4 min[11]。 1.7 数据分析
生物炭的产率、灰分、元素组成、芳香性等基本性
质数据,以及修复后对TPH、烷烃、芳烃的修复效果用
SPSS 18.0 进行方差分析。
2 结果与讨论
2.1 生物炭的产率、pH值、灰分及元素分析
生物炭的产率及元素组成见表 2。由表 2 看出,
小麦秸秆在300 ℃下缺氧裂解,裂解时间越长,产率
越低。裂解6 h比裂解3 h的产率明显下降,由产率为
61.258%下降到41.357%,且产率具有显著性差异(P<
0.05);而裂解8 h比裂解6 h的生物炭产率下降幅度
较小,其产率没有显著性差异(P>0.05)。这说明在一定时间范围内,裂解时间越长,生物炭碳化程度越高。
但是表 2 显示的生物炭的C 元素含量并没有随着裂
解时间的延长而升高,而是由3 h到6 h显著升高,6 h
到8 h显著下降,这可能是因为裂解8 h时,更多的有
机碳成分变成了灰分,从而导致灰分含量升高,碳含
量下降。表 2中显示的灰分含量随裂解时间的增加也
说明了这一点。
N元素含量随裂解时间的变化不显著。C/N 值随
裂解时间的延长,先升高后下降,在裂解6 h时达到最
大值51.588。H元素的含量随裂解时间的延长显著下
降,由WBC-3的4.328%下降到了WBC-8的2.677%。
H/C 的值随裂解时间的延长而下降,这说明在一定裂
解温度下,裂解时间越长,生物炭的芳香性越高[12],但
是裂解3 h和6 h制备的生物炭的芳香性具有显著性
差异(P<0.05),而6 h和8 h的生物炭芳香性没有显
著性差异(P>0.05)。另外,生物炭的pH值随裂解时间
的延长而升高,且裂解3 h和6 h制备的生物炭的pH
值具有显著性差异(P<0.05),而6 h和8 h的pH 值无
显著性差异(P>0.05)。
Kong 等[5]的研究表明,大豆秆700℃制备的生物
炭,比其他条件下制备的生物炭碳化度高,灰分含量、
比表面积也较高,其对亚甲蓝的吸附效果也最好。而
由以上生物炭的性质随裂解时间的变化可知,碳含量
在裂解6 h时最高,且裂解6 h 时的灰分、pH 值、芳香
性等显著高于裂解3 h,6 h和8 h时则无显著性差
异,同时考虑到时间和能源成本,选择裂解6 h制备
的生物炭用于石油污染土壤的修复。
2.2 生物炭表面形态
图 1 为300℃裂解6 h制备的小麦秸秆生物炭的扫描电镜图,由图 1看出,它具有疏松的管状结构。
这种结构能增大比表面积[13],从而增强其对PAH 等
有机污染物的吸附能力[14]。
Obst 等[15]在亚微米尺度下对PAH 在不同生物炭
颗粒上的吸附研究表明,菲积累在生物炭互相连通的
孔隙中。另外,生物炭的这种互相连通的孔隙和大的
比表面积能为微生物提供良好的生存环境,刺激某些
微生物的繁殖和活性[16],从而使石油烃等有机污染物
通过直接分解、共代谢和菌根际作用而降解[17]。
2.3 土壤中总石油烃及其组分的含量
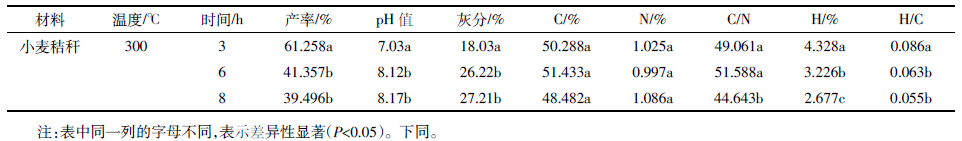
土壤中总石油烃及其组分含量见表 3。由表 3 看
出,通过培养,不添加任何修复材料和添加生物炭修
复的土壤中,TPH、烷烃及芳烃的含量都有了明显的
下降,培养后TPH 最高下降了46.88%,烷烃最高下
降了20.91%,芳烃最高下降了20.60%。之所以经培养后总石油烃及其组分的含量有了很大的降低,可能
是合适的温度、水分及光照为微生物提供了适宜的生
存条件,刺激了它们的生长繁殖,加速了对石油烃的
利用;另外,一定的光照、温度等条件也促使石油烃的
某些成分通过光降解和易挥发组分的挥发而去除。另
外,CK 培养28 d和生物炭培养14、28 d后,饱和烃减
少率>芳香烃减少率,这是因为饱和烃比芳香烃更容
易降解[18]。
但是,在同样的条件下培养14 d,添加生物炭修
复组和对照组对TPH 修复效果具有显著差异(P<
0.05),添加生物炭后其减少率达45.48%,而对照组只
减少了42.32%。这说明添加生物炭能加快总石油烃
的去除,可能是生物炭吸附了石油烃,也可能是生物
炭使得微生物的量和活性增强,加快了对石油烃的利
用;同样培养14 d,烷烃的去除率也是生物炭修复组
显著大于对照组(P<0.05),这也可能是烷烃降解菌的
数量和活性增加引起的;但从表 3 中还可看出,并不
是石油烃的每个组分的减少率都是生物炭修复组比
对照组高,芳香烃的去除率是对照组比生物炭组高,
分别为20.60%和16.00%,可能是因为生物炭修复组
中的一部分芳香烃被生物炭吸附后,降低了微生物的
生物可利用性[8],或者被吸附的多环芳烃在生物炭的
孔隙中阻碍了光降解的进行和易挥发组分的挥发,另
外还可能是因为生物炭的高含碳量致使吸附在上面
的PAHs难以降解。Robert 等[19]的研究就说明了这一
点,他于1986 年比较了苯并[a]芘和芘在8 种煤灰上
的光降解,结论表明煤灰的高含碳量有效抑制了苯并
[a]芘和芘的光降解。黄国兰等[20]也发现PAH在3种颗
粒上的半衰期随着颗粒含碳量的增加而延长。培养
28 d的土壤TPH 去除率也是生物炭组>对照组,且二
者具有显著性差异(P<0.05),而烷烃和芳烃去除率均
为对照组>生物炭组,这同样可能是由于生物炭降低
了生物可利用性所致。
另外,从表 3 中还可以看出,无论是对照组还是
生物炭组,TPH 去除率都是28 d>14 d,这说明,随着
培养时间的延长,TPH的修复效果会增强。但表 3 中
显示的石油烃各组分的去除并不是时间越长效果越
好:对照组烷烃和其他组分的减少率28 d>14 d,芳烃
减少率14 d>28 d;生物炭组烷烃和芳烃减少率都是
14 d>28 d,其他组分减少率28 d>14 d。
值得注意的是,芳烃减少率最高的一组是CK 培
养14 d,而延长培养时间和添加生物炭都没能增大其
减少率。CK 组培养28 d后,芳香烃降解率为14.37%,
比培养14 d的降解率低,即芳香烃的含量在14 d到
28 d 呈上升趋势,这与王斐等[21]用牛粪堆肥对含油污
泥进行生物处理的结果类似,从0 到30 d,芳香烃的
含量呈上升趋势,这可能是随培养时间的延长,石油
的其他组分降解生成的中间产物未能被微生物利用
所致[22]。同样,生物炭修复组的芳香烃降解率也有类似
的结果,培养14 d的减少率比培养28 d的减少率高,
分别为16.00%和3.58%,这可能是其他组分的降解的
中间产物积累,也可能是被生物炭吸附的芳香烃在培
养过程或者萃取过程的重新释放所致。对照组和生物
炭组其他组分的降解率都随培养时间的延长而增大,
这是因为部分沥青质在一定条件下也能降解[23]。而
Khokhlova 等[24]用生物炭吸附剂修复石油污染土壤的
研究中,30~40 d后,芳香烃和烷烃的含量都明显下降,
胶质和沥青质含量显著增加,所以本实验还需继续取
样测定TPH及各成分的变化以研究长期修复效果。
2.4 几种PAH的含量
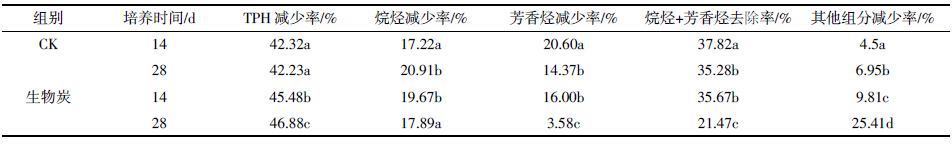
由表 3已经知道,重量法测定的芳香烃在添加和
未添加生物炭修复一定时间后都有了不同程度的减
少,但这并不意味着各修复组的每种PAH 的含量都
有了下降,如表 4 所示,对比修复前的土壤中萘、苊、
苯并[a]蒽、屈、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、
茚并[1,2,3-cd]芘的含量,修复后各种PAH 的变化情
况不一致。其中苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘3
种PAH的含量比修复前都有下降,下降幅度最高的
是苯并[a]芘,未添加修复剂培养14 d的苯并[a]芘含
量下降了95.15%,而添加生物炭修复14 d下降了98.18%,二者具有显著性差异(P<0.05)。
由表 4还可看出,培养14 d后与修复前相比,对
照组各种PAH的含量变化不一致,苊、苯并[k]荧蒽和
苯并[a]芘的含量下降,其减少率分别为7.17%、41.69%、
95.15%,其他PAH不变或有所升高。而生物炭修复组
每种PAH的含量都比修复前显著下降,并且与对照
组相比,表 4 中有7 种PAH含量具有显著性差异(P<
0.05)。培养28 d后,对照组仍然是苊、苯并[k]荧蒽和
苯并[a]芘的含量比修复前下降,并且比培养14 d的相
应PAH 含量显著降低,即这几种PAH能随培养时间
的延长而继续减少,而其他几种PAH含量与修复14 d
时无显著差异,即在不添加任何修复剂条件下,这几
种PAH含量基本不变。培养28 d后的生物炭修复组,
除苯并[k]荧蒽的含量比14 d的含量低外,其他PAH
的含量都比培养14 d的含量高,这与表 3中所显示的
生物炭组的芳烃降解率28 d<14 d的结果一致。不同
PAH的含量变化趋势不同,这可能是由于PAH自身
的性质以及和生物炭之间的相互作用所致,Korfmacher等[25]就把吸附在煤灰上的PAH 对光的抵抗力归因
于PAH自身的性质和它们在煤灰上的物理性质。
2.5 生物炭本身芳烃含量的影响
生物炭本身也可能含有多环芳烃[26]。Hale 等[27]用
不同的方法定量研究了59 种250~900℃慢裂解的生
物炭中总的和生物可利用的多环芳烃,结果表明,所
有慢裂解产生的生物炭中,多环芳烃的总含量和生物
可利用的含量均低于土壤环境质量标准。另外有限数
量的生物炭的分析表明,燃烧过程产生的有毒的物质
如PAH不会超过环境风险水平[28]。因此,生物炭作为
修复剂加入土壤中,其本身的芳烃含量不会对修复效
果产生影响。
3 结论
小麦秸秆的裂解时间对生物炭产率、灰分、pH
值、C 含量、芳香性都有影响,裂解时间越长,产率越
低、灰分含量越高、pH 值越高、C 含量先升高后下降、
芳香性越高。但是,这些指标的变化都是从3 h到6 h
变化较快,从6 h到8 h变化较慢,产率、芳香性、pH
值等在3 h和6 h的值具有显著性差异,而6 h和8 h
的值没有显著性差异。
修复28 d后,生物炭修复组对TPH的去除率比
对照组高,且2 个组别的TPH 去除率具有显著性差
异(P<0.05);TPH去除率随培养时间的延长而增大,而
烷烃和芳烃去除率却不一定随着生物炭的添加和培养时间的延长而增大。
生物炭修复14 d后,萘、苊、苯并[a]蒽、屈、苯并
[b]荧蒽、苯并[a]芘、茚并[1,2,3-cd]芘的含量比对照组
显著降低(P<0.05)。28 d后,某些种类的PAH含量比
对照组高。
生物炭对石油污染的土壤有一定程度的修复作
用,但是还应延长修复时间,继续测定生物炭石油烃
的修复效果,并对微生物群落的变化进行跟踪。

图 1 300 ℃裂解6 h 制备的小麦秸秆生物炭的扫描电镜图
Figure 1 SEMof biochar made from wheat straw at 300℃for 6 h
| [1] | Sohi S P, Krull E, Lopez-Capel E, et al. A review of biochar and its use and function in soil[J]. Advanced in Agronomy, 2010, 105: 47-82. |
| [2] | Marris E. Putting the carbon back: black is the new green[J]. Nature, 2006, 422(10): 624-626. |
| [3] | Zhang Afeng, Cui Liqiang, Pan Gengxing, et al. Effect of biochar amend-ment on yield and methane and nitrous oxide emissions from a rice pad-dyfromTaiLakeplain[J].Agriculture,EcosystemandEnvironment,2010, 139(4):469-475. |
| [4] | Broun Glaser, Johannes Lemann, Wolfgang Zech. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal: A review[J]. Biology and Fertility of Soils, 2002, 35(4): 219-230. |
| [5] | Kong Huoliang, He Jiao, Gao Yanzheng, et al. Cosorption of phenan-threne and mercury(II)from aqueous solution by soybean stalk-based biochar[J]. Journal of Agriculture and Food Chemistry, 2001, 59(22): 12116-12123. |
| [6] | Cao Xinde, Harris Willie. Properties of dairy-manure-derived biochar pertinent to its potential use in remediation[J]. Bioresource Technology, 2010, 101(14): 5222-5228. |
| [7] | Gerard Cornelissen, Orjan Gustafsson. Effects of added PAHs and pre-cipitated humic acid coatings on phenanthrene sorption to environmen-tal black carbon[J]. Environmental Pollution, 2006, 141(3): 526-531. |
| [8] | Jose L Gomez-Eyles, Tom Sizmur, Chris D Collins, et al. Effects of biochar and the earthworm Eisenia fetida on the bioavailability of poly-cyclic aromatic hydrocarbons and potentially toxic elements[J]. Environ-mental Pollution, 2011, 159(2): 616-622. |
| [9] | Keri B Cantrell, Patrick G Hunt, Minori Uchimiya, et al. Impact of pyrol-ysis temperature and manure source on physicochemical characteristics of biochar[J]. Bioresource Technology, 2012, 107: 419-428. |
| [10] | Chun Yuan, Sheng Guangyao, Cary T Chiou, et al. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Sci-ence and Technology, 2004, 38(17): 4649-4655. |
| [11] | Wang Xin, Cai Zhang, Zhou Qixing, et al. Bioelectrochemical stimula-tion of petroleum hydrocarbon degradation in saline soil using U-tube microbial fuel cells[J]. Biotechnology and Bioengineering, 2012, 109: 426-433. |
| [12] | Chen B L, Johnson E J, Chefetz B, et al. Sorption of polar and nonpolar aromatic organic contaminants by plant cuticular materials: the role of polarity and accessibility[J]. Environmental Science and Technology,2005, 39: 6138-6146. |
| [13] | Lehmann J, Joseph S. Biochar for environmental management: science and technology[M]. London: Earthscan, 2009: 1-29, 107-157. |
| [14] | Chen Baoliang, Yuan Miaoxin. Enhanced sorption of polycyclic aro-matic hydrocarbons by soil amended with biochar[J]. Journal of Soils and Sediments, 2011, 11(1): 62-71. |
| [15] | Martin Obst, Peter Grathwohl, Andreas Kappler, et al. Quantitative high-resolution mapping of phenanthrene sorption to black carbon par-ticles[J]. Environmental Science and Technology, 2011, 45(17): 7314-7322. |
| [16] | Steinbeiss S, Gleixner G, Antonietti M. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology and Bio-chemistry, 2009, 41(6): 1301-1310. |
| [17] | Sarand I, Timone S. Microbial biofilms and plasmid harbouring degrada-tive fluorescent pseudomonads in Scots pine mycorrhizosphere devel-oped on petroleum contaminated soil[J]. TEMS Microbiology Ecology, 1998, 27(2): 115-126. |
| [18] | Routani J F, Bosser-Joulak J F, Rambeloarisoa E, et al. Analytical study of asthart crude oil asphaltenes bioremediation[J]. Chemosphere, 1985, 14: 1413-1422. |
| [19] | Robert A Y, Arlene A G, Wehry E L, et al. Photochemical transforma-tion of pyrene and benzo [a] pryene vapor-deposited on eight coal stack ashes[J]. Environmental Science and Technology, 1986, 20(1): 86-90. |
| [20] | 黄国兰, 庄源益, 戴树桂. 颗粒物上多环芳烃的光转化作用[J]. 南开 大学学报: 自然科学版, 1997, 30(1) : 98-101. HUANG Guo-lan, ZHUANG Yuan-yi, Dai Shu-gui. Phototransforma-tion of PAH on particulate matter[J]. ActaScientiarum Naturalium Uni-versitatis Nankaiensis, 1997, 30(1): 98-101.(in Chinese) |
| [21] | 王斐, 唐景春, 林大明, 等. 牛粪强化高含油污泥堆肥生物处理 及评价[J]. 生态学杂志, 2013, 32(1): 164-170. WANG Fei, TANG Jing-chun, Lin Da-ming, et al. An evaluation of in-tensified bio-disposal of oily sludge by composting it with cattle dung [J]. Chinese Journal of Ecology, 2013, 32(1): 164-170.(in Chinese) |
| [22] | Chaineau C H, Rougeux G, Yepremian C, et al. Effects of nutrient con-centration on the bioremediation of crude oil and associated microbial populationsinthesoil[J].SoilBiologyandBiochemistry,2005,37: 1490-1497. |
| [23] | 李凤梅, 郭书海, 牛之欣, 等. 稠油降解菌的筛选及其对胶质和沥青 质的生物降解[J]. 土壤通报, 2006, 37(4): 764-767. LI Feng-mei, GUO Shu-hai, NIU Zhi-xin, et al. Screening of degrad-ing bacteria of thickened oil and its biodegradation on colloid and as-phalt[J]. Chinese Journal of Soil Science, 2006, 37(4): 764-767.(in Chinese) |
| [24] | Khokhlova L, Strelko V, Khokhlov A, et al. Bioremediation of oil-pol-luted soil with sorptive bio-complexes[J]. Shandong Science, 2010, 23(6): 1-4. |
| [25] | Korfmacher W A, Wehry E L, Mamantov G, et al. Resistance to photo-chemical decomposition of polycyclic aromatic hydrocarbons vapor-ad-sorbed on coal fly ash[J]. Environmental Science and Technology, 1980, 14(9): 1094-1097. |
| [26] | Ana M Mastral, Maria S Callen. A review on polycyclic aromatic hy-drocarbon(PAH)emissions from energy generation[J]. Environmental Science& Technology, 2000, 34(15): 3051-3057. |
| [27] | Sarah E Hale, Johannes Lehmann, David Rutherford, et al. Quantifying the total and bioavailable polycyclic aromatic hydrocarbons and dioxins in biochars[J]. Environmental Science & Technology, 2012, 46(5): 2830-2838. |
| [28] | Saran Sohi, Elisa Lopez-Capel, Evelyn Krull, et al. Biochar, climate change and soil: A review to guide future research[R]. CSIRO Land and Water Science Report series ISSN, 2009: 1834-6618. |
 2014, Vol. 31
2014, Vol. 31