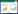文章信息
- 瞿巧钰, 陈珊珊, 刘潇威
- QU Qiao-yu, CHEN Shan-shan, LIU Xiao-wei
- 三种常用氨基甲酸酯类农药人工抗原合成方法的设计与优选
- Design and Selection of Synthesis Methods of Artificial Antigens for Three Frequently-used N-methylcarbamate Pesticides
- 农业资源与环境学报, 2013, 30(6): 101-108
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/
-
文章历史
- 收稿日期:2013-10-10
氨基甲酸酯类农药是我国当前广泛使用的农药 种类之一。该类农药具有分解快、残留期短、高效、选 择性强等特点,代表品种有甲萘威、克百威、涕灭威 等。20 世纪70 年代以来,氨基甲酸酯类农药的使用 量逐年增加,随之带来的农产品中农药残留量超标问 题也日益突出,直接影响着消费者的身体健康和对外 经贸的发展。所以建立快速、高效、经济的检测方法成 为亟待解决的问题[1, 2]。
目前氨基甲酸酯类农药残留检测常采用高效液 相色谱(HPLC)法[3],另外LC-MS/MS 是快速发展的一 种分析技术,具很高的灵敏度和分离能力,近年来在 水果、蔬菜等农残分析上已有了一些应用[4]。但这些方 法需要较昂贵的仪器并且样品前处理过程复杂,因而 难以满足样品快速检测的需要。免疫分析方法具有快 速、特异性强、灵敏度高等优点,近年已被广泛应用于 农药残留检测[5]。农药免疫分析是利用抗原、抗体的特 异性反应来检测农药含量,此方法的关键是制备高特 异性的抗体,以提高检测特异性和灵敏度。根据标记 物的不同,主要农药免疫分析技术分为: 放射免疫分 析(RIA)、酶免疫分析(EIA)、荧光免疫分析(FIA)、化 学发光免疫分析(CLIA)等。1993 年Marco 等[6]最先开 始甲萘威免疫技术的研究,设计并合成总共8 种半抗 原,分别进行多克隆抗体的制备,通过效价评定,筛选 出较高免疫性的人工抗原,为后续甲萘威抗体的制备 以及免疫技术的发展提供了重要的参考。1994 年 Antonio 等[7]就进行了甲萘威单克隆抗体的制备。1994年后,科研人员对甲萘威的研究逐渐增多,根据需要 开发了免疫技术需求,设计合成了不同的人工抗原, 得到相应的高特异性抗体。克百威免疫技术的研究略 晚于甲萘威,1999 年Antonio 等[8]设计合成了4 种克 百威的半抗原,通过单克隆抗体的制备,筛选出较高 免疫性的人工抗原。之后人们不断开发克百威残留的 检测免疫技术。关于涕灭威半抗原的合成及其免疫技 术的研究相对较少。最早的研究是1988 年Brady 等[9] 设计合成了一种半抗原,建立的酶联免疫法对涕灭威 的检测具有较高特异性,但是其最低检出限为0.3 滋g·mL-1。我国对其的研究始于2006年,张彦峰等[10]设 计并合成了一种新的涕灭威半抗原,但是此半抗原还 未在免疫技术上进一步应用。
高质量的抗体是免疫分析方法建立的关键,而合 成高质量的人工抗原又是制备特异性抗体的必备条 件。本文对国内外关于氨基甲酸酯类广泛使用的3 种 农药甲萘威、克百威、涕灭威人工抗原合成过程中的 农药分子半抗原的设计原则、合成方法,人工抗原的 设计、优选及影响因素等方面的研究进展作一综述, 并从中总结一些规律,为促进国内氨基甲酸酯类农药 免疫分析技术的发展提供参考。 1 半抗原的设计与合成
农药小分子半抗原分子的设计及合成是免疫动 物制备单克隆抗体(McAb)或多克隆抗体(PcAb)以及 进一步建立免疫分析法快速检测农药残留的前提、基 础及关键[11]。
选定农药待测物后,应根据其结构选择合适的半 抗原合成方法,如果农药分子含有活性基团,可直 接与连接剂或载体蛋白连接,但大多数农药小分子 没有现成的活性基团,需要作适当的衍生化改造,使 农药原药分子内产生活性基团,即在农药分子末端引 入-COOH、-NHn(n=l 或2)、-SH、-OH、-CHO 等活性 基团后再与连接剂连接[12]。合成半抗原的路径一般有 以下几种方式:直接对农药分子的原药进行衍生化, 利用待测物现有结构,通过氧化、还原、取代、水解等 反应产生相应的功能基团;利用农药分子降解产物或 中间产物合成半抗原;由原料重新合成半抗原,在合 成过程中选择适当步骤用一个有反应功能团的分子 参与反应,从而合成出有反应功能团的半抗原分子; 簇半抗原的制备;半抗原中特征基团的保护等。半抗 原设计需要遵循总体原则:第一,半抗原中要含有目 标物的完整或部分结构特征;第二,半抗原中需要有 一个可以与载体蛋白质发生共价结合反应的活性基 团;第三,半抗原上的空间连接臂长度要适中(通常为 3~6个碳原子的链长)[13]。
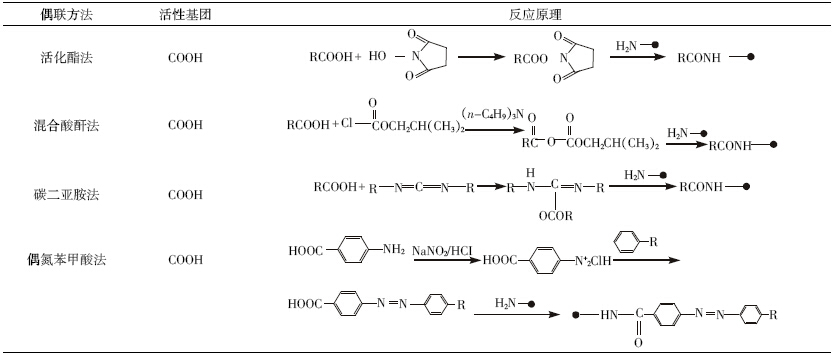
氨基甲酸酯类农药是指在甲酸酯类化合物中,连 于碳原子上的氢原子被氨基取代的化合物,通式见图 1;其中甲萘威、克百威、涕灭威的结构式分别见图 1。
|
| 图 1 氨基甲酸酯类农药通式及甲萘威、克百威和涕灭威分子结构式 |
根据图 1 中3种农药的结构,我们可以看出甲萘 威和克百威的分子结构式相似,都属于取代苯基-N- 甲基氨基甲酸酯类,具有稠环结构和一个较强的吸电 子基团氨基甲酸酯基团,推测稠环和氨基甲酸酯基团 可能为其免疫决定区。而涕灭威属于肟基氨基甲酸酯 类农药,推断其肟基可能为其免疫决定区域。 1.1 甲萘威半抗原的设计与合成
甲萘威(carbaryl),化学名称为1-萘基甲基氨基甲 酸酯(1-naphthyl methylcarbamate),分子式C12H11NO2, 相对分子质量为201,水解主要产物为1-萘酚[14]。
对于甲萘威半抗原的合成与筛选,最早见1993 年Marco 等[6]的研究,在稠环上的不同位置引入不同 的连接臂,合成8 种不同的半抗原。也有许多学者[15, 16, 17] 相继根据所要研究和开发的免疫技术,尝试合成并筛 选不同的半抗原,以达到最好的免疫性和特异性。借 鉴前期学者的经验,近年来人们主要选择的半抗原有 3-(1-萘氧基甲酰胺)-丙酸((3 - [[(1-naphthyloxy) carbonyl]amino] propionic acid,CNA)、6-(1-萘氧基甲 酰胺)-己酸((6 - [[(1-naphthyloxy)carbonyl]amino] hexanoic acid,CNH)、4-(1-萘氧基甲酰胺)-丁酸((4 - [[(1 -naphthyloxy)carbonyl]amino] butanoic acid, CNB)、1-(1-萘基)-3-(5-羧基戊烷基)尿素((l-(lnaphthyl)- 3-(5-carboxypentyl)urea,CPNU),制备出的抗体,均得到较高的效价以及特异性[18, 19, 20]。
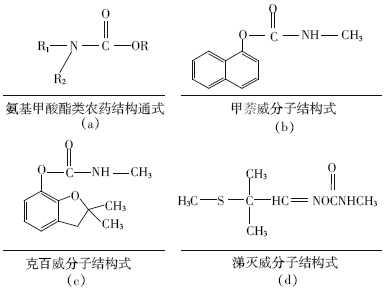
对于甲萘威半抗原的合成方法,国外采用的合成 方法[7, 21]是(合成途径见图 2(a)):在酚盐的水溶液中 通入过量的光气,得到中间产物氯甲酸酯,再用氯甲 酸酯和氨基己酸在氢氧化钠溶液中反应生成半抗原。 实际上用光气合成氨基甲酸酯类农药属于一种传统 的方法,这类方法需要使用大量的光气以及甲苯,极 易造成环境污染,危害人体健康。近几年来,有研究者 不断探究新的合成方法并成功合成了甲萘威半抗 原[22, 23]( 合成途径见图 2(b)),研究采用了对硝基苯氯 甲酸酯制成了萘羧酸酯的结构,避免了直接使用光 气,并获得了较高吸收率(70%),避免了光气和甲苯 的引入所带来的危害作用。
|
| 图 2 2(a)甲萘威半抗原传统合成路线;(b)甲萘威半抗原新合成路线 |
为了能够产生适合目标物的抗原,采用目标化合 物的衍生物作为半抗原也是制备抗体的一种有效 方法。如甲萘威的衍生物1-萘基-N-氨基甲酸酯,N- (2-萘甲酰基)-6-氨基己酸等也可以作为半抗 原[22, 24]。另外,CPNU 的合成可以参照文献[25]中的合 成路线(见图 3)。

|
| 图 3 甲萘威半抗原CPNU合成路径 |
克百威(carbofuran),化学名称为2,3,-二氢-2,2- 二甲基-7-苯并呋喃基-N-甲基氨基甲酸酯(2,3- diydro-2,2-dimethyl-7-benzofurany-N-lmethyl carba原 mate),分子式为C12H15NO3,相对分子质量为221,水 解的主要产物为呋喃酚。
对于克百威人工抗原的合成,研究略晚于甲萘威 半抗原的研究,研究者根据克百威与甲萘威水解后 断裂部位相同,参照了甲萘威半抗原合成方法,从克 百威水解产物呋喃酚入手制备半抗原。1999 年 Antonio Abad 等[8]选择不同的连接臂,合成了4 种克 百威的半抗原分别为3-[[(2,3-二氢-2,2-二甲基-7- 苯并呋喃基氧)羰基]氨基]丙酸(3-[[(2,3-Dihydro- 2,2 -dimethyl -7 -benzofuranyloxy)carbonyl] -amino] - propanoic acid,BFNP)、4-[[(2,3-二氢-2,2-二甲基- 7-苯并呋喃基氧)羰基]氨基]丁酸(4-[[(2,3-dihydro- 2,2-dimethyl-7-benzofuranyloxy)carbonyl]-amino] bu原 tanoic acid,BFNB)、6-[[(2,3-二氢-2,2-二甲基-7- 苯并呋喃基氧)羰基] 氨基]己酸(6-[[(2,3-dihydro-2,2 -dimetyl -7 -benzofuranyl -oxy)carbonyl] -amino hexanoic acid,BFNH)、6-[[(2,2-二甲基-1,3-苯丙二 烷基-4-氧)羰基] 氨基]己酸(6-[[(2,2-dimethyl-1,3- benzodi oxol -4 -oxy)carbonyl] -amino] hexanoic acid, BONH)。根据单克隆抗体的制备,以及酶联免疫方法 的建立,高特异性和亲和性的杂交瘤来自BFNP、 BFNB。之后关于克百威免疫技术的研究中,半抗原的 合成主要都是参考前3 种半抗原,例如Zhu 等[26]在建 立直接酶联免疫吸附技术(Direct competitive enzymelinked immunoassay,CD-ELISA)测定蔬菜中克百威残 留的方法中,合成BFNP作为半抗原,Gui 等[27]在建立 时间分辨荧光免疫技术时,合成BFNB 作为半抗原。 也有研究者以克百威、对硝基苯氯甲酸酯和6-氨基 己酸为反应原料,避免传统的三光气化学合成工艺, 合成克百威半抗原BFNH。将半抗原与载体蛋白 (BSA、OVA) 偶联制备了克百威人工免疫抗原 BFNH-BSA 和包被抗原BFNH-OVA。利用BFNHBSA 免疫家兔获得抗克百威多克隆抗体,并通过间接 ELISA 法测定抗体效价。结果表明家兔抗血清效价高 达1.28×106[28]。 1.3 涕灭威半抗原的设计与合成
涕灭威(Aldicarb),化学名称为2-甲基-2-(甲硫基) 丙醛-氧-[(甲胺基)羧基]肟(2-Methyl-2-(Methylthio) propanal-O-[(Methylamino)carbonyl]oxime),分子式为 C7H14N2O2S,相对分子质量为190。它是一种高效、剧 毒、广谱,内吸性的杀虫、杀瞒、杀线虫剂。涕灭威是目 前毒性最大的农药之一,它在环境或生物体内发生氧 化反应生成涕灭威亚砜(Aldicarb sulfoxide)和涕灭威 砜(Aldicarb sulfone),都具有较高的水溶性和毒性,主 要水解产物为涕灭威肟。
由于涕灭威的毒性以及在环境中的不稳定性,关 于涕灭威半抗原的研究相对较少。涕灭威的结构不同 于甲萘威、克百威,因此半抗原的合成方法不同于前 者。1988年Brady等[9]最早开始进行涕灭威半抗原的 制备并开发了酶联免疫技术,建立的方法对涕灭威具 有高度选择性。此半抗原在涕灭威肟分子中引入了反 式-(氨基甲基)-环己烷羧酸,而甲萘威、克百威的半 抗原引入的是直链羧酸。我国学者张彦峰等[10, 29]设计 并合成了一种新的涕灭威半抗原:涕灭威肟琥珀酸单 酯(Aldicarb oxime succinic ester,AOSE),并偶联BSA 制备了多抗。关于涕灭威半抗原,国外最新的研究是 Lai Khai Siew 等[30]制备单抗所合成的半抗原:涕灭威 肟乙酸乙酯(Aldicarb oxime ethyl acetate),并分别偶 联载体蛋白BSA、KLH 形成2 种免疫原,分别得到不 同的单抗,为发展不同的免疫技术提供借鉴。 2 人工抗原的合成与筛选
分子量小于300 的半抗原较难获得高亲和力的 抗体[12],必须设法先将农药小分子与载体蛋白质偶联 制备出农药人工完全抗原,这是农药免疫分析的关 键。人工抗原的合成需要考虑载体蛋白、偶联方法、偶 联结合比等因素的选择与优化。 2.1 载体蛋白的选择
常用来作为合成农药人工抗原的载体蛋白质有 牛血清蛋白(BSA)、卵清蛋白(OVA)、钥孔血蓝蛋白 (KLH)、人血清蛋白(HSA)及人工合成的多聚赖氨酸 (PLL)。此外,阳离子牛血清白蛋白(cBSA)也逐渐在 人工抗原的制备中作为即用型和具有高度免疫原性 的载体蛋白。cBSA 通过过量的乙二胺修饰天然BSA 制备而成,基本上用带正电的伯胺封闭了所有带负电 的羧基基团,其效果是获得了免疫性明显增强、高度 带正电的蛋白质(pI>11)。此外,伯胺数量的增加为使 用典型交联法提供了更大量的可被交联的抗原分子。 当相对于BSA 需要更强的免疫原性,而条件不适合 使用钥孔血蓝蛋白(KLH)时,cBSA 是用于免疫原制 备的优良选择。
一般采用比较多的制备免疫原用的载体蛋白为 BSA,制备包被原用的载体蛋白为OVA。BSA 具有物 化性质稳定、不易变性、价廉易得,而且其赖氨酸含量 高、自由氨基多,在不同的pH 值和离子强度下均有较 大的溶解度等优点。而将OVA作为包被原的载体蛋 白是因为其免疫原性较BSA、KLH 等其他蛋白弱,可 以作为无关的载体蛋白用于抗体的筛选和免疫测定。 KLH 因为其与脊椎动物免疫系统具有很好的异源性 而被认为是很好的载体,但是KLH 价格昂贵,虽然免 疫原性强,但它激发的B 淋巴细胞克隆中针对自身 的抗原决定簇较多,相对减少了针对半抗原的B 淋 巴细胞克隆,增加了阳性克隆筛选的难度和工作量。 因此一般采用BSA、KLH 作为免疫原的载体蛋白,而 OVA 则作为包被原载体蛋白的首选,当然也有学者 采用其他种类的蛋白作为包被原的载体蛋白,如刘曙 照[16]在“甲萘威酶联免疫吸附分析技术研究”中则采 用了HSA、OVA作为包被原的载体蛋白。阳离子化的 载体蛋白可以增强半抗原分子和蛋白的偶联,减小蛋 白间的交联反应,提高免疫效应等优点,现在主要应 用于药物的酶联免疫技术中人工抗原的合成[31],用此免疫原制备了高质量的单抗并建立了高灵敏性的酶 联免疫技术。表 1 列举了部分研究者对3种农药免疫 原所选取的载体蛋白。
在设计好的半抗原的基础上,半抗原与载体蛋白 的偶联,主要考虑偶联方法和偶联结合比2 个重要因 素。 2.2.1 偶联方法的选择
药物或其衍生物分子上的羧基可以通过活化酯 法、碳二亚胺法、混合酸酐法、偶氮苯甲酸法等与蛋白 上的氨基形成酰胺键,其中碳二亚胺法在这类化合物 的偶联反应中的应用最为广泛。但是,碳二亚胺的缩 合反应存在没有选择性、易形成蛋白分子间的自身聚 合、产生非均一性产物等缺点。为了减少蛋白分子间 的自身聚合,可以先将药物分子上的羧基转化为N- 羟基琥珀酰亚胺的活泼酯,然后再与抗体交联,即在 碳二亚胺法基础上改进活化酯法[35]。混合酸酐法是指 半抗原或药物及其衍生物分子中的羧基可以在三乙 胺存在下与氯甲酸异丁酯反应,生成活泼中间体混合 酸酐,然后与蛋白载体上的伯氨基反应,形成酰胺交 联键。本反应过程简单,毋需制备和分离中间产物。偶 氮苯甲酸法是对氨基苯甲酸重氮化后,与带苯环的半 抗原偶联引入羧基,再利用羧基的反应连接于蛋白上。 目前,还没有采用此种方法合成氨基甲酸酯类农药的 人工抗原。其原因可能是采用此方法引入的苯环本身 就具有免疫性,再者引入部分的位置在苯环上,改变 了农药本身的结构,影响针对农药分子抗体的特异 性。
对于载体偶联方法的选择,免疫原及包被原的合 成路线最好不同,另外,用作免疫原的半抗原化学结 构、连接位置、连接臂长及构型应尽量与包被原的半 抗原不同[33],因此免疫原的制备常采用活化酯法,而 包被原的制备常采用混合酸酐法。4 种偶联方法的反 应原理见表 2。
人工抗原中半抗原与载体蛋白的摩尔分子比称 为偶联结合比。除半抗原结构特征外,偶联率也是影 响人工抗原免疫效果的重要因素。适宜的偶联结合 比有助于提高抗体的亲和力和选择性。不同待测 物,不同载体其最佳结合比可能不同。现在一般通过 调节半抗原与载体的摩尔比、反应的pH 值、温度、离 子强度等来控制结合比。半抗原结合比过高或过低均 会影响抗体的生成。低偶联结合比的人工抗原引起的 免疫反应较慢,过高结合比抗原易导致动物免疫麻 痹。刘成梅等[34]认为,完全抗原的偶联结合比在10: 1~25:1 之间为宜。Rinehart等[36]认为最佳偶联结合比 为10:1~20:1。不同人工抗原的最佳结合比可能是不一致的,最好且直接的获取方法是通过免疫实验, 进行最优人工抗原的筛选。
综合以上人工抗原合成的因素,3 种氨基甲酸酯 类农药的部分人工抗原分子的设计、合成与优选归纳 见表 3。
不同种类人工抗原的免疫性,最终需要进行免疫 实验,才能筛选出适宜的人工抗原,为后期特异性抗 体的制备打好坚实的基础。
半抗原修饰物与载体偶联后所得的人工抗原必 须进行纯化,以除去未反应的半抗原小分子、盐类及 其他小分子杂质。最常用的方法是透析和层析法。透 析一般耗时较长(通常需2 d 以上),纯化较为彻底、 操作相对简单。层析法中,常用的有凝胶层析、亲和层 析和离子交换层析,具体采用哪种形式,需要根据偶 联的种类和性质以及对纯化程度的要求来决定。但凝 胶层析耗时较短,但操作相对复杂,需要对流出组分 进行跟踪分析,以确定目标组分。
对纯化后人工抗原进行鉴定,一方面是定性判断 半抗原与载体是否偶联成功;另一方面是定量测定偶 联结合比和蛋白质含量。人工抗原的检测方法主要有 紫外分光光度法、红外吸收光谱法、考马斯亮蓝法、聚 丙烯酰胺凝胶电泳法、标记抗原示踪法、SDS-PAGE 法、ESI-MS 法[32]、MALDI-TOF-MS法等[37]。
鉴定农药人工抗原最常用的方法是紫外光谱扫 描法,如果人工抗原的紫外吸收图谱不同于原载体蛋 白和半抗原的紫外扫描图谱,则证明人工抗原合成成 功[39]。
以最后一次的透析外液作空白,分别将载体蛋 白、半抗原及偶联在波长200~400 nm 进行紫外扫描, 得到各物质最大的吸收波长,如若是在280 nm 处均 有较大吸收,则选择280 nm处波长的OD280值以及浓 度分别计算摩尔吸光系数,按下式估算半抗原与载体 蛋白结合的分子数之比(结合比):
结合比=(e280 偶联物-e280 载体蛋白)/ e280 半抗原[23]
若是得到的3种物质的最大吸收波长相差较远, 可以分别以半抗原、载体蛋白的最大吸收波长扫描得 到的OD,进行结合比的计算[40, 41]。
偶联结合比(n)=(ACam.KBbm -ACbm.KBam)/ (ACbm.KAam -ACam.KAbm)
式中:A、B、C 分别为半抗原、载体蛋白、偶联物; KAam、KAbm、KBam、KBbm、ACam、ACbm 分别为3 种物质在A、B 物质最大吸收波长处的吸光值;分子 消光系数K=A/C。但是,对于最大吸收波长相差不大 的偶联比计算,也可以采用上述方法[42, 43]。紫外分光光度法只能对偶联的结果进行初步判 断,计算中涉及到的偶联物浓度是根据初始加入蛋白 质的浓度进行计算的,且对人工抗原纯化程度以及偶 联物体积不十分精确,因此计算出的结合比也不是精 确的;且紫外分光光度法需要一系列浓度的配制、烦 琐的计算等。质谱法具有灵敏度高、样品用量少、可以 提供样品的精确分子量和结构信息,能与色谱联用、 用于复杂体系的分析等优点,是近年来广泛应用于偶 联物鉴定的新型鉴定方法之一。基质辅助激光解吸- 电离飞行时间质谱法(MALDI-TOF/MS),也被称为生 物质谱,可以直接测定偶联物的相对分子质量,可作 为一种直观的检测方法判定小分子是否与载体蛋白 结合,并可精确计算偶联物结合比。
半抗原与载体蛋白的结合比越(MC-MB)/ MA
式中:A、B分别为半抗原和蛋白质,其比值为偶联结 合比;MA、MB 和MC分别表示半抗原、蛋白、偶联物 的摩尔质量。若是实验室具备仪器条件,生物质谱法无疑是一 种快捷、准确的方法。王莹等[44]用质谱法测定了4 种 真菌毒素与载体蛋白偶联物的结合比。 3 问题与展望
稳定并具有免疫原性的半抗原是农药人工抗原 分子合成的前提和关键。氨基甲酸酯类农药的结构相 对比较简单,都具有氨基甲酸酯的结构,半抗原的合 成具有一定的规律。(1)从农药分子的共性结构(氨基 甲酸酯末端)设计引入连接臂或活性基团,为一大类 农药分子人工抗原的合成提供了可行性,如上述3 种 农药均是在氨基甲酸酯末端水解引入连接臂;(2)借 鉴已合成的半抗原的方法,在结构类似的农药分子上 引入活性基团,合成新的半抗原。例如,克百威与甲萘 威水解后断裂部位相同,参照甲萘威半抗原合成方法 从克百威水解产物呋喃酚入手制备半抗原。异丙威、 仲丁威等半抗原也可以用此种合成方法。
虽然氨基甲酸酯农药的人工抗原合成有可参考的合成路径,但是方法中也存在一些问题:(1)活化酯 法合成免疫原时,水容易被引入而影响实验的成败; (2)传统蛋白的纯化,透析需要经过较长的时间,凝胶 层析所需时间较短,但操作相对复杂;(3)偶联物的定 性方法较为简单,但不能准确判断偶联情况以及结合 比的计算。针对以上问题,需要我们严格控制实验的 操作条件和方法,避免引入其他物质而对目标物质的 形成和保存产生影响;农药人工抗原的合成过程中涉 及有机化学知识,全面系统地掌握化学知识有利于从 根本上掌握人工抗原设计与合成的原理;对于人工抗 原的定性,可以采用ESI-MS,MALDI-TOF-MS 等方 法进行更加快捷、精确的确证。
成功合成高质量的人工抗原是制备特异性抗体 的关键。氨基甲酸酯类农药人工抗原的合成已初见成 效并有一定规律可循,因此,此类农药人工抗原的合 成以及免疫技术的开发与建立将有一个较大的发展。
| [1] | 武中平,高 巍,杨 红,等. 氨基甲酸酯类农药残留测定方法的研究进展[J]. 江苏化工,2004 (5):24-27,53. |
| [2] | 胡芹芹. 蔬菜中氨基甲酸酯类农药残留快速检测技术研究[D]. 武汉:华中师范大学,2009. |
| [3] | Caballo-Lopez A, M D L D. Continuous ultrasound-assisted extractioncoupled to on line filtration -solid -phase extraction -column liquidchromatography-post column derivatisation-fluorescence detection forthe determination of N -methyl carbamates in soil and food[J]. Journal ofChromatography A, 2003,998: 51-59. |
| [4] | 郝学飞,董小海,钟红舰,等. 氨基甲酸酯类农药残留检测方法对比研究[J]. 食品科学,2010 (2):183-186. |
| [5] | Barbora Mickova, Jitka Zrostlikova, Jana Hajslova, et al. Correlationstudy of enzyme-linked immunosorbent assay and high-performanceliquid chromatography/tandem mass spectrometry for the determinationof N-methyl carbamate insecticides in baby food [J]. Analytica ChimicaActa,2003,495: 123-132. |
| [6] | Marco Maria-Pilar, Gee J Shirley, Cheng Hong M, et al. Development ofan enzyme-linked immunosorbent assay for carbaryl[J]. Journal of Agri-cultural Food Chemistry,1993,41:423-430. |
| [7] | Antonio Abad, Angel Montoya. Production of monoclonal antibodies forcarbaryl from a hapten preserving the carbamate group [J]. Journal of A-gricultural and Food Chemistry,1994,42 (8):1818-1823. |
| [8] | Antonio Abad, Mara' Jose' Moreno, Angel Montoya. Development ofmonoclonal antibody-based immunoassays to the N-methyl carbamatepesticide carbofuran[J]. Journal of Agricultural and Food Chemistry,1999,47 (6):2475-2485. |
| [9] | Brady F James, Fleeker R James, Wilson A Richard, et al. Enzyme im-munoassay for aldicarb[J]. American Chemical Society,1988,doi:10.1021:262-284. |
| [10] | 张彦峰,戴树桂,高志贤,等. 杀虫剂涕灭威的半抗原、 抗原和抗体及其制备方法与应用 [P]. 中国:200610013124.9,2007-08-08. |
| [11] | 贲亚琍,朱德锐,刘德立,等. 农药人工抗原合成方法的设计与优选[J]. 农药,2008 (1):10-14. |
| [12] | 张文元,杨亚冬.农药小分子半抗原合成的研究与应用[J]. 农药研究与应用,2007 (6):7-10. |
| [13] | 张 奇. 倍硫磷和速灭威半抗原分子设计及其免疫效果研究[D].南京: 南京农业大学,2007. |
| [14] | 罗永宏,宋 超,陈家长,等. 氨基甲酸酯类农药甲萘威的毒理学及环境归趋研究进展[J]. 江苏农业科学,2012 (1): 316-318,321. |
| [15] | Abad A, Primo J A. Development of an enzyme-linked immunosorbentassay to carbaryl antibody production from several haptens and charac-terization in different immunoassay formats[J]. Journal of AgriculturalFood Chemistry,1997,45: 1486-1494. |
| [16] | 刘曙照,冯 大,钱传范,等. 甲萘威酶联免疫吸附分析技术研究[J]. 农药学学报,1999 (1):62-68. |
| [17] | 许 艇. 杀虫剂西维因单克隆抗体的研制及鉴定[J]. 免疫学杂志,2004 (1): 61-64. |
| [18] | Wang Shuo, Yu Chun-di, Wang Jun-ping, et al. Enzyme immunoassayfor the determination of carbaryl residues in agricultural products[J].Food Additives and Contaminants,2005,22 (8):735-742. |
| [19] | Wang Shuo, Robin D Allan, Amanda S, et al. Rapid enzyme immunoas-says for the detection of carbaryl and methoprene in grains[J]. Journalof Environmental Science and Health part B:-Pesticides Food Con-taminants and Agricultural Wastes, 2002,37 (6): 521-532. |
| [20] | Wang Shuo, Yu Chun-di, Zhang Yan, et al. Tube-immunoassay forrapid detection of carbaryl residues in agricultural products [J]. Journalof Environmental Science,2007,41 (5):693-704. |
| [21] | Miguel A, Gonza'lez-Mart'nez, Sergi Morais, et al. Monoclonal anti-body-based flow-through immunosensor for analysis of carbaryl [J].Analytical Chemistry,1997,69 (14):2812-2818. |
| [22] | 王 硕. 西维因抗体库的构建及特异性克隆的筛选[J]. 食品研究与开发,2012 (7):127-131. |
| [23] | 杨耀军. 西维因人工抗原的合成新方法[J]. 过程工程学报,2005(2):201-204. |
| [24] | 张 灿. 农药西维因快速检测试纸条的研究开发[D]. 天津:天津科技大学,2006. |
| [25] | Dong Ting-ting, Sun Jing-wei, Liu Bing, et al. Development of a sensi-tivity-improved immunoassay for the determination of carbaryl in foodsamples [J]. Society of Chemical Industry,2010,90: 1106-1112. |
| [26] | Zhu Guo-nian, Jin Mao-jun, Gui Wen-jun, et al. Development of adirect competitive enzyme-linked immunoassay for carbofuran in veg-etables [J]. Food Chemistry,2008,107 (4):1737-1742. |
| [27] | Gui Wen-jun, Jin Mao-jun, Sun Li-feng, et al. Residues determina-tion of carbofuran in vegetables based on sensitive time-resolved fluo-rescence immunoassay[J]. Food and Agricultural Immunology,2009,20(1):49-56. |
| [28] | 朱德锐. 呋喃丹半抗原合成与多克隆抗体制备及其检测应用[D].武汉: 华中师范大学,2011. |
| [29] | Zhang Yan-feng, Gao Zhi-xian, Zhang Qing-min, et al. A new haptenfor immunoassay of aldicarb[J]. Chinese Chemical Letters,2006 (8):1021-1024. |
| [30] | Lai Khai Siew, Larry A Winger, Julia A Spoors, et al. Monoclonal an-tibodies useful in sensitive immunoassays for aldicarb in either labora-tory or the field[J]. International Journal of Environmental AnalyticalChemistry,2003,83 (5):417-426. |
| [31] | Chen Jun-Jie, Jiang Jin-Qing. Monoclonal antibody-based solvent tol-erable indirect competitive ELISA for monitoring ciprofloxacin residuein poultry samples[J]. Food and Agricultural Immunology,2013,24 (3):331-344. |
| [32] | Yang Jin-yi, Wu Qing, Wang Hong, et al. Production and identifica-tion of high affinity monoclonal antibodies against pesticide carbofuran[J]. Agricultural Sciences in China,2007 (9):1082-1088. |
| [33] | Yang Jin-yi, Wang Hong, Jiang Yue-ming, et al. Development of anenzyme-linked immuno-sorbent assay(ELISA)method for carbofuranresidues [J]. Molecules,2008,13 (4):871-881. |
| [34] | 刘成梅,黄 丽,罗舜菁,等. 氨苄青霉素人工抗原的制备及鉴定[J]. 生物工程·食品科学,2007,28 (9):384-388. |
| [35] | 龚雄麒,仲伯华. 蛋白质交联方法及其应用[J]. 国外医学·药学分册,1988 (2):65-73. |
| [36] | Rinehart K L, Namikoshi M, Cho B W. Structure and bio-synthesis oftoxins from blue-green alage (cyanobacteria)[J]. Appl Phycol,1994 (6):159-176. |
| [37] | 王悦秋,宋 娟,王榕妹,等. 半抗原的设计、 修饰及人工抗原的制备[J]. 分析化学评述与进展,2010,38 (8):1211-1218. |
| [38] | 杨金易,吴 青,王 弘,等. 高亲和力的农药克百威单克隆抗体的制备及鉴定[J]. 中国农业科学,2007 (3):518-523. |
| [39] | 张丽芳,李伟岭,薛飞群. 人工抗原的鉴定[J]. 畜牧与饲料科学,2009,30 (10):116-117. |
| [40] | 陈建波,王云飞,奚道珍,等. 克百威及其代谢产物残留分析方法研究进展[J]. 农药科学与管理,2011 (3):30-33. |
| [41] | 王 静,魏朝俊,赵建庄,等. 溴氰菊酯人工抗原的合成及偶联比的测定[J]. 北京农学院学报,2006 (4):71-74. |
| [42] | 朱国念,吴银良,程敬丽,等. 克百威人工抗原的合成与鉴定[J]. 浙江大学学报:农业与生命科学版,2002 (1):49-55. |
| [43] | 许 艇,李 季,李兴海,等. 杀虫剂西维因特异性多克隆抗体的制备及鉴定[J]. 农业环境科学学报,2003 (6):758-761. |
| [44] | 王 莹,王希春,金福源,等.质谱法测定 4 种真菌毒素与载体蛋白偶联物的结合比[J].分析检测,2012,33 (2):219-223. |
 2013, Vol. 30
2013, Vol. 30