文章信息
- 张金玲, 李凯, 孙军, 房灵军, 高彦
- ZHANG Jinling, LI Kai, SUN Jun, FANG Lingjun, GAO Yan
- 纳米传感器在食品和水质安全监测方面的应用及展望
- Application and Perspective of Nano-sensors in the Detection of Food and Water Safety
- 农业资源与环境学报, 2013, 30(5): 12-17
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/
-
文章历史
- 收稿日期:2013-05-16
2. 滨州六和隆达农牧有限公司 山东 滨州 256600
2. Binzhou Liuhe Longda Farming Limited,Binzhou,256600, China
近年来,食品和水质安全问题频出,已经成为人 们关注的焦点问题,关系到广大人民群众的身体健康 和生命安全,是急需解决的头等大事。而对食品和水 质安全监测来说,如何获取第一手信息就显得非常重 要。实时、动态监测体系能够更加快速进行危害评估, 对食品和水质等各环节中化学污染物、食源性致病菌 以及食源性疾病可更好地实施布控和预防,及时发现 安全隐患,因此,打造这样一个监测系统是十分必要 的。然而,目前还没有一个真正意义上的全过程监测 系统问世。最近几年已经有大量关于食品和水质监测 的传感器被开发出来,这些仪器和系统都是各种交叉 学科融合的结晶,其中以融合纳米科技的传感器尤为 突出。 1 纳米传感器的优缺点
采用纳米技术开发新的食品和水质安全监测传 感器是目前的一个研究趋势,这是因为纳米尺度的监 测体系具有以下优点:(1 )与传统材料相比,纳米材料 具有更高的面积/体积比,即在其表面进行监测功能化 修饰的效率更高[1, 2, 3, 4, 5];(2)因具有1~100 nm的体积使其 展现更高的灵敏度[6, 7, 8];(3)具有独特的光电性能[9];(4) 纳米材料的高弹性常数使其具有更快的反应速度; (5)对于同它们体积相似的物体可以进行高度密集的 小范围检测。通常用于生物传感器上的纳米材料有纳 米颗粒(如金、硅、磁复合材料、聚合物)[10]、纳米线(如 金、聚合物、复合材料)、纳米多孔表面材料[3]、碳材料 (大部分是纳米管),或者量子点等物质[10]。然而,虽然 这些纳米材料具有许多明显的优点,但仍面临着一些 挑战。例如,纳米材料的高灵敏度来自于其纳米尺寸 的体积,然而因其体积过小(纳米级别),在与被检测 物相互作用时互相吸引碰撞的几率也大大减小。因 此,在利用纳米材料优点的同时还需要增加测量次数 和时间以弥补其不足,尤其是在使用纳米传感器进行 “痕量检测”(10-6或10-9)时,样品需经过预浓缩,否则 检测时间的延长可能会导致更强的背景噪音。遗憾的是,关于针对纳米传感器测试的预浓缩技术报道并不 多见,据我们所知,仅有数篇文献报道[11, 12]。另外,还有 一些纳米传感器,如碳纳米管类传感器,因其纳米材 料是靠范德华力作用制备的[13],测试温度变化也可能 会对检测结果产生一定影响。
将纳米材料与导电聚合物复合在一起制备传感 器是目前研究的一个热点,这是因为该体系更易进行 功能化修饰,引入生物识别元素,进行电讯号的直接 传导及增强其生物的相容性[8]。例如,导电聚合物纳米 颗粒[4]和纳米线[7]可进行分子印迹功能化应用,噬菌体 功能化应用(对沙门氏菌[14]和大肠杆菌[1] 检测),以及 抗体功能化应用(对病毒[15]和细菌[2]免疫检测)等。然 而,该传感器却难以适应复杂环境,这是由于:(1 )大 多难溶于有机溶剂中;(2)机械性能差,且弹簧系数低; (3)电阻率高;(4)驱动电压高;(5)对环境条件,如湿 度、离子、酸碱度、二氧化碳含量等的变化敏感。
微/纳米流体技术或数字微/纳米流体技术为检测 微体积样品提供了可能,也为制备芯片实验室绘制了 美好的蓝图,基于芯片实验室的检测平台具有全自动 化多组分检测、高灵敏度、低成本以及易操作的特 点[16, 17],尤其是在对生物病原菌和寄生虫进行检测时 可以显著地减少样品用量,因此也就减少了人力对这 些病原菌或寄生虫进行辛苦的培育[18]。在这些优点的 驱使下,近几年基于微/纳米流体系统的食品、水质传 感器不断涌现出来[19, 20, 21, 22, 23, 24, 25, 26, 27]。然而这些设备使用起来相当 困难,其中严重限制其应用的问题是生物淤积以及如 何有效地实现宏观外部系统和芯片系统的衔接[28]。 2 纳米传感器在食品和水质检测方面的应用
目前开发出的食品、水质传感器已被用于检测多 种潜在危害,如图 1所示。例如,在美国,弯曲杆菌、沙 门氏菌、李斯特菌以及大肠杆菌等被认为是食品中的 首要致病菌[29],针对这些细菌的传感器研究已经有很 多。在世界范围内,通过水介质传播疾病的病原菌有霍乱弧菌O139、肠出血性大肠杆菌O157颐H、抗氯隐 孢子虫或抗药性绿脓杆菌等[30],在人口增长、迁移以 及社会经济动荡时期时有爆发。与此同时,毒素传感 器也要相应地进行深入研究[31, 32],虽然食品杀菌方法 可以消除很多蛋白毒素,但是有一些热稳定的毒素如 真菌毒素和贝类毒素等即使在煮熟的食品中仍然存 在。近年来,关于蓖麻毒素可被用作生化武器对人类 造成危害的争论一直存在[33],因此,对新型蓖麻毒素 传感器的开发也屡见报道[34, 35, 36, 37]。另外,对食物或水源中 的农药污染检测也是重中之重[38, 39],因为这些污染在 环境中会持续地产生毒性[40]。因此,针对污染物的多 样性,食品和水质传感器的开发既要做到具有针对 性,又要能够对食物源头和环境等进行监测,同时所 开发的传感器更要易于操作。
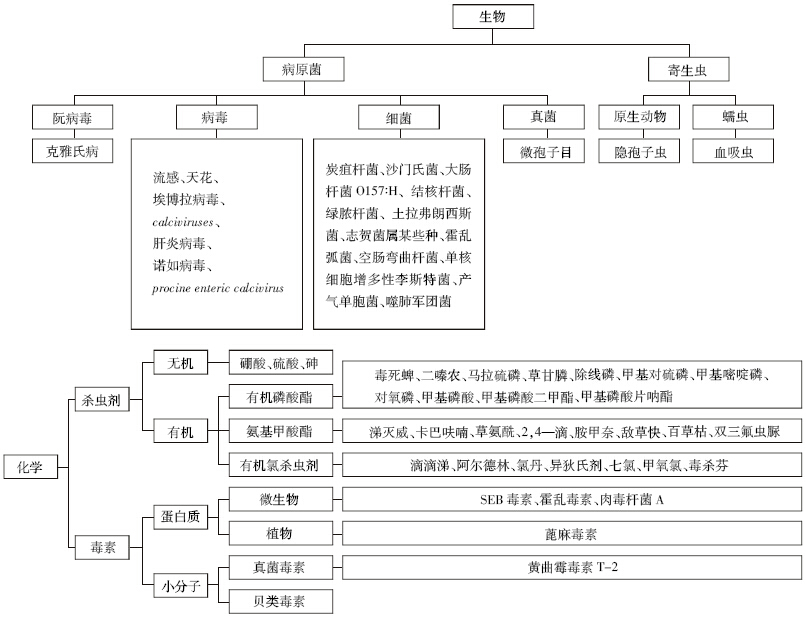
|
| 图 1 目前开发出可用于食品、水质检测的传感器 |
敏感的配体是制备食品、水质传感器的必须物 之一。目前大部分的配体都是生物配体和化学配体, 例如生物催化剂(“锁-钥”模式)[24, 41]和受/配体吸 附[2, 3, 5, 9, 18, 23, 27]技术是较常用的研究技术,它们可对分 子进行高选择性识别。此外,细胞中通过生化途径产 生的细胞响应也可作为检测病原菌和毒素的工具, Banerjee 等[42]对此进行了较详细研究。采用噬菌体的 展示技术对细菌进行检测的方法也有很多报道[1, 43]。 最近,采用融合适体[44, 45]和分子印迹[4, 7]等技术的非生 物仿生学食品、水质传感器也成为研究热点。然而,一 些基于待测物物理特性的配体还很少有人开发,这恰 恰是未来研究的重点。制备传感器的一般步骤是将含 有配体的材料均匀覆盖到传导装置表面,进而使这些 装置对某些特定的生物或化学物质产生信号。物理型 传感器一般是采用通过对样品特性进行直接检测的 方式,若特征明显,则检测结果可作为鉴别被测物的 方法。该方法是对一般使用的化学方法,如酶转化、 受-配体结合、适体或分子印迹的纳米材料等的进一 步补充,一般来说远程检测手段都属于这个范畴。
通过自组装方法制备稳定和耐用的功能化识别 薄膜也是目前研究的热点,但是还存在许多挑战,因 此大家将兴趣转为研究材料内部如待测物独特的光 谱或者热指纹特性等的响应。Wig 等[46]通过光热辐射 和热处理过程制备出了非功能化识别的微悬梁臂,并 对炭疽杆菌进行靶向检测。类似的实例还有采用微换 热器对化学武器进行检测[47],以及采用微量热传感器 来检测热源或者爆炸源等[48, 49]。然而迄今为止,这些方 法在食品或水质检验方面的应用实例并不多见。
理想的传感器应基于材料对识别元素最原始的 响应,经过扩大和过滤,然后产生最低可检测到的信 号(检测限)。目前检测器敏感性和识别准确性之间 的不匹配可能导致检测过程异常灵敏(艾克[50]和仄 克[51]级的检测限),但识别系统却无法识别,例如,表 面声波(SAW)、石英晶体微天平(QCM)、微悬梁臂、 表面等离子共振(SPR),以及其他一些高灵敏度传感 器需要配备相应的化学和物理识别系统,因此,未来 的研究方向之一是要向着消除传感器和识别器之间 的不匹配来进行。最近一些研究结果表明,虽然高灵 敏度的检测器和稳定灵敏的识别元素都可获得,但 是它们之间的通讯问题还需进行深入研究[52]。表 1 列 举了一些对电化学、电磁学、热力学以及纳米力学性 能等环境变量敏感的材料研制而成的食品或水质纳 米传感器。
开发食品或水质传感器的最终目标是建立区域 化的动态监测系统,这些监测系统可以分布在农田 中、食品加工厂以及消费场所等。但在现实世界中建 立这样的系统却是困难重重。例如,食品和饮料的成 分复杂,其中所包含的蛋白质、脂肪、碳水化合物、添 加剂以及在生产制造或消费过程中产生的污染都需 要考虑进去,另外食品或水中的化学或生物污染物也 不均匀。譬如小剂量的有害菌(10~10000个)就会对人 体产生相当大的伤害,但相同量的益生菌株则不会产 生危害,而且这2种类型的细菌经常是同时存在的[41]。 农田、工厂或运输集装箱等多变的环境因素也可能干 扰到传感器检测的稳定性,因为这些地点的温度、压 力、机械性能、化学因素以及电磁因素的变化情况很 难掌握。即使是使用热稳定的传感器,因食品状态如可 能是固体或液体等不同,也要求传感器能够适应一定 的范围。而不同的是,在实验室环境下,食物或水质样 品大多会进行前处理,以便使之适应传感器的检测。
虽然传感器普遍具有很高的灵敏度,但对待测物 的选择性则很差。通常情况下传感器对环境因素的改 变会产生不同程度的响应,或者在相同刺激下识别元 素将响应传导给传感器。样品—传感器之间的传导一 定要同环境因素区别开来,这样就可最大限度地减少 “假阳性”,在增加结果可信度的同时也使定量更为准 确。例如,在温度变化下一些特性,如导电性、弹性、膨 胀系数、阻尼、表面张力、电介质功能、能带隙、噪音等 发生变化的传感器和/或识别元素必须不能影响到对 温度敏感的食品或水样。即使是在相同温度下,pH值、亲水/亲油性的改变以及机械性能的改变也会对 传感器产生影响[14],因此,理想的传感器需要只对识 别元素产生响应而不会被环境所影响。这对于开发可 移动检测装置来说就是较大的挑战。
随着检测手段不断增多,检测条件也开始变得更 加宽松,食品或水质传感器装置可以在现实环境中直 接应用于样品检测,例如直接对西红柿[53]、牛奶[54]、牛 肉[55]以及菠菜[56]等检测。Horgan 等[57]认为虽然新的检 测方法在选择性、灵敏度和检测限方面都有明显提 高,但是对于检测器的评估还需考虑一些组织和机构 如临床实验室标准化协会等的意见。食品或水质传感 器也要经由受试者工作特征(ROC)分析来评估,这与 采用ROC 评估免疫生物传感器在医学中的应用类 似[58]。一个理想的食品、水质传感器应该具有良好的 ROC 曲线,并且适用于任何场地或环境。 4 展望
未来的研究应将传感器平台和识别元素更加紧 密地结合起来,更加注重传统分析方法和纳米化非 传统方法的结合。为了适应食品和水质检测中污染 物种类繁多的情况,未来开发的传感器应融合光 学、机械学以及化学模型为一体,更大程度地扩展 其检测范围,同时新型物理型(非受体)检测器也应 大力开发。在食品或水质传感器方面的研究成果对 于食品科学、粮食安全、农业生产率以及质量方面[58] 都会有着极大的促进作用,而且这些研究对于实现 食品工业的纳米化,制备纳米食品方面也有着良好 的推动作用[59]。另外,在纳米科技领域的任何突破性 发现都可能用于食品、水质传感器开发,这些发现 或多或少的能给打破传感器使用中的某种局限提供 方法。
模仿人类嗅觉的“电子鼻”也是目前研究的热点 之一[55]。通过分子识别(锁-钥分子配对或电子量子轨 道程序[60])来进行检测的“电子鼻”可以将可食用的和 不可食用的食材分开,用于防止食物早期腐害。在未 来的个人消费领域,它可以组装到一些常见的装置 上,例如冰箱温度感应器、婴儿用品或者手机上来辨 别食材的新鲜程度。 5 结论
目前食品和水质传感器的发展仍面临着多方面 挑战。虽然在实验室里其选择性和灵敏度已经取得了 很大进展,但是仍很少有将其置于现实环境中进行检 测的报道。在未来的研究中,不仅应加强对传感器的 基础研究,尤其是将传感器的灵敏度和识别元素对于 待测物的识别效率匹配起来,同时减少环境因素对于 传感系统的影响,而且更重要的是开发出适用于各种 环境的检测终端。
| [1] | Arter J A,Taggart D K,McIntire T M. Virus-PEDOT nanowires for biosensing[J].NANO LETTERS,2010.4858-4862. |
| [2] | García-Aljaro C,Bangar M A,Baldrich E. Conducting polymer nanowire-based chemiresistive biosensor for the detection of bacterial spores[J].Biosensors and Bioelectronics,2010.2309-2312. |
| [3] | Luo Y,Nartker S,Miller H. Surface functionalization of electro-spun nanofibers for detecting E. coli O157:H7 and BVDV cells in a di-rect-charge transfer biosensor[J].Biosensors,2010.1612-1617. |
| [4] | Morelli I,Chiono V,Vozzi G. Molecularly imprinted submicron-spheres for applications in a novel model biosensor-film[J].Sensors and Actuators B-Chemical,2010.394-401. |
| [5] | 刘蓉,薛文通,张惠. 浅析生物传感器在食品分析中的应用[J].食品工业科技,2009,(11):318-321. |
| [6] | Alvarez M,Lechuga L M. Microcantilever-based platforms as biosensing tools[J].A nalyst,2010.827-836. |
| [7] | Berti F,Todros S,Lakshmi D. Quasi-monodimensional polyaniline nanostructures for enhanced molecularly imprinted polymer-based sens-ing[J].Biosensors,2010.497-503. |
| [8] | Hangarter C M,Bangar M,Mulchandani A. Conducting polymer nanowires for chemiresistive and FET-based bio/chemical sensors[J].Journal of Materials Chemistry,2010.3131-3140. |
| [9] | Chang Y-F,Wang S-F,Huang J C. Detection of swine-origin influenza A(H1N1)viruses using a localized surface plasmon coupled fluorescence fiber- optic biosensor[J].Biosensors and Bioelectronics,2010.1068-1073. |
| [10] | Kaittanis C,Santra S,Perez J M. Emerging nanotechnology-based strategies for the identification of microbial pathogenesis[J].Advanced Drug Delivery Reviews,2010.408-423. |
| [11] | Farahi R H,Passian A,Ferrell T L. Microfluidic manipulation via Marangoni forces[J].Applied Physics Letters,2004.4237-4239. |
| [12] | Li D,Li D-W,Fossey J S. Portable surface-enhanced raman scattering sensor for rapid detection of aniline and phenol derivatives by on-site electrostatic preconcentration[J].Analytical Chemistry,2010.9299-9305. |
| [13] | Tetard L,Passian A,Farahi R H. Spectroscopy and atomic force microscopy of biomass[J].ULTRAMICROSCOPY,2010.701-707. |
| [14] | Dadarwal R,Namvar A,Thomas D F. Organic conducting polymer electrode based sensors for detection of Salmonella infecting bacterio-phages[J].Mater Sci Eng C Mater Biol Appl,2009.761-765. |
| [15] | Shirale D J,Bangar M A,Park M. Label-free chemiresistive im-munosensors for viruses[J].Environmental Science and Technology,2010,(23):9030-9035. |
| [16] | Yager P,Edwards T,Fu E. Microfluidic diagnostic technologies for global public health[J].NATURE,2006.412-418. |
| [17] | Mark D,Haeberle S,Roth G. Microfluidic lab-on-a-chip plat-forms:requirements,characteristics and applications[J].Chemical So-ciety Reviews,2010.1153-1182. |
| [18] | Mairhofer J,Roppert K,Ertl P. Microfluidic systems for pathogen sens-ing:a review[J].SENSORS,2009,(09):4804-4823. |
| [19] | Ricciardi C,Canavese G,Castagna R. Integration of microfluidic and cantilever technology for biosensing application in liquid environ-ment[J].Biosensors&Bioelectronics,2010.1565-1570. |
| [20] | Piliarik M,Parova L,Homola J. High-throughput SPR sensor for food safety[J].Biosensors&Bioelectronics,2009.1399-1404. |
| [21] | Peng Z,Soper S A,Pingle M R. Ligase detection reaction genera-tion of riverse molecular beacons for near real-time analysis of bacteri-al pathogens using single-pair fluorescence resonance energy transfer and a cyclic olefin copolymer microfluidic chip[J].Analytical Chemistry,2010.9727-9735. |
| [22] | Narakathu B B,Atashbar M Z,Bejcek B E. Improved detection limits of toxic biochemical species based on impedance measurements in elec-trochemical biosensors[J].Biosensors &Bioelectronics,2010.923-928. |
| [23] | Mujika M,Arana S,Castano E. Magnetoresistive immunosensor for the detection of Escherichia coli O157:H7 including a microfluidic network[J].Biosensors&Bioelectronics,2009.1253-1258. |
| [24] | Heinze B C,Gamboa J R,Kim K. Microfluidic immunosensor with integrated liquid core waveguides for sensitive Mie scattering detection of avian influenza antigens in a real biological matrix[J].Analytical and Bioanalytical Chenistry,2010.2693-2700. |
| [25] | Dykstra P,Hao J,Koev S T. An optical MEMS sensor utilizing a chitosan film for catechol detection[J].Sensors and Actuators B:Chem-ical,2009.64-70. |
| [26] | Do J,Ahn C H. A polymer lab-on-a-chip for magnetic immunoassay with on- chip sampling and detection capabilities[J].Lab on a Chip,2008,(08):542-549. |
| [27] | Cretich M,Sedini V,Damin F. Functionalization of poly(dime thylsiloxane) by chemisorption of copolymers:DNA microarrays for pathogen detection[J].Sensors and Actuators B-Chemical,2008.258-264. |
| [28] | Freimund D L,Aflatooni K,Batelaan H. Observation of the Kapitza-Dirac effect[J].NATURE,2001.142-143. |
| [29] | Chemburu S,Wilkins E,Abdel-Hamid I. Detection of pathogenic bac-teria in food samples using highly- dispersed carbon particles[J].Biosensors and Bioelectronics,2005.491-499. |
| [30] | Sharma S,Sachdeva P,Virdi J S. Emerging water-borne pathogens[J].Applied Microbiology and Biotechnology,2003.424-428. |
| [31] | Zhu S,Du C,Fu Y. Localized surface plasmon resonance-based hybrid Au Ag nanoparticles for detection of Staphylococcus aureus enterotoxin B[J].Optical Materials,2009.1608-1613. |
| [32] | Tetard L,Passian A,Farahi R H. Optomechanical spectroscopy with broadband interferometric and quantum cascade laser sources[J].Optics Letters,2011.3251-3253. |
| [33] | Schep L J,Temple W A,Butt G A. Ricin as a weapon of mass terror-Separating fact from fiction[J].Environment International,2009.1267-1271. |
| [34] | Zhuang J,Cheng T,Gao L. Silica coating magnetic nanoparticle-based silver enhancement immunoassay for rapid electrical detection of ricin toxin[J].TOXICON,2010.145-152. |
| [35] | Suresh S,Gupta A K,Rao V K. Amperometric immunosensor for ricin by using on graphite and carbon nanotube paste electrodes[J].Ta-lanta,2010.703-708. |
| [36] | Melchior W B Jr,Tolleson W H. A functional quantitative polymerase chain reaction assay for ricin,Shiga toxin,and related ribosome-inac-tivating proteins[J].Analytical Biochemistry,2010.204-211. |
| [37] | Bevilacqua V L,Nilles J M,Rice J S. Ricin activity assay by di-rect analysis in real time mass spectrometry detection of adenine re-lease[J].Analytical Chemistry,2010.798-800. |
| [38] | Du D,Huang X,Cai J. An amperometric acetylthiocholine sensor based on immobilization of acetylcholinesterase on a multiwall carbon nanotube-cross-linked chitosan composite[J].Analytical and bioana-lytical chemistry,2007.1059-1065. |
| [39] | 干宁,王峰,杨欣. 采用纳米修饰双酶电极生物传感器检测有机膦与氨基甲酸酯类农药[J].农药学学报,2008,(10):329-334.doi:10.3321/j.issn:1008-7303.2008.03.013. |
| [40] | Jiang X,Li D,Xu X. Immunosensors for detection of pesticide residues[J].Biosensors&Bioelectronics,2008.1577-1587. |
| [41] | Mandal P K,Choi A K B K,Pal U K. Methods for rapid detection of foodborne pathogens:An overview[J].American Journal of Food Tech-nology,2011,(06):87-102. |
| [42] | Banerjee P,Bhunia A K. Mammalian cell -based biosensors for pathogens and toxins[J].Trends in Biotechnology,2009.179-188. |
| [43] | Mao C,Liu A,Cao B. Virus-Based Chemical and Biological Sensing[J].Angew Chem Int Ed,2009.6790-6810. |
| [44] | Tombelli S,Minunni M,Mascini M. Analytical applications of aptamers[J].Biosensors&Bioelectronics,2005.2424-2434. |
| [45] | Ding S,Gao C,Gu L-Q. Capturing Single molecules of immunoglobulin and ricin with an aptamer-encoded glass nanopore[J].Analytical Chem-istry,2009.6649-6655. |
| [46] | Wig A,Arakawa E T,Passian A. Photothermal spectroscopy ofBacillus anthracis and Bacillus cereus with microcantilevers[J].Sensors and Actuators B-Chemical,2006.206-211. |
| [47] | Taylor C J C R E,V E W,Ellzy M W. Chemical warfare agent de-tection using MEMS-compatible microsensor arrays[J].Sensors Jour-nal,2005.712-725. |
| [48] | Senesac L R,Yi D,Greve A. Micro-differential thermal analysis detection of adsorbed explosive molecules using microfabricated bridges[J].The Review of scientific instruments,2009,(03):035102. |
| [49] | Greve A,Olsen J,Privorotskaya N. Micro-calorimetric sensor for vapor phase explosive detection with optimized heat profile[J].Micro-electronic Engineering,2010.696-698. |
| [50] | Tetard L,Passian A,Eslami S. Virtual resonance and frequency difference generation by van der Waals interaction[J].Physical Review Letters,2011,(18):180801. |
| [51] | Tetard L,Passian A,Farahi R H. Atomic force microscopy of sili-ca nanoparticles and carbon nanohorns in macrophages and red blood cells[J].ULTRAMICROSCOPY,2010.586-591. |
| [52] | Kim S,Yi D,Passian A. Observation of an anomalous mass effect in microcantilever-based biosensing caused by adsorbed DNA[J].Ap-plied Physics Letters,2010,(15):153703. |
| [53] | Concina I,Falasconi M,Gobbi E. Early detection of microbial contamination in processed tomatoes by electronic nose[J].Food Con-trol,2009.873-880. |
| [54] | Suarez G,Jin Y H,Auerswald J. Lab-on-a-chip for multiplexed biosensing of residual antibiotics in milk[J].Lab on a Chip,2009,(09):1625-1630. |
| [55] | Arshney M,Li Y,Srinivasan B. A label-free,microfluidics and interdigitated array V microelectrode-based impedance biosensor in combination with nanoparticles immunoseparation for detection of Es-cherichia coli O157:H7 in food samples[J].Sensors and Actuators B-Chemical,2007.99-107. |
| [56] | Leach K M,Stroot J M,Lim D V. Same-day detection of Escherichia coli O157:H7 from spinach by using electrochemiluminescent and cy-tometric bead array biosensors[J].Applied and Environmental Microbi-ology,2010.8044-8052. |
| [57] | Horgan A M,Moore J D,Noble J E. Polymer- and colloid-me-diated bioassays,sensors and diagnostics[J].Trends in Biotechnology,2010.485-494. |
| [58] | Lee W S,Alchanatis V,Yang C. Sensing technologies for preci-sion specialty crop production[J].Computers and Electronics in Agri-culture,2010,(01):2-33. |
| [59] | Chun A L. Will the public swallow nanofood[J].Nature Nanotechnolo-gy,2009,(04):790-791. |
| [60] | 刘宁晶,史波林,赵镭. 电子鼻检测技术研究进展[J].食品科技,2012,(10):248-252. |
 2013, Vol. 30
2013, Vol. 30